基于综合数据库分析ASXL1基因突变对子宫内膜癌预后的影响及作用机制
2021-07-05范玥韩馨乐杜俊
范玥 韩馨乐 杜俊
子宫内膜癌(Endometrial carcinoma,EC)是女性第六大常见的恶性肿瘤。近年来,发病率持续上升并呈现年轻化趋势,严重威胁女性健康[1]。根据2015年中国癌症数据分析显示子宫内膜癌预计年发病率为60/10万,死亡率约为20/10万,发病率也呈逐年上升趋势[2]。2013年,人类癌症基因组图谱(The cancer genome atlas,TCGA)根据不同突变方式和拷贝数将EC划分为4种分子分型,即POLE(DNA聚合酶ε)突变型、微卫星不稳定高突变型、低拷贝数型和高拷贝数型。该分子分型对预后判断及精准治疗有重要意义,但也存在局限性[3,4]。在肿瘤精准治疗的背景下,探讨基因突变的预后意义及作用机制,对靶向治疗的靶点选择具有重要参考意义。ASXL1(Additional sex combs like 1)基因首次于2009年在骨髓增生异常综合征(MDS)中报道[5],其位于染色体20q11,靠近DNMT3B基因[6],由12个外显子组成。根据既往研究,ASXL1基因突变在血液系统髓系肿瘤中是预后不良的生物学标志物[7],包括骨髓增殖性肿瘤(MPN)、骨髓增生异常综合征(MDS)、慢性粒单核细胞白血病(CMML)和急性髓系白血病(AML)等。然而,ASXL1在EC中的预后意义鲜有报道,其相关机制仍有待研究。本研究旨在通过多种肿瘤综合数据库,分析ASXL1基因突变在EC患者中的预后意义及可能的作用机制,为EC的精准治疗提供参考依据。
1 材料与方法
1.1 数据来源与方法基于GEPIA数据库(http://gepia.cancerpku.cn/)分析ASXL1基因突变在EC患者中的预后意义及其与临床分期的关系。同时,通过获取在EC中与ASXL1有相似表达特征的前200个基因,对其信号通路相关性及蛋白质互作网络做了进一步分析。
基于Kaplan-Meier plotter数据库(https://kmplot.com/analysis/),汇总ASXL1基因突变在EC患者中的预后意义,包括总生存期(Overall survival,OS)与无复发生存期(Relapse-free survival,RFS)。通过将ASXL1基因突变截分为高低两组,比较两组的生存差异,并进一步计算危险比(Hazard ratio,HR)、95%置信区间(95%CI)以及P值。
基于FireBrowse网站(http://www.firebrowse.org/),分析ASXL1的基因表达、DNA甲基化、拷贝数变异和突变状态。同时,基于人类蛋白质图谱图像分类数据库(Human Protein Atlas),ASXL1的组织、器官分布情况得以呈现,也对ASXL1的亚细胞定位进行分析。
STRING数据库(https://string-db.org/)作为在线检索已知蛋白质互作关系的数据库,可对直接或间接的蛋白质互作网络进行功能分析。基于STRING数据库,纳入50个表达量相对较高的相关因素,结合Cytoscape软件,进行蛋白质互作网络分析(Protein-protein interaction network,PPI)。纳入分析的最小相关性分数为0.400。
UALCAN数据库(http://ualcan.path.uab.edu)是基于TCGA数据库在线分析和挖掘的网站。分析ASXL1基因在不同种族、年龄、更年期状态以及组织学亚型EC患者中的表达水平。
DAVID数据库(https://david.ncifcrf.gov/)是基于Annotation Tool,GoCharts,KeggCharts以及Domain Charts四个分析模块实现对数据的注释、可视化和集成发现,从而实现基因组规模数据集的分析。通过其在线分析功能,对ASXL1基因突变密切相关的生物学过程以及富集的信号通路进行初步探究。
1.2 统计学方法采用SPSS 25.0软件(SPSS,Inc.,Chicago,IL,USA)进行统计学分析。计量数据以均数±标准差(±s)表示,采用双侧t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 EC患者中ASXL1基因突变状态及分布差异GEPIA数据库检索结果显示ASXL1基因在多种肿瘤组织中异常表达,其中在EC中表达降低,见图1。UALCAN数据库检索结果显示ASXL1基因在不同种族、年龄、更年期状态以及组织学类型中的分布差异。与正常组相比,年龄21~40岁组和41~60岁组中ASXL1基因水平有所降低(P<0.001),各种族人群比较显示高加索人群中EC患者ASXL1基因水平低于正常人群(P<0.001),其余人种无统计学差异。绝经前人群中EC患者ASXL1基因水平明显低于正常对照组(P<0.001)。根据不同组织学亚型进行分组,EC中ASXL1基因水平明显降低,而浆液性癌与之相反(P<0.001),见图2。

图1 不同肿瘤类型与正常对照组织中ASXL1基因的表达情况
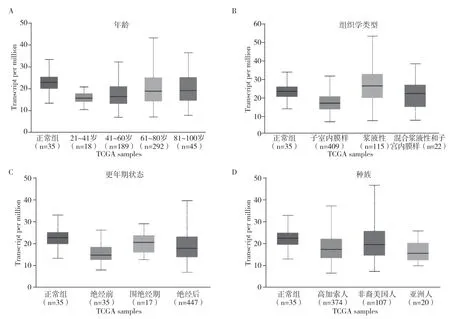
图2 ASXL1基因在不同年龄、组织学类型、更年期状态以及种族间的分布差异
利用The Human Protein Atlas数据库追踪ASXL1基因的亚细胞定位,发现ASXL1基因主要定位于细胞的核质和核仁。通过FireBrowse网站分析了538例EC患者的基因表达情况,发现突变水平较高的基因主要包括PTEN、PIK3CA、ARID1A、PIK3R1、CTNNB1、TP53、KRAS等,其突变类型主要为无义突变和错义突变。
2.2 ASXL1基因突变在EC预后中的意义通过Kaplan-Meier Plotter数据库根据log-rank法及生存曲线比较,显示升高的ASXL1 mRNA水平与缩短的OS及RFS相关(P<0.001)。通过GEPIA数据库检索结果发现ASXL1突变在不同时期肿瘤中存在差异,处于疾病进展期(Ⅲ、Ⅳ期)的EC患者较疾病初期(Ⅰ、Ⅱ期)的患者有所升高,见图3。

图3 ASXL1基因表达水平与OS、RFS及肿瘤分期之间关系
2.3 EC患者中ASXL1基因的突变状态及功能预测在GEPIA数据库检索,获取TCGA及GTEx测序数据中前200位与ASXL1有相似表达特征的基因,并通过Pearson相关系数对这些基因进行排序。采用GO分析及KEGG分析对ASXL1突变相关基因进行功能富集分析及信号通路预测。通过DAVID数据库(https://david.ncifcrf.gov/),发现与ASXL1突变密切相关的生物学过程主要包括DNA转录、RNA处理、RNA剪接等;蛋白质结合、组蛋白结合、DNA结合、转录共激活因子活性、序列特异性DNA结合等分子功能的改变与ASXL1基因突变有关;而核质、驱动蛋白复合物等细胞组分的改变与ASXL1基因异常表达有关。通过KEGG分析,这些相关基因突变主要与mTOR信号通路调节相关。见图4。

图4 GO分析与ASXL1基因异常表达有关的生物学过程(左)、细胞组分(中)和分子功能(右)之间的关系
2.4 PPI及ASXL1基因的相关性分析选取前50位与ASXL1有相似表达情况的相关基因,通过STRING数据库(https://string-db.org/)在线分析以及Cytoscape软件的可视化绘图,进行了PPI分析。表观遗传学相关改变与ASXL1存在相互作用关系,包括HDAC2、DNMT3A、CBX家族以及TET2,见图5。另外,在GEPIA数据库中,通过TCGA及GTEx的数据集对ASXL1突变存在密切关系的基因做相关性分析。ASXL1基因突变与PTEN、PIK3CA、JAK2、STAT3及TET2多个基因存在正相关,其中PTEN(r=0.55,P<0.001)、PIK3CA(r=0.73,P<0.001)、JAK2(r=0.66,P<0.001)、STAT3(r=0.6,P<0.001)以及TET2(r=0.63,P<0.001),见图6。

图5 ASXL1与相似基因表达的蛋白质互作图

图6 TET2、PTEN、PIK3CA、JAK2、STAT3基因与ASXL1表达的相互关系
3 讨论
本研究显示ASXL1在EC中存在基因突变。通过GEPIA和Kaplan-Meier plotter数据库的生存分析发现ASXL1基因突变是EC的不良预后因素,与OS和RFS均存在相关。虽然ASXL1基因突变在EC中的预后价值极少报道,但从公共数据库的大样本分析看,该基因的突变状态确实对生存造成了威胁。作为肿瘤抑制基因,ASXL1的缺失也是结直肠肿瘤(Colorectal cancer,CRC)中的不良预后因子[8]。有学者在结直肠样本(408例结直肠癌、46例正常结肠粘膜、48例腺瘤及92例癌性淋巴结)中发现,ASXL1的缺失造成5年生存率明显低于正常组(78.7%±2.5% vs 100%,P=0.034)。并且,在结直肠正常组织→腺瘤→腺癌→癌性淋巴结转移发展的过程中,ASXL1基因缺失的比例也逐渐增加[8]。这表明ASXL1作为抑癌基因的缺失状态是肿瘤患者的不良预后因素,其可能与淋巴结转移相关,使得疾病更具侵袭性。在我们的分析中,ASXL1突变不仅是预后不良因素,且在疾病晚期的患者中突变率显著升高。这提示在EC中ASXL1突变同样与疾病严重程度相关,是评判临床预后的重要指标。
ASXL1基因突变如何发挥功能、影响预后,仍然缺乏可靠的基础生物学研究。通过GO分析及KEGG分析,我们发现ASXL1参与的生物学过程主要包括DNA转录、RNA处理、RNA剪接等。结合相关性分析可以发现ASXL1与PTEN、PIK3CA、JAK2及STAT3基因存在相关性,ASXL1可能与PI3K/mTOR信号通路调节有关。众所周知,PI3K/AKT/mTOR细胞内信号传导途径调节重要的细胞周期。PI3K(The phosphatidylinositol 3-kinase)是一类高度保守的酶家族,是胞内PI3K/AKT/mTOR信号轴的重要组成部分。PI3K/AKT/mTOR信号通路在细胞的生长、分化、凋亡等方面都发挥着重要作用,其中信号转导的很多成员分子,都是癌症、免疫及控制血栓形成等过程中的关键药物靶点[9]。PI3K激活磷酸化并激活AKT,使其定位在质膜上。AKT可以具有许多下游效应,如激活CREB,抑制p27,在细胞质中定位FOXO,激活PtdIns-3ps和激活mTOR可能会影响p70或4EBP1的转录。而肿瘤抑制基因PTEN能够通过去磷酸化而使PIP3变为PIP2,是该通路的负性调节因子[10]。在我们的分析中,ASXL1基因突变与PI3K/AKT/mTOR信号通路激活相关,且与PTEN基因突变存在正相关性,表明两者可能发挥了协同致病的效应,共同导致疾病不良预后。
近年来,肿瘤的分子生物学检测尤其是高通量测序,为精准治疗创造了必要条件[11~13]。基于我们对EC的肿瘤数据库挖掘,以及生物信息学预测,干预PI3K/AKT/mTOR信号通路可能为患者治疗带来益处,尤其是对复发/转移的EC患者。PI3K存在4种异构体,其信号协同有所差异,但最终与PTEN突变有重要关系,导致癌症发生。PI3K下游存在两条重要通路,其中FOXO主要与细胞分化有关,而mTORC主要与细胞增殖有关[14]。目前关于PI3K/AKT/mTOR信号通路的靶向干预治疗报道较多,包括单独或联合靶向PI3K异构体以及靶向mTOR的药物[15]。目前临床可及的药物包括PI3K抑制剂(Idelalisib、Infinity等)及mTOR抑制剂(雷帕霉素)。由于诸多恶性肿瘤中普遍存在PI3K/AKT/mTOR信号通路异常,包括实体瘤和血液恶性肿瘤[9],故而以该通路为靶点研发肿瘤抑制剂也是研究热点。但是,在其他实体肿瘤的研究中,我们发现PI3K/AKT/mTOR单靶点抑制剂很难产生显著、可持续的治疗效应,而联合用药成为重要的研究方向[16~18]。目前,探索PI3Kα/mTOR双靶点药物如NVP-BEZ235、PI3Kα/δ/γ/PDK1双靶点抑制剂等,均在实体肿瘤及血液病研究中存在巨大潜力,可能有可观的临床疗效,具备应用前景[19]。
本研究通过肿瘤综合数据库,发现ASXL1基因突变与EC患者不良预后有关,是重要的临床预后参考指标,动态监测基因突变状态也有助于评估疾病进展状态。同时,通过生物信息学分析,我们发现ASXL1基因突变可能与PI3K/AKT/mTOR信号通路调节有关,这表明靶向该通路的抑制剂可能成为潜在有效的治疗方式,尤其是对于复发/进展的患者。不过本研究仍存在局限性:①本研究纳入的人群为EC患者,来自于特定的国家和地区,可能缺乏种族特异性;②本研究通过公共数据库生物信息学分析,缺乏严谨可靠的生物学验证,其真实性仍然值得进一步研究;③基因测序的数据样本量中等,在真实世界能否重现ASXL1突变的临床预后意义,需要临床队列进行验证。
综上所述,我们通过多个肿瘤相关数据库,发现ASXL1基因突变是EC患者的不良预后因素,显著影响OS及RFS,且与PI3K/AKT/mTOR信号通路有关。靶向该通路可能成为新的治疗选择,为复发/进展的EC患者带来福音[20],但需要严谨的生物学验证以及前瞻性的临床试验证实。总之,探索ASXL1基因突变的预后意义及作用机制,可能成为未来EC精准治疗的新研究方向。
