罗汉果内生菌中乙醇降解菌株的筛选及其发酵条件优化
2021-07-04周巧丽胡梦琪赵丰丽
付 强,王 琪,周巧丽,金 岳,胡梦琪,赵丰丽,2
(1.广西师范大学 生命科学学院,广西 桂林 541006;2.珍稀濒危动植物生态与环境保护教育部重点实验室,广西 桂林 541006)
罗汉果是中国广西特色经济作物,为葫芦科多年生宿根性藤本植物罗汉果的果实,含有三萜、黄酮、木脂素、呋喃、糖类、脂肪酸、甾体等,具有降糖、降脂、免疫调节、抗氧化等功效[1-3]。目前,我国对中药降解乙醇作用的利用研究日益增多,如利用葛花、葛根和枳椇子为原料,得到降解乙醇效果较好的产品,可有效的降低酒精对人体带来的伤害[4-9]。目前我国市场上的解酒产品,多以对中草药的开发为主[10-14],利用罗汉果内生菌进行降解乙醇的研究较少。
植物内生菌是植物微生态系统的重要组成部分[15-16],在长期协同进化过程中,与植物形成和谐共生,互惠互利的关系[17-18]。从罗汉果内生菌中,张昌志等[19]筛选出了高效产环糊精葡萄糖基转移酶的菌株;范彩琴等[20]筛选出多株具有良好抗氧化活性的菌株;龙楚媚[21]分离得到了一株具有高效降糖活性的菌株,表明罗汉果内生菌所产代谢产物具有多重功效。在内生菌降解乙醇能力研究方面,高慧[22]从韩国泡菜制品中筛选出一株具有良好降解乙醇能力的厌氧菌;孙志一等[23]从12种中草药中分离纯化得到5株降解乙醇能力较强的芽孢杆菌,展现出内生菌降解乙醇的潜力。
因此,本研究通过传统培养分离法从罗汉果中分离内生菌,采用测定乙醇耐受性和重铬酸钾-硫酸法从中筛选具有降解乙醇能力的菌株,通过形态观察及分子生物学技术对其进行鉴定,并以乙醇降解率为评价指标,通过单因素试验及正交试验对其发酵条件进行优化。以期为具有降解乙醇功能的产品提供一个新的途径,为工业生产产品奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
罗汉果:植株采自广西桂林市龙胜县。
1.1.2 主要试剂
重铬酸钾(分析纯):阿拉丁试剂(上海)有限公司;葡萄糖、浓硫酸、无水乙醇(均为分析纯):西陇化工股份有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
马铃薯葡萄糖琼脂(potatodextroseagar,PDA)培养基[20]:土豆200 g,切块,煮沸30 min,过滤,葡萄糖20 g,琼脂20 g,蒸馏水定容至1 L。
发酵培养基[20]:PDA培养基去除琼脂。
初筛培养基[21]:硫酸镁0.3 g、磷酸二氢钾1.0 g、氯化钠0.1 g、硫酸铵5 g、氯化铁0.01 g、琼脂22 g,蒸馏水定容至1 L,pH=7.0。灭菌完成后,待培养基冷却至50 ℃,加入8%无水乙醇。
沙氏葡萄糖液体(Sabouraud dextrose broth,SDB)培养基[20]:葡萄糖40 g,胰蛋白胨10 g,酵母粉5 g,麦芽糖5 g,蒸馏水定容至1 L。
沙氏培养基(Sabouraud dextrose medium with yeast extract,SDY)[20]:葡萄糖40 g,胰蛋白胨10 g,酵母浸膏2 g,氯化钠0.5g,磷酸二氢钾0.5g,七水硫酸镁0.5g,蒸馏水定容至1L。
胨酵母浸膏葡萄糖(peptone yeast extract glucose,PYG)培养基[20]:胰蛋白胨10 g,酵母浸膏5 g,葡萄糖20 g,蒸馏水定容至1 L。
以上培养基的灭菌条件均为121℃高压蒸汽灭菌30min。
1.2 仪器与设备
BXM-30R型立式压力蒸汽灭菌锅:上海博讯实业有限公司医疗设备厂;HZ200LB型恒温摇床、HP400S型生化培养箱:武汉瑞华仪器设备有限责任公司;Infinite M200Pro酶标仪:帝肯(上海)贸易有限公司;KQ-500VDE型双频数控声波清洗器:昆山市超声器有限公司。
1.3 方法
1.3.1 罗汉果内生菌分离纯化
按参考文献[24]中的方法对罗汉果组织进行消毒,将处理后的材料剪碎接种到PDA培养基上,置于28 ℃恒温培养箱中培养,待菌落长成后,进行分离纯化,得到罗汉果内生菌株。
1.3.2 乙醇降解菌的初筛
在无菌条件下,用划线法将菌株接种于初筛培养基平板上,置于28 ℃恒温培养箱中培养,定期观察菌落生长情况。挑选生长情况良好(即耐受乙醇)的菌株即为初筛菌株。
1.3.3 乙醇降解菌的复筛
将初筛菌株接种于发酵培养基,装液量100 mL/250 mL,30 ℃、130 r/min条件下发酵培养5 d,获得菌株的发酵液用于复筛。
快速降解乙醇能力的测定:将待测菌株的发酵液500μL加入含8%乙醇的5mL发酵培养基中,混匀后37℃水浴反应1h。
缓速降解乙醇能力的测定:将待测菌株的发酵液500μL分别加入到体积分数分别为10%和20%乙醇的5 mL发酵培养基中,混匀后37 ℃水浴反应24 h。
两组试验的对照均为水代替发酵液,利用重铬酸钾-硫酸法[25]测定乙醇的残留量,计算乙醇降解率,其计算公式如下:

式中:A空白组为空白组的吸光度值,A实验组为实验组的吸光度值。
1.3.4 乙醇降解菌的鉴定
形态学鉴定:采用点植法将菌株接种于PDA培养基上,观察菌株的菌落大小、颜色及表面形态。并在光学显微镜下观察菌体形态,对菌株进行初步鉴定。
分子生物学鉴定:菌株送武汉华大基因科技有限公司完成18S rDNA测序,并将该菌株的18S rDNA序列提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中采用局部序列比对基本检索工具(basic local alignment search tool,BLAST)同源搜索,选取同源性较高的模式菌株的18S rDNA基因序列,应用MEGA软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.5 乙醇降解菌培养基筛选
种子液的制备:将复筛菌株接种于发酵培养基,装液量250 mL/500 mL,30 ℃、130 r/min条件下发酵培养3 d。
按3%(V/V)的接种量将种子液分别接种于PDA、SDB、SDY、PYG四种液体培养基中,30 ℃、130 r/min条件下培养5 d,测定发酵液对乙醇的降解率。选取乙醇降解率最佳的培养基进行培养基优化试验。
1.3.6 菌株降解乙醇发酵条件优化单因素试验
将复筛菌株的种子液按3%的接种量接种于最优培养基中,装液量250 mL/500 mL,初始pH值7.0,30 ℃、130 r/min条件下发酵5 d,测定发酵液对乙醇的降解率。在此基础上,依次分别考察接种量(3%、4%、5%、6%、7%)、装液量(100 mL/500mL、150mL/500mL、200 mL/500 mL、250mL/500 mL、300 mL/500 mL)、发酵温度(26 ℃、28 ℃、30 ℃、32 ℃、34 ℃)、发酵时间(2 d、3 d、4 d、5 d、6 d)、初始pH值(5.0、6.0、7.0、8.0、9.0)对乙醇降解率的影响,从而确定最佳发酵条件。
1.3.7 菌株降解乙醇发酵条件优化正交试验
在单因素研究的基础上,选择对试验结果影响大的因素接种量(A)、发酵温度(B)、发酵时间(C)、装液量(D),以乙醇降解率作为评价指标进行4因素3水平的正交试验,正交试验因素与水平见表1。
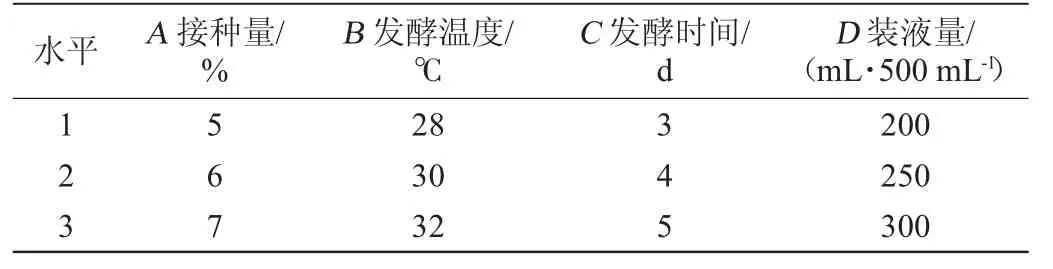
表1 菌株G-1降解乙醇发酵条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal tests for fermentation conditions optimization of ethanol degradation of strain G-1
2 结果与分析
2.1 罗汉内生菌分离结果
通过传统培养分离法从罗汉果根、茎和果实等组织中共分离纯化得到68株内生菌。
2.2 乙醇降解菌株的初筛结果
通过初筛从罗汉果内生菌中筛选得到17株对乙醇具有耐受性的菌株,根据菌株的生长情况从中选取14株菌株进行复筛。
2.3 乙醇降解菌株的复筛结果
由图1可知,复筛的14株菌株,都具有一定的降解乙醇的能力,综合比较菌株G-1对乙醇降解效果最好,对体积分数8%乙醇作用1 h时,乙醇降解率为9.1%;对体积分数10%乙醇作用24 h时,乙醇降解率为16.7%,对体积分数20%乙醇作用24 h时,乙醇降解率为13.2%。因此,选择菌株G-1进行进一步的研究。
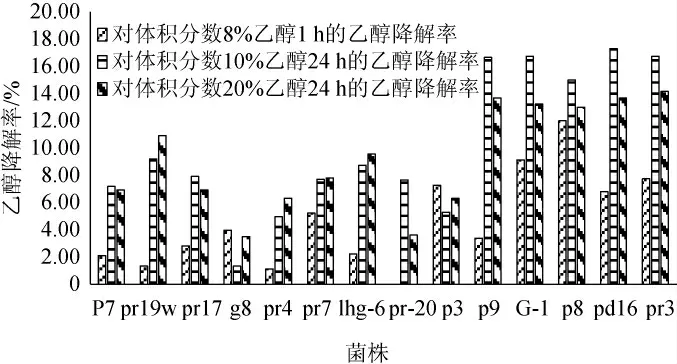
图1 基于重铬酸钾-硫酸法乙醇降解菌株的筛选结果Fig.1 Screening results of ethanol-degrading strains by potassium dichromate-sulfuric acid method
2.4 菌株G-1的鉴定
2.4.1 形态学鉴定
菌株G-1的菌落及细胞形态见图2。由图2可知,在PDA培养基上,菌株G-1菌落表面突起,菌落高3~5 mm,呈絮状,菌丝呈白色,较为质密;背面为粉白色,略带有紫色。分生孢子着生于菌丝上,在顶端聚成卵形。

图2 菌株G-1的菌落(a)及细胞(b)形态Fig.2 Colony (a) and cell (b) morphology of strain G-1
2.4.2 分子生物学鉴定
由武汉华大基因科技有限公司测得菌株G-1的18SrDNA基因序列碱基长度为534 bp,经过同源性序列检索,结果显示菌株G-1与尖孢镰刀菌(Fusarium oxysporum)的18S rDNA序列同源性>99%。在搜索比对结果中选择与菌株G-1同源性较高的菌株,建立菌株G-1的系统发育树,结果见图3。由图3可知,菌株G-1与尖孢镰刀菌(Fusarium oxysporum)聚于一支,相似度最高,亲缘关系最近。结合菌株G-1的形态观察结果和分子生物学鉴定结果,最终确定菌株G-1为尖孢镰刀菌(Fusarium oxysporum)。

图3 基于18S rDNA基因序列菌株G-1的系统发育树Fig.3 Phylogenetic tree of strain G-1 based on 18S rDNA gene sequences
2.5 菌株G-1降解乙醇培养基的筛选结果
由图4可知,采用PDA培养基对菌株G-1进行发酵得到的发酵液乙醇降解率最高,为21.3%,因此,选择PDA作为最优培养基。

图4 不同培养基对菌株G-1乙醇降解率的影响Fig.4 Effect of different media on ethanol degradation rate of strain G-1
2.6 菌株G-1降解乙醇发酵条件优化
2.6.1 接种量对菌株G-1乙醇降解率的影响
由图5可知,随着接种量的增大,乙醇降解率呈先升高后降低的趋势。当接种量为6%时,菌株G-1的乙醇降解率最高,达24.8%。这是因为接种量对菌株的生长和活性物质积累起着重要作用,当接种量<6%之前,菌株生长和活性物质积累时间过长,效率低下;当接种量>6%之后,会引起溶氧不足,影响活性物质的产量和产生过多代谢废物[26]。故确定最佳接种量为6%。
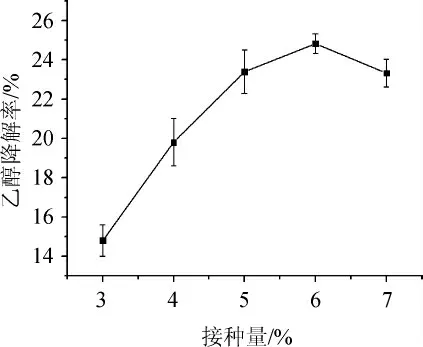
图5 不同接种量对菌株G-1乙醇降解率的影响Fig.5 Effect of different inoculum on ethanol degradation rate of strain G-1
2.6.2 装液量对菌株G-1乙醇降解率的影响
由图6可知,随着装液量的增大,菌株G-1的乙醇降解率呈先升高后下降的趋势。当装液量为250 mL/500 mL时,菌株乙醇降解率最高,达25.78%。装液量通过影响营养物质的含量和菌株需氧量来对菌株的活性进行影响,当装液量<250 mL/500 mL之前,可能其菌株积累活性物质所需的营养不足,导致乙醇降解率低;当装液量>250 mL/500 mL之后,可能其需氧量不足,菌株生长缓慢,活性物质积累不足[27]。故确定最佳装液量为250 mL/500 mL。
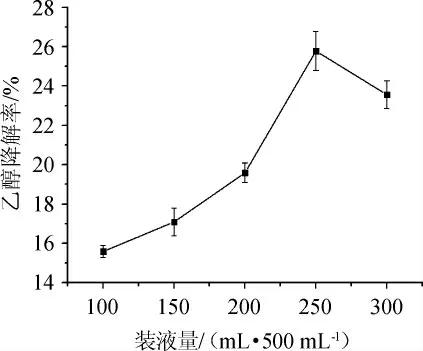
图6 不同装液量对菌株G-1乙醇降解率的影响Fig.6 Effect of different loaded liquid on ethanol degradation rate of strain G-1
2.6.3 发酵温度对菌株G-1乙醇降解率的影响
由图7可知,随着发酵温度的升高,菌株G-1的乙醇降解率呈先升高后下降的趋势。当发酵温度为32 ℃时,乙醇降解率最高,可达26.8%。温度对微生物的影响体现在影响细胞膜的流动性与细胞内生物大分子的活性,进而影响细胞的生长代谢。当发酵温度<32 ℃之前,可能达不到菌株生长的最佳温度,菌株生长效率低;当发酵温度>32 ℃之后,可能过高的温度对菌株的活性产生了影响,致使其活性物质积累较慢[28]。故确定最佳发酵温度为32 ℃。
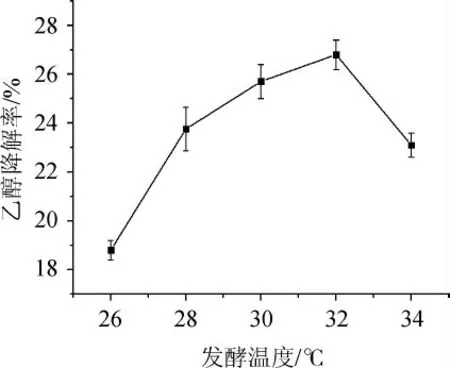
图7 不同发酵温度对菌株G-1乙醇降解率的影响Fig.7 Effect of different fermentation temperature on ethanol degradation rate of strain G-1
2.6.4 发酵时间对菌株G-1乙醇降解率的影响
由图8可知,随着发酵时间的延长,菌株G-1的乙醇降解率呈先升高后降低的趋势。当发酵时间为4 d时,菌株G-1的乙醇降解率最高,达24.08%。分析原因可能是随着发酵时间的延长,微生物的种群密度和代谢产物也会增加,但随着营养物质的减少,微生物的种群密度和代谢产物会慢慢减低[28]。故确定最佳发酵时间为4 d。
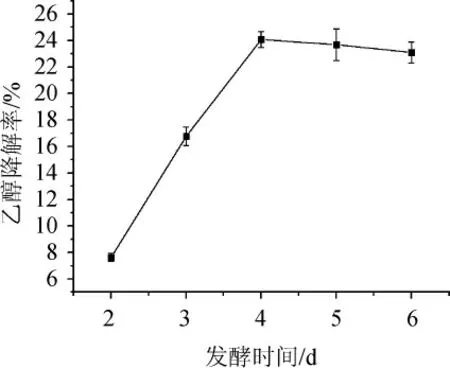
图8 不同发酵时间对菌株G-1乙醇降解率的影响Fig.8 Effect of different fermentation time on ethanol degradation rate of strain G-1
2.6.5 初始pH值对菌株G-1乙醇降解率的影响
由图9可知,随着初始pH值的增大,菌株G-1的乙醇降解率呈先升高后降低的趋势。当初始pH值为6.0时,菌株G-1的乙醇降解率最高,达24.34%。分析原因可能是pH值对微生物生命活动的影响较大,当pH值<6.0之前,环境对菌株细胞膜通透性产生了较大影响,不利于菌株发酵;当pH值>6.0之后,环境对菌株影响渐渐变大,菌株发酵等受到了影响,使活性物质积累速率降低[28]。故确定最佳初始pH值为6.0。
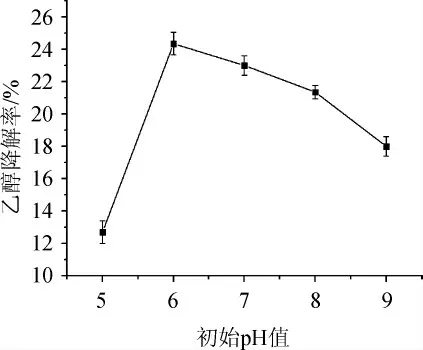
图9 不同初始pH值对菌株G-1乙醇降解率的影响Fig.9 Effect of different initial pH value on ethanol degradation rate of strain G-1
2.6.6 菌株G-1降解乙醇发酵条件优化正交试验结果
采用PDA培养基,在单因素试验的基础上,确定初始pH值为6.0,选择接种量(A)、发酵温度(B)、发酵时间(C)、装液量(D)为影响因素,以乙醇降解率为评价指标,采用L9(34)正交设计研究不同因素对乙醇降解率的影响,正交试验结果与分析见表2。

表2 菌株G-1降解乙醇发酵条件优化正交试验结果与分析Table 2 Design and results of orthogonal tests for fermentation conditions optimization of ethanol degradation of strain G-1
由表2可知,根据极差分析,各因素影响菌株G-1乙醇降解能力的强弱顺序为A>C>B>D,说明接种量对试验结果的影响最大,其次是发酵时间。各因素最优水平为A3B3C1D1,即接种量7%、发酵温度32 ℃、发酵时间3 d、装液量200 mL/500 mL。
2.6.7 验证试验结果采取优化后的培养条件对菌株G-1进行发酵,重复试验3次,测得乙醇降解率为29.77%,是优化前的2.2倍。
3 结论
采用传统培养分离方法从罗汉果中分离得到68株内生菌,通过测定乙醇耐受性和重铬酸钾-硫酸法筛选得到了一株具有降解乙醇能力的菌株G-1,经形态学和分子生物学鉴定为尖孢镰刀菌(Fusarium oxysporum)。通过单因素试验和正交试验得出菌株G-1降解乙醇的最优发酵条件为发酵培养基PDA培养基,初始pH值6.0,接种量7%,装液量200 mL/500 mL,发酵温度32 ℃,130 r/min条件下振荡培养3 d。在此优化条件下,菌株G-1的乙醇降解率为29.77%,是优化前的2.2倍。
