甲酰肽受体Fpr2在氧诱导视网膜病变小鼠新生血管形成中的作用及相关机制研究△
2021-07-02薛盛丁陈辉刘爽朱蓉嵘王诗逸俞莹
薛盛丁 陈辉 刘爽 朱蓉嵘 王诗逸 俞莹
早产儿视网膜病变(ROP)是一种发生于早产儿尤其是低体质量儿的视网膜血管性疾病,是婴幼儿致盲的最主要原因。ROP的主要特征是视网膜新生血管的形成,其中涉及到多种视网膜细胞,如视网膜内皮细胞、胶质细胞、色素上皮细胞等,并受众多因素的调控,其发病机制尚未完全明确。甲酰肽受体(Fpr2)属于G蛋白偶联趋化因子受体家族,在血管内皮细胞、小胶质细胞、星形胶质细胞、皮肤成纤维细胞等均有表达,在炎症反应、细胞增殖、血管增生中发挥重要的免疫调控作用。本研究利用Fpr2-/-小鼠和C57BL/6J小鼠构建氧诱导视网膜病变(OIR)模型,通过观察各组小鼠视网膜中神经胶质细胞的改变、新生血管的生成情况,进而探讨Fpr2在OIR小鼠中的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物本研究采用的SPF级C57BL/6J (B6)孕鼠、Fpr2-/-孕鼠均由南通大学医学院动物中心饲养繁殖。在模型制作过程中,所有小鼠均由实验动物中心统一饲养,室温控制在20 ℃±5 ℃。实验动物的使用和饲养均符合国家科学技术部发布的《实验动物管理条例》。
1.1.2 材料实时荧光定量PCR(RT-PCR)试剂盒、逆转录试剂盒均购自美国赛默飞科技公司;一抗:抗FPR2 [GM1D6] (ab26316)、抗离子化钙结合适配分子1(IBA1) [EPR16589] (ab178847)、抗CD31 [MEC 7.46] (ab7388)、抗神经胶质纤维酸性蛋白(GFAP)(ab7260)、抗波形蛋白(Vimentin)(ab45939)、抗ki67(ab15580)和荧光二抗均购自美国Abcam公司;抗p-P38丝裂原活化蛋白激酶(MAPK)、抗P38 MAPK、抗细胞外调节蛋白激酶(ERK)1/2、抗p-ERK1/2和Western blot二抗均购自美国细胞信号技术公司。冷冻高速离心机(Eppendorf,德国),解剖显微镜、光学显微镜、荧光显微镜(Leica,德国),RT-PCR仪(Applied Biosystems,美国)。
1.2 方法
1.2.1 OIR小鼠模型构建分别选取Fpr2-/-孕鼠和C57BL/6J(B6)孕鼠各4只,饲养至产下新生鼠。将C57BL/6J新生鼠(12只,氧诱导组)和Fpr2-/-新生鼠(12只,Fpr2-/-氧诱导组)在出生后的第7天和母鼠一同置于密闭氧箱,每隔2 h观察一次,确保氧箱内氧气体积分数保持在75%±5%,连续5 d,密闭氧箱中的母鼠每24 h与正常氧气含量空气中的母鼠更换一次,确保母鼠能提供足够的养分给新生鼠。氧箱中的新生鼠在出生后第12天被移至正常氧气含量的空气中,连续5 d。正常对照组(C57BL/6J新生鼠12只)和Fpr2-/-组(Fpr2-/-新生鼠12只)的新生鼠和母鼠一起放置于正常氧气含量的空气中饲养。正常对照组、正常Fpr2-/-组、氧诱导组和Fpr2-/-氧诱导组小鼠均于造模后第17天处死小鼠,并取出眼球备用。
1.2.2 视网膜铺片免疫荧光染色造模后第17天处死小鼠并摘除眼球,PBS缓冲液漂洗后置于40 g·L-1多聚甲醛溶液中固定10 min,随后在显微镜下取出完整视网膜组织。将取出的视网膜组织浸泡于用PBS配制的一抗稀释液中,稀释浓度为1200,4 ℃孵育过夜。次日将视网膜组织洗涤后放在黏附载玻片上,将完整的杯状视网膜组织切成4瓣,封片,荧光显微镜观察并拍照保存。采用Adobe Photoshop软件计算各组小鼠新生血管面积与全视网膜面积的比值和无灌注区面积与全视网膜面积的比值,计算均值并分析各组间的差异。
1.2.3 冰冻切片免疫荧光染色冰冻切片复温后用30 g·L-1BSA(含5 g·L-1TritonX-100)封闭2 h,加入一抗稀释液(Vimentin、GFAP、IBA1、CD31、Fpr2),稀释浓度均为1200,4 ℃条件下孵育过夜。次日复温洗涤后加入二抗稀释液,稀释浓度为1200,室温下在暗盒中孵育2 h。洗涤后滴加稀释的Hoechst孵育10 min,稀释浓度为110 000,洗涤后封片,共焦显微镜观察并拍照保存,分析各组小鼠视网膜中各指标的差异。
1.2.4 Western blot检测各组小鼠视网膜中ERK 1/2、p-ERK 1/2、P38、p-P38蛋白表达取小鼠眼球后剥离视网膜,加入裂解液后冰浴下超声匀浆,收集蛋白。用BCA法测定各组小鼠视网膜中蛋白浓度,上样、电泳、转膜后封闭3 h,加入抗ERK 1/2、抗p-ERK 1/2、抗P38、抗p-P38抗体稀释液,稀释浓度均为1300,4 ℃条件下孵育过夜。次日洗膜3次,室温下用相应的二抗稀释液在暗盒中孵育2 h,稀释浓度为1200,洗膜后显影,扫描并保存。将正常对照组目的基因的表达量作为1,各标本重复检测3次后取其平均值。分析各组小鼠视网膜中ERK 1/2、p-ERK 1/2、P38、p-P38蛋白的相对表达量。
1.2.5 RT-PCR检测各组小鼠视网膜中炎症因子mRNA表达RT-PCR检测各组小鼠视网膜中白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10) mRNA表达的变化。按照Trizol试剂盒说明书提取mRNA,使用 Easy-Script First-stand cDNA Synthesis Super Mix试剂盒逆转录为cDNA,并测定浓度和纯度。以cDNA为模板按照试剂盒说明书进行反应,收集并分析数据。mRNA的相对表达量使用公式 2-ΔΔCt×103计算。正常对照组目的基因的相对表达量作为1,各标本重复检测3次后取其平均值。相应引物序列如下:IL-1β上游引物:5’-GAAGAAGAGCCCATCCTCTGT-3’,下游引物:5’-TGTTCACGGAGCCTGTAG-3’;TNF-α上游引物:5’-CTCCACTTGGTGGTTTGCTAC-3’,下游引物:5’-CTTCCCTCTCATCAGTTCTATGG-3’;IL-6上游引物:5’-ACCACTCCCAACAGACCTGTCT-3’,下游引物:5’-CAGATTGTTTTCTGCAAGTGCAT-3’;IL-10上游引物:5’-ACCTGGTACAAGTGATGCC-3’,下游引物:5’-CAAGGAGTTGTTTCCGTTA-3’;GAPDH上游引物:5’-TGAGCAAGAGAGGCCCTATC-3’,下游引物:5’-AGGCCCCTCCTGTTATTATG-3’。
1.3 统计学处理数据均以均数±标准差表示。利用Graph Pad Prism Version 7.00进行统计分析及作图,组间比较采用单因素方差分析并进行两两比较,检验水准:α=0.05。
2 结果
2.1 Fpr2在各组小鼠视网膜中的表达冰冻切片免疫荧光染色结果显示,在正常对照组和氧诱导组小鼠的视网膜中,Fpr2可在神经节细胞层(GCL)、内丛状层(IPL)和外丛状层(OPL)中表达。Fpr2和CD31双重免疫荧光染色结果显示(图1),Fpr2在小鼠视网膜血管内皮细胞中表达,与正常对照组(0.115±0.006)相比,氧诱导组小鼠视网膜中Fpr2表达(0.252±0.018)明显增加,两组间比较差异有统计学意义(t=12.62,P<0.01)。Fpr2-/-组、Fpr2-/-氧诱导组小鼠视网膜中均没有检测到Fpr2的表达。
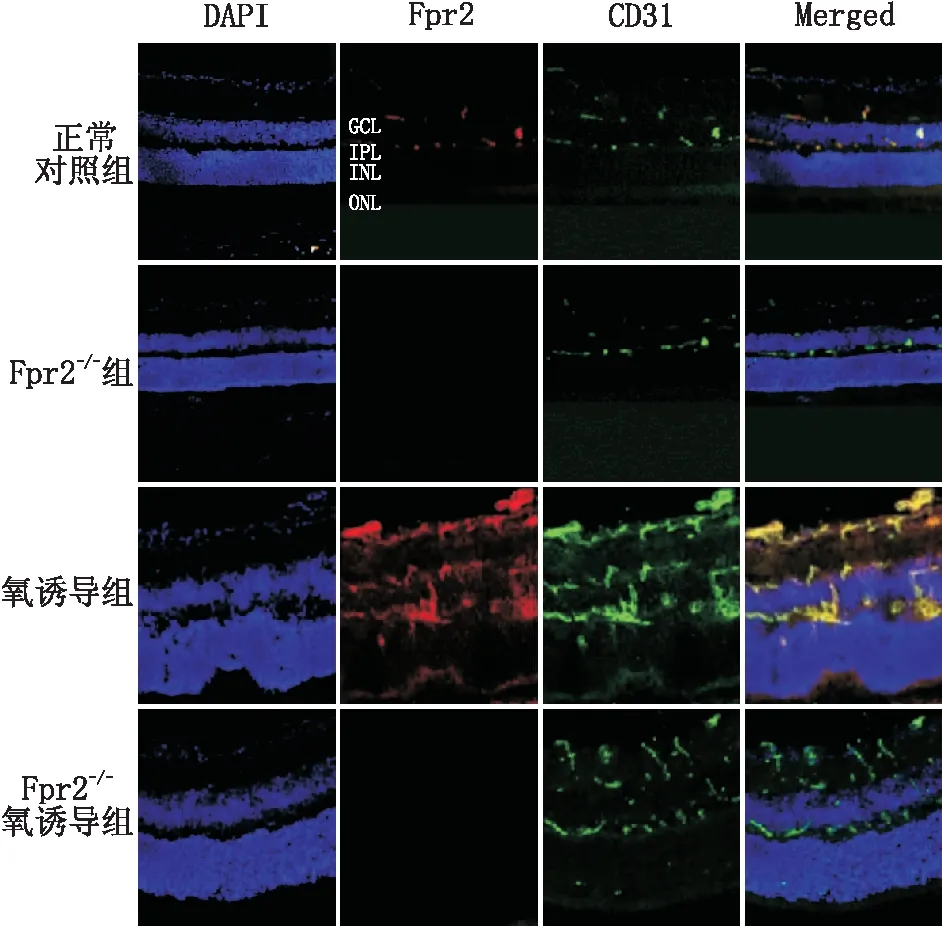
图1 各组小鼠视网膜组织Fpr2免疫荧光染色结果
2.2 抑制Fpr2减轻OIR小鼠视网膜中胶质细胞的活化与正常对照组相比,氧诱导组和Fpr2-/-氧诱导组小鼠视网膜中IBA1阳性的小胶质细胞均显著增加,尤其在IPL和OPL,Fpr2-/-氧诱导组小鼠视网膜中IBA1的表达量均低于氧诱导组。氧诱导组与正常对照组比较、Fpr2-/-氧诱导组与正常对照组比较、Fpr2-/-氧诱导组与氧诱导组比较,小鼠视网膜中IBA1表达差异均有统计学意义(t=5.82、9.18、-2.84,均为P<0.05)(图2)。Fpr2-/-组与正常对照组比较,IBA1表达差异无统计学意义(t=0.84,P>0.05),表明抑制Fpr2减轻了小胶质细胞的增殖(图3A)。Vimentin作为Müller细胞的标记物,冰冻切片免疫荧光染色结果表明,在神经视网膜各层均有表达。免疫荧光染色结果表明,与正常对照组相比,氧诱导组和Fpr2-/-氧诱导组小鼠视网膜中Vimentin表达均显著增加,但与氧诱导组相比,Fpr2-/-氧诱导组小鼠视网膜中Vimentin受到显著抑制,氧诱导组与正常对照组比较、Fpr2-/-氧诱导组与正常对照组比较、Fpr2-/-氧诱导组与氧诱导组比较,小鼠视网膜中Vimentin表达差异均有统计学意义(t=2.92、7.19、-1.86,均为P<0.05)(图3B)。Fpr2-/-组与正常对照组比较,小鼠视网膜中Vimentin表达差异无统计学意义(t=1.32,P>0.05)。氧诱导组与正常对照组比较、Fpr2-/-氧诱导组与正常对照组比较、Fpr2-/-氧诱导组与氧诱导组比较,小鼠视网膜中GFAP表达差异均有统计学意义(t=5.00、4.10、-4.75,均为P<0.05)(图3C)。Fpr2-/-组与正常对照组比较,小鼠视网膜中GFAP表达差异无统计学意义(t=3.97,P>0.05)。
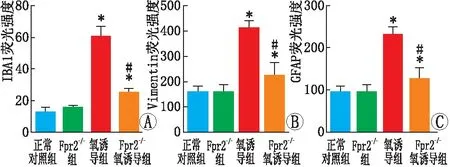
图2 各组小鼠视网膜中IBA1(A)、Vimentin(B)、GFAP(C)的荧光强度差异 与正常对照组相比,*P<0.05,与氧诱导组相比,#P<0.05。
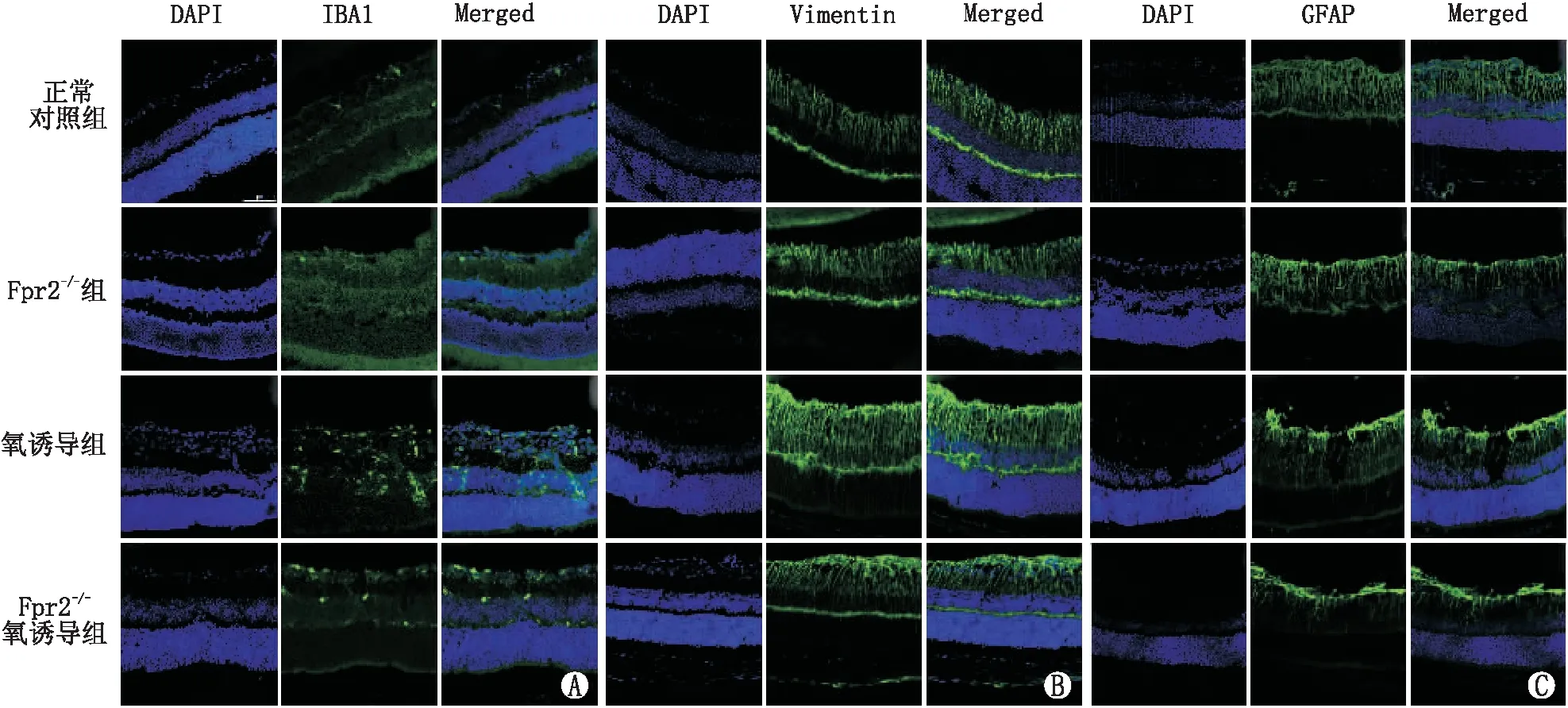
图3 各组小鼠视网膜中IBA1(A)、Vimentin(B)、GFAP(C)的表达情况
2.3 Fpr2对OIR小鼠视网膜中炎症因子mRNA表达的影响RT-PCR检测结果显示,与正常对照组相比,氧诱导组和Fpr2-/-氧诱导组小鼠视网膜中的促炎因子TNF-α、IL-1β和IL-6 mRNA相对表达量均显著升高,而抑炎因子IL-10 mRNA的相对表达量则降低。与氧诱导组相比,Fpr2-/-氧诱导组小鼠视网膜中TNF-α、IL-1β和IL-6 mRNA相对表达量均降低,而IL-10 mRNA的相对表达量则升高。氧诱导组与正常对照组比较、Fpr2-/-氧诱导组与正常对照组比较、Fpr2-/-氧诱导组与氧诱导组比较,小鼠视网膜中TNF-α、IL-1β、IL-6和IL-10 mRNA相对表达量差异均有统计学意义(TNF-α:t=12.10、7.98、-7.90;IL-1β:t=6.71、5.39、-3.67;IL-6:t=8.38、7.17、-4.59;IL-10:t=-5.60、-4.17、1.74;均为P<0.05)(图4)。Fpr2-/-组与正常对照组比较,小鼠视网膜中TNF-α、IL-1β、IL-6和IL-10 mRNA相对表达量差异均无统计学意义(t=5.83、2.97、3.45、1.29;均为P>0.05)。表明Fpr2在氧诱导小鼠的视网膜炎症反应中起着重要作用。
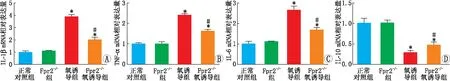
图4 各组小鼠视网膜中IL-1β(A)、TNF-α(B)、IL-6(C)、IL-10(D)mRNA的表达情况 与正常对照组相比,*P<0.05;与氧诱导组相比,#P<0.05。
2.4 Fpr2对OIR小鼠视网膜中ERK1/2、P38信号通路的影响检测各组小鼠视网膜中ERK1/2和P38蛋白的磷酸化情况,结果显示,在氧诱导组和Fpr2-/-氧诱导组,小鼠视网膜中ERK1/2和P38 MAPK的磷酸化水平均明显升高,而与氧诱导组相比,Fpr2-/-氧诱导组小鼠视网膜中p-ERK1/2蛋白和p-P38蛋白相对表达量下降。氧诱导组与正常对照组比较、Fpr2-/-氧诱导组与正常对照组比较、Fpr2-/-氧诱导组与氧诱导组比较,小鼠视网膜中p-ERK1/2蛋白和p-P38蛋白相对表达量差异均有统计学意义(p-ERK1/2:t=7.60、6.58、-3.36;p-P38:t=8.46、5.79、-3.25;均为P<0.05)(图5)。Fpr2-/-组与正常对照组比较,小鼠视网膜中p-ERK1/2和p-P38蛋白相对表达量差异均无统计学意义(t=2.21、2.35,均为P>0.05)。说明抑制Fpr2能够抑制缺氧引起的P38蛋白和ERK1/2蛋白的磷酸化表达,从而抑制信号转导。
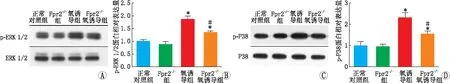
图5 Western blot 检测各组小鼠视网膜中ERK1/2蛋白、p-ERK1/2蛋白、P38蛋白、p-P38蛋白的表达情况 A、C:各蛋白电脉图;B、D:p-ERK1/2、p-P38蛋白相对表达量。与正常对照组相比,*P<0.05;与氧诱导组相比,#P<0.05。
2.5 Fpr2对OIR小鼠视网膜新生血管形成的影响用IB4对小鼠视网膜进行免疫荧光染色,观察Fpr2对OIR小鼠视网膜新生血管形成的影响,结果显示,在造模后第17天,氧诱导组和Fpr2-/-氧诱导组小鼠视网膜大血管呈不规则扩张,走形迂曲,后极部可见视网膜有大片无灌注区,在视盘周围出现毛细血管闭塞,血管分支减少,大量的视网膜新生血管出现在视网膜中周部。就视网膜血管形态而言,与氧诱导组相比,Fpr2-/-氧诱导组小鼠的视网膜血管更加接近于正常对照组和Fpr2-/-组小鼠,且新生血管簇和血管闭塞区域均明显减少。氧诱导组与正常对照组比较、Fpr2-/-氧诱导组与正常对照组比较、Fpr2-/-氧诱导组与氧诱导组比较,小鼠视网膜新生血管面积(t=7.46、 4.38、 -3.24;均为P<0.05)和无灌注区面积(t=10.14、 6.19、 -7.91;均为P<0.05)差异均有统计学意义 (图6)。Fpr2-/-组与正常对照组比较,小鼠视网膜新生血管面积和无灌注区面积差异均无统计学意义(t=1.21、2.14,均为P>0.05)。
3 讨论
本文第一次采用OIR小鼠模型观察Fpr2在缺氧条件下对视网膜胶质细胞的影响和对视网膜新生血管形成的作用。经研究发现,视网膜的缺氧会增加Fpr2在视网膜内皮细胞中的表达。与正常对照组小鼠的视网膜相比,氧诱导组和Fpr2-/-氧诱导组小鼠视网膜出现大量的新生血管及无灌注区,而Fpr2-/-氧诱导组小鼠视网膜新生血管面积及无灌注区的面积均显著减少,说明Fpr2促进了新生血管的发生发展。Fpr2是甲酰肽受体中一类重要的促炎、促血管生成的趋化因子受体,在内皮细胞、小胶质细胞、星形胶质细胞、皮肤成纤维细胞等均有表达,参与多种生物学活动。MAPK包括ERK1/2(即P44 MAPK和P42 MAPK)和P38 MAPK等,可以调节多种细胞病理生理过程,如细胞的生长分化、对新环境的应激反应和炎症反应等。研究表明,IL-1β通过ERK和JNK信号通路诱导微血管内皮细胞高表达Fpr2,促进内皮细胞增殖[1]。有研究发现[2],血清淀粉样蛋白A能够通过Fpr2促进内皮细胞钙离子内流,活化ERK和Akt信号通路,促进内皮细胞增殖、迁移及血管增生。本研究结果显示,与正常对照组相比,氧诱导组和Fpr2-/-氧诱导组小鼠视网膜中ERK1/2和P38 MAPK的磷酸化水平升高,而在Fpr2-/-氧诱导组小鼠视网膜中ERK1/2和P38 的磷酸化表达被抑制,说明抑制Fpr2能够抑制缺氧引起的P38和ERK1/2的磷酸化表达。Fpr2的激动剂WKYMVm在体外能通过Fpr2促进内皮祖细胞增殖、迁移、管腔形成,从而促进血管生成、恢复血循环[3]。Fpr2的抑制剂UPARANT能够显著抑制增生型糖尿病视网膜病变患者中由玻璃体液所造成的血管生成[4]。
视网膜新生血管的发生发展除了与视网膜内皮细胞有关外,还与多种视网膜胶质细胞息息相关,如星形胶质细胞、Müller细胞和小胶质细胞。视网膜胶质细胞是血管改变的预定靶标,并在疾病进展期充当血管和神经元之间的沟通者[5]。Müller细胞能释放多种炎症因子,破坏血管内皮细胞间的紧密连接。小胶质细胞是视网膜的单核巨噬细胞,围绕在视网膜血管的周围,能够敏感地感知外界微环境的变化,在视网膜血管发育和新生血管的形成过程中发挥了重要的作用。星形胶质细胞在离子的稳态、神经元信号转导和视网膜内皮屏障的完整性中起着非常重要的作用。有研究发现,在OIR小鼠视网膜上,Müller细胞和小胶质细胞的数量增加,并且这些胶质细胞数量的增加与深神经丛的缺失有关[6-7]。胶质细胞活化的标志是定位于视网膜星形胶质细胞和视网膜Müller细胞的GFAP。缺氧会导致GFAP表达上调,并伴有反应性细胞增生,而抑制了Fpr2,视网膜最内层GFAP荧光强度降低,说明这种胶质细胞增生反应减弱。本研究在OIR模型视网膜切片中发现,三种胶质细胞荧光标志物均有明显增高,说明视网膜缺氧增加了视网膜胶质细胞的活性,抑制Fpr2则显著抑制了这些胶质细胞的活化,说明Fpr2可能加重促进OIR缺血性视网膜神经胶质细胞的功能障碍,这与Fpr2在其他神经胶质细胞中的作用一致。有研究表明,刺激炎症反应的物质能够提高中枢神经系统小胶质细胞中Fpr2的表达和功能,进而协调宿主促进小胶质细胞的趋化作用和内吞作用[8]。
炎症因子参与了OIR的病理过程,有研究发现,在ROP患儿与非ROP新生儿之间,IL-1β等炎症指标在患儿体内存在着显著差异[9]。Dammann等[10]发现,ROP的患儿体内IL-10、IL-1β、TNF-α的变化情况与ROP病情相关。Müller细胞是释放炎症因子中最重要的神经胶质细胞,有研究表明,在链脲佐菌素诱导的糖尿病大鼠视网膜Müller细胞中,有78个基因发生了改变,有1/3与炎症有关[11],而糖尿病视网膜病变也被认为是一种视网膜缺血缺氧引起的慢性炎症病变。在OIR小鼠的动物模型中,炎症不仅阻碍了视网膜血管化的进程,而且加重了视网膜无血管区的面积及视网膜新生血管的数量[9]。炎症因子TNF-α、IL-6、IL-1β 对OIR小鼠视网膜上新生血管的形成有着重要的促进作用[12]。经炎症干预后的新生大鼠,出现了与ROP相似的眼底改变,如视网膜血管化进程被抑制,有大片新生血管丛出现在视网膜周边部,并伴有大量炎症细胞浸润和TNF-α、IL-1β等炎症因子的表达量升高[13]。本研究中,抑制Fpr2显著抑制了OIR小鼠视网膜炎症因子mRNA的表达,因此,我们认为Fpr2参与了OIR的促炎过程。
总之,Fpr2参与了OIR的发病过程,抑制Fpr2后,视网膜胶质细胞的活化、炎症因子的表达和视网膜新生血管的形成被显著抑制,这将为缺血性视网膜病变的治疗提供一个新的靶点。
