分泌型糖蛋白Reelin对N-甲基-D-天冬氨酸(NMDA)诱导的视网膜神经节细胞凋亡的抑制作用△
2021-07-02王艳婷金学民李晓华赵朝霞
王艳婷 金学民 李晓华 赵朝霞
青光眼是一种以视神经损伤、视野缺损、视网膜神经节细胞(RGC)变性或凋亡为特征的视网膜神经病变[1-2]。研究表明,缺血、缺氧、谷氨酸兴奋性毒性、神经营养因子缺乏、氧化应激等均会导致RGC凋亡,引起青光眼[3-4]。N-甲基-D-天冬氨酸(NMDA)通过与细胞表面特异性受体结合,诱发细胞谷氨酸兴奋性毒性和氧化应激反应,通常用NMDA诱导动物青光眼模型或RGC损伤模型[5]。Reelin属于分泌型糖蛋白,与受体结合后可调节神经细胞突触功能[6]。Reelin与神经系统疾病(阿尔茨海默病或帕金森病)的发生密切相关[7-8]。然而,Reelin与青光眼中RGC变性损伤的关系鲜有报道。视网膜被认为是中枢神经系统的一部分,有“外周脑”之称。青光眼患者的视网膜神经病变与阿尔茨海默病等疾病类似,都以神经元的凋亡、变性为特征。本研究我们利用NMDA诱导RGC损伤,制作大鼠青光眼模型,进而探讨Reelin在青光眼发生中的作用。
1 材料与方法
1.1 试剂与仪器大鼠RGC-5(中国科学院上海细胞库),含双抗的DEME培养基、不含双抗的DEME培养基、胎牛血清(上海碧云天生物技术有限公司),NMDA、糖原合成酶激酶-3 (GSK-3)小鼠单克隆抗体、山羊抗鼠IgG二抗(英国Abcam公司),Annexin V FITC/碘化丙啶(PI)凋亡试剂盒(德国美天旎公司),兔抗鼠Reelin一抗(PA5-78413)、兔抗鼠磷酸化-Tau蛋白(p-Tau)一抗、鼠抗鼠细胞周期素依赖蛋白激酶5(CDK5)一抗、山羊抗兔IgG二抗(美国Invitrogen公司),Reelin抑制物、Reelin类似物和Reelin阴性对照序列由上海吉玛基因公司合成,Trizol试剂、Lipofectamine 2000(美国Sigma公司)。
1.2 实验分组将大鼠RGC-5分为对照组、NMDA组、Reelin类似物组、Reelin阴性对照组和Reelin抑制物组。对照组细胞常规培养,NMDA组细胞使用NMDA诱导RGC-5损伤,Reelin类似物组、Reelin阴性对照组和Reelin抑制物组细胞使用NMDA诱导RGC-5损伤后分别转染Reelin类似物、阴性对照和抑制物。
1.3 方法
1.3.1 RGC-5复苏与培养将细胞解冻、复苏,用含体积分数10%的胎牛血清和10 g·L-1双抗的DEME培养基重悬细胞,置于37 ℃、体积分数5%CO2细胞培养箱中培养,每2~3 d用胰蛋白酶消化传代1次。取对数生长期细胞进行后续实验。
1.3.2 NMDA诱导RGC-5损伤将对数生长期细胞用含体积分数1%胎牛血清的DEME培养基饥饿处理24 h,将细胞分为对照组和NMDA组,对照组细胞不作任何干预,NMDA组细胞培养基中加入终浓度为100 μmol·L-1的NMDA,每组设置6个复孔,作用24 h后,Annexin V FITC/PI联合流式细胞仪检测细胞凋亡率,Western blot检测细胞内Reelin、p-Tau、GSK-3β和CDK5蛋白表达。
1.3.3 细胞转染将NMDA诱导损伤后的RGC-5分为Reelin类似物组、Reelin阴性对照组和Reelin抑制物组。转染前24 h将待转染细胞转移至6孔板中,调整细胞密度约为500×106个·L-1,待细胞融合至80%以上时,按照Lipofectamine 2000说明书中所示步骤,将Reelin类似物、Reelin阴性对照和Reelin抑制物与Lipofectamine 2000分别用DEME培养液稀释,室温孵育5 min,然后将各稀释液分别与Lipofectamine 2000稀释液混合,室温孵育15 min。之后将上述混合液分别加入Reelin类似物组、Reelin阴性对照组和Reelin抑制物组细胞培养液中,每组设置6个复孔,6 h后弃掉旧培养液,换为新鲜培养基,继续培养24 h后,用Annexin V FITC/PI联合流式细胞仪检测细胞凋亡率,Western blot检测细胞内Reelin、p-Tau、GSK-3β和CDK5蛋白表达情况。
1.3.4 Annexin V FITC/PI联合流式细胞仪检测细胞凋亡率将细胞用胰蛋白酶消化,预冷磷酸盐缓冲液洗涤2次,离心后重悬于200 μL 结合缓冲液中,加入5 μL Annexin V-FITC混匀,冰浴条件下避光反应15 min,继续加入300 μL 结合缓冲液,上流式细胞仪前加入5 μL PI,1 h内使用流式细胞仪检测细胞凋亡率。左下象限为活细胞,左上象限为死亡细胞,右上象限为晚期凋亡细胞,右下象限为早期凋亡细胞,细胞凋亡率取早期凋亡率和晚期凋亡率之和。每个实验结果独立重复3次。
1.3.5 Western blot检测细胞内Reelin、p-Tau、GSK-3β和CDK5蛋白表达用RIPA裂解液提取总蛋白,加入聚丙烯酰胺凝胶加样孔进行电泳,使蛋白转移至PVDF膜,50 g·L-1脱脂牛奶室温封闭2 h,TBST温和洗膜3 min后加入相对应的一抗Reelin(11000)、p-Tau(1500)、GSK-3β(11000)、CDK(1500),54 ℃孵育过夜,TBST洗涤3次,每次10 min,加入相应二抗(12000),室温下孵育1 h,TBST洗涤3次,每次10 min,加入配制好的ECL发光液,避光孵育5 min,用化学发光凝胶成像仪采集图片信息,用Image pro plus 6.0软件进行灰度值分析,以β-actin为内参,分析目的蛋白条带灰度值。
1.4 统计学方法用 SPSS 20.0 统计学软件进行数据分析。计量资料以均值±标准差表示,各组间差异采用单因素方差分析,两两比较采用LSD-t检验。检验水准:α=0.05。
2 结果
2.1 NMDA对RGC-5细胞凋亡的影响对照组RGC-5细胞凋亡率为(9.30±0.74)%,NMDA组为(25.40±1.13)%,NMDA组高于对照组,差异有统计学意义(t=6.311,P<0.001)(见图1)。
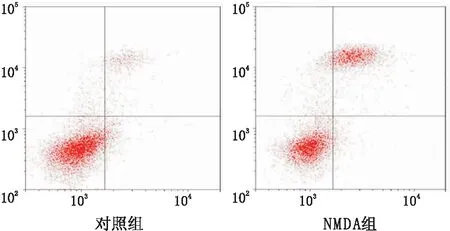
图1 对照组和NMDA组细胞凋亡情况
2.2 NMDA对RGC-5内Reelin、p-Tau、GSK-3β、CDK5蛋白表达的影响NMDA组RGC-5内Reelin蛋白表达水平低于对照组,p-Tau、GSK-3β和CDK5蛋白表达水平均高于对照组,差异均有统计学意义(均为P<0.001)(见图2和表1)。
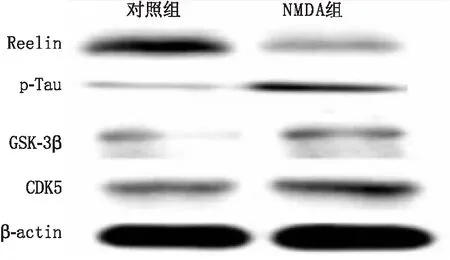
图2 Western blot检测对照组和NMDA组RGC-5内各种蛋白表达
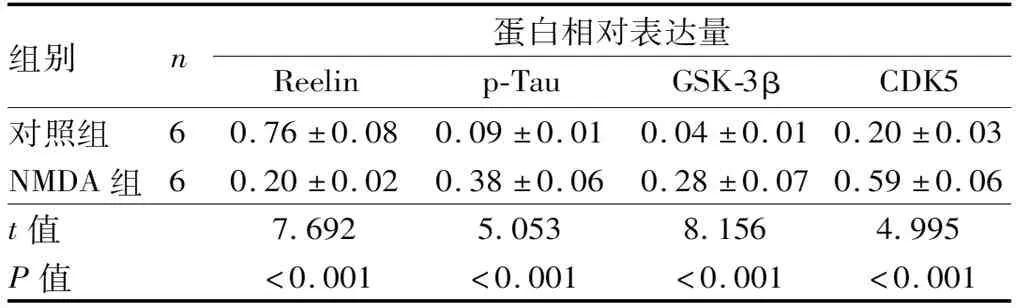
表1 对照组和NMDA组RGC-5内Reelin、p-Tau、GSK-3β、CDK5蛋白相对表达量
2.3 Reelin对RGC-5细胞凋亡的影响Reelin类似物组细胞凋亡率为(9.23±0.24)%,低于Reelin阴性对照组[(14.33±1.02)%]和Reelin抑制物组[(26.81±1.15)%],各组细胞凋亡率差异均有统计学意义(均为P<0.05)(见图3)。
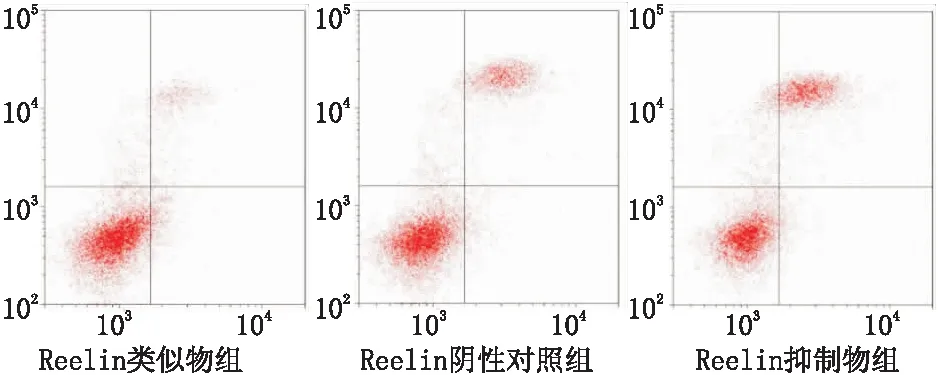
图3 Reelin类似物组、Reelin阴性对照组和Reelin抑制物组细胞凋亡情况
2.4 Reelin对RGC-5内p-Tau、GSK-3β、CDK5蛋白表达的影响Reelin类似物组RGC-5内p-Tau、GSK-3β蛋白表达水平均低于Reelin阴性对照组和Reelin抑制物组,Reelin抑制物组RGC-5内p-Tau、GSK-3β蛋白表达水平均高于Reelin阴性对照组,差异均有统计学意义(均为P<0.05);CDK5蛋白表达水平在3组中基本一致,差异无统计学意义(P>0.05)(见图4和表2)。
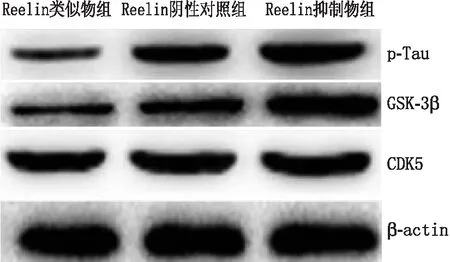
图4 Western blot检测Reelin类似物组、Reelin阴性对照组和Reelin抑制物组RGC-5内各种蛋白表达
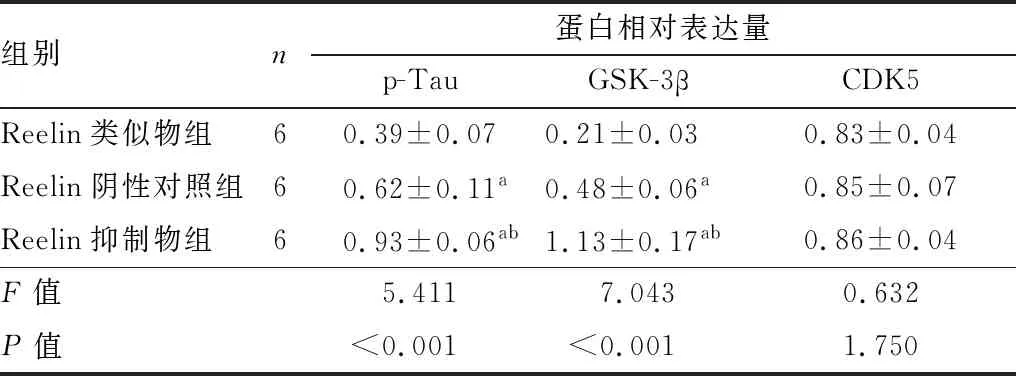
表2 Reelin类似物组、Reelin阴性对照组和Reelin抑制物组RGC-5内p-Tau、GSK-3β、CDK5蛋白表达情况
3 讨论
RGC变性和凋亡是青光眼的主要病理特征。RGC由胞体、轴突和树突组成,负责将视觉信息传递至中枢神经系统[9]。Reelin属于分泌型糖蛋白,通过与其受体结合,使细胞质衔接蛋白磷酸化,进而激活下游通路[6,10]。Reelin在神经发育的早期主要与神经细胞的迁移过程有关,发育后期主要起到调节突触功能的作用[11]。研究发现,Reelin蛋白在阿尔茨海默病、抑郁症、帕金森病等中枢神经系统疾病患者中呈现异常表达[7-8,12]。青光眼与阿尔茨海默病、抑郁症等多种中枢神经系统疾病存在病理相似性,都以中枢神经元的变性、凋亡为特征。研究发现,青光眼合并阿尔茨海默病患者其病程进展会加快[13]。本研究以NMDA诱导RGC损伤模型,探讨Reelin在RGC损伤中发挥的作用。本研究结果显示,NMDA组RGC-5内Reelin的表达水平低于对照组;转染Reelin类似物的RGC-5细胞凋亡率低于转染Reelin阴性对照和Reelin抑制物的细胞。以上实验结果提示,Reelin对RGC-5具有保护作用,Reelin表达下降可能是导致RGC-5损伤的原因之一。
Reelin的神经保护作用主要体现在阻止Tau蛋白的磷酸化[14]。Tau蛋白是神经细胞中的主要微管相关蛋白,对神经细胞骨架稳定起重要作用。Tau蛋白广泛分布在正常视网膜中,磷酸化的Tau蛋白在正常视网膜组织中几乎不表达[15]。RGC轴浆运输依赖于细胞骨架的微管系统,当Tau蛋白被磷酸化后,RGC内微管系统被破坏,生长锥塌陷,进而加速RGC变性凋亡[16]。因此,异常磷酸化的Tau蛋白在RGC的变性中起重要作用。本研究发现,在NMDA刺激后,RGC-5内p-Tau蛋白的表达增加,同时伴随细胞凋亡率升高,与Reelin表达趋势相反。进一步抑制RGC-5内Reelin的表达后,Tau蛋白磷酸化随之升高,而RGC-5内Reelin的表达上调后,Tau蛋白磷酸化随之下降,提示RGC损伤变性可能与Reelin表达下调后Tau蛋白的磷酸化上调有关。
蛋白激酶活化是导致Tau蛋白被异常磷酸化的主要原因,GSK-3β和CDK5是中枢神经系统内磷酸化Tau蛋白的两种主要激酶,且二者在RGC中都有表达,在RGC Tau蛋白磷酸化过程中都发挥重要作用[17-18]。本研究发现,在NMDA刺激的RGC-5内,GSK-3β和CDK5的表达都会增加,而在转染了Reelin抑制物的RGC-5内,GSK-3β的表达增加,转染Reelin类似物后,GSK-3β的表达下降, CDK5在3个转染组中的表达水平无明显变化,提示Reelin在RGC中对Tau磷酸化的抑制作用可能是通过抑制GSK-3β的活性而实现的。
综上所述,Reelin对NMDA 诱导损伤的RGC具有保护作用,这种作用是通过下调GSK-3β表达抑制Tau蛋白磷酸化,进一步抑制细胞凋亡而实现的。
