潜伏转化生长因子β结合蛋白2(LTBP2)对氧化型低密度脂蛋白诱导的人视网膜色素上皮细胞氧化损伤的影响
2021-07-02孙连义白淑玮李凤至赵梅生
孙连义 白淑玮 李凤至 赵梅生
年龄相关性黄斑变性(AMD)是一种发生于黄斑区视网膜组织的退行性疾病,常导致老年人视力不可逆的下降,严重者甚至失明[1-2]。由于黄斑部代谢率和氧张力高以及活性氧(ROS)的持续产生,其更容易受到氧化刺激,从而诱导视网膜色素上皮(RPE)细胞的损伤,引起光感受器功能障碍和相关的视觉障碍[3-4]。目前研究认为,AMD的主要病因为老化组织中氧化蛋白的积累,脂质和DNA的堆积[5-6]。高浓度氧化型低密度脂蛋白(ox-LDL)已被证明可诱导氧化应激,引起RPE层脂质的沉积,与RPE细胞功能失调及AMD发展密切相关[7-10]。因此,研究ox-LDL引发RPE细胞形成氧化应激的反应过程对揭示AMD的发病机制具有重要意义。
人潜伏转化生长因子β结合蛋白2 (LTBP2)是一种细胞外基质蛋白,被认为在青光眼、晶状体脱落等多种眼科疾病中发挥重要作用[11-12]。此外,沉默LTBP2可以减弱心肌细胞氧化应激损伤、减轻心肌细胞纤维化程度和重构[13]。然而,LTBP2在AMD中的作用目前还未见报道。本实验以人RPE细胞系ARPE-19为研究对象,探索LTBP2对ox-LDL诱导的ARPE-19细胞氧化损伤的影响,以期为进一步揭示ox-LDL诱导氧化损伤的作用机制和开发AMD治疗新靶点提供理论基础。
1 材料与方法
1.1 实验材料与主要仪器人RPE细胞系ARPE-19购自中国生命科学院。LTBP2过表达质粒(ov-LTBP2)、阴性对照过表达质粒(ov-NC)、LTBP2 siRNA (si-LTBP2)和阴性对照siRNA(si-NC)由广州锐博生物公司合成。Annexin V-FITC细胞凋亡检测试剂盒和Cell Counting Kit-8(CCK-8)试剂均购自上海碧云天公司;RPMI 1640培养基、胎牛血清购自美国HyClone公司;TRIzol购自日本TaKaRa公司;Lipofectamine 3000试剂和人血管内皮生长因子(VEGF)酶联免疫吸附实验(ELISA)检测试剂盒购自美国Thermo Fisher Scientific公司;超氧化物歧化酶(SOD)试剂盒购自南京建成生物工程研究所。Multiscan-GO全波长酶标仪购自美国Bio-Rad公司;凝胶成像系统购自西安天隆科技公司。
1.2 细胞处理及分组APRE-19细胞采用含体积分数10%胎牛血清的RPMI 1640培养基,在37 ℃、含体积分数5% CO2、饱和湿度的培养箱中培养。取对数生长期的APRE-19细胞随机分为7组,分别为对照组:常规培养细胞; ox-LDL组:细胞培养基中加入100 mg·L-1ox-LDL处理24 h;ox-LDL+ov-LTBP2组:细胞转染ov-LTBP2 24 h后加入100 mg·L-1ox-LDL 继续培养24 h; ox-LDL + ov-NC组:细胞转染ov-NC 24 h后加入100 mg·L-1ox-LDL继续培养24 h;ox-LDL+si-LTBP2组:细胞转染si-LTBP2 24 h后加入100 mg·L-1ox-LDL继续培养24 h;ox-LDL+ si-NC组:细胞转染si-NC 24 h后加入100 mg·L-1ox-LDL继续培养24 h;ox-LDL+si-LTBP2+VEGF组:细胞转染si-LTBP2 24 h后加入100 mg·L-1ox-LDL培养12 h,之后加入50 μg·L-1VEGF继续培养12 h。
1.3 ARPE-19细胞活力和凋亡水平检测取对数生长期ARPE-19细胞,以每孔1×103个接种于24孔板中,分别用0 mg·L-1、50 mg·L-1、100 mg·L-1、200 mg·L-1ox-LDL处理细胞24 h后,使用Annexin V-FITC细胞凋亡检测试剂盒检测ARPE-19细胞的凋亡水平。使用CCK-8试剂盒检测ARPE-19细胞活力,在450 nm波长处用酶标仪进行光密度(D)值的测定。实验重复3次。同样方法检测各分组处理后细胞的活力和凋亡水平。
1.4 ARPE-19细胞转染将APRE-19细胞以每孔50×103个均匀接种于24孔板中,于CO2培养箱培养24 h。取50 pmol的ov-LTBP2、ov-NC或si-LTBP2、si-NC加入无血清稀释液制成工作液。将1 μL的Lipofectamine 3000和24 μL的工作液在离心管中充分混合,室温静置15 min。将制备好的复合物逐滴滴加到有0.45 mL全培养基的细胞上,每6 h更换一次培养液。
1.5 Western blot检测各组细胞中各蛋白表达使用RIPA裂解液抽提不同方法处理后细胞的总蛋白, BCA法测定蛋白浓度。将蛋白样品上样于制备好的聚丙烯酰胺凝胶中,100 V电压下电泳2 h,反应完毕后将目的蛋白转至PVDF膜。之后将蛋白置于含50 g·L-1脱脂奶粉的TBST中封闭,TBST洗膜3次后,将兔抗LTBP2(11000,Thermo Fisher scientific,美国)、兔抗p38 MAPK (11000,Cell signaling technology,美国)、兔抗p-P38 MAPK (1500,Cell signaling technology,美国)分别与条带共同孵育,4 ℃过夜。用HRP标记的山羊抗兔二抗 (12000,Cell signaling technology,美国)室温孵育2 h后,采用 ECL显色,并在凝胶成像系统进行曝光。利用Image J软件分析条带灰度值。
1.6 ELISA检测各组细胞SOD活性和ROS、VEGF的含量分组处理细胞后,收集各组细胞的上清液检测SOD活性和ROS、VEGF含量。(1)ROS含量检测:在酶标包被板上待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL(样品最终稀释度为5倍)。用封板膜封板后置37 ℃温育30 min。小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次,甩干。每孔加入酶标试剂50 μL,空白孔除外。每孔先加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻振荡混匀,37 ℃避光显色15 min。 每孔加终止液50 μL终止反应。以空白孔调零,450 nm波长依序测量各孔的D值。(2)SOD活性检测:收集各组细胞培养液,采用SOD ELISA检测试剂盒检测各组细胞上清液中SOD活性,具体操作按说明书进行。(3)VEGF表达量检测:收集各组细胞培养液,采用人VEGF ELISA检测试剂盒,按照说明书步骤检测各组细胞上清液中VEGF表达量。
1.7 统计学处理采用SPSS 22.0统计软件进行统计学分析,数据以均数±标准差表示。各组间比较采用单因素方差分析,两组之间比较采用t检验。检验水准:α=0.05。
2 结果
2.1 ox-LDL对人APRE-19细胞活力和凋亡水平的影响与0 mg·L-1ox-LDL处理后相比,50 mg·L-1、100 mg·L-1和200 mg·L-1ox-LDL处理后APRE-19细胞活力均显著下降,细胞凋亡率均显著升高(均为P<0.05),且随着ox-LDL作用浓度的升高,APRE-19细胞活力逐渐下降,细胞凋亡率逐渐升高,不同处理浓度间差异均有统计学意义(均为P<0.05)(图1)。表明ox-LDL对APRE-19细胞活力和凋亡率的影响均具有剂量依赖性。
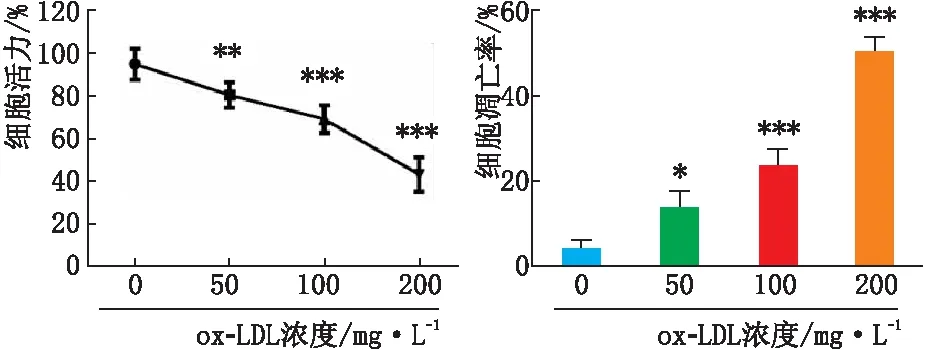
图1 不同浓度ox-LDL处理后APRE-19细胞活力和凋亡率变化 与0 mg·L-1 ox-LDL处理细胞后相比,*P<0.05,**P<0.01,***P<0.001。
2.2 LTBP2过表达对ox-LDL诱导的APRE-19细胞氧化损伤的影响50 mg·L-1、 100 mg·L-1、 200 mg·L-1ox-LDL处理APRE-19细胞24 h后,LTBP2 蛋白表达水平均较0 mg·L-1ox-LDL处理后明显增加,并具有剂量依赖性(均为P<0.05)。与对照组相比,ox-LDL组APRE-19细胞中LTBP2蛋白表达水平、ROS含量、细胞凋亡率均增加,细胞活力和SOD活性均降低,差异均有统计学意义(均为P<0.01)。与ox-LDL+ov-NC组相比,ox-LDL+ov-LTBP2 组APRE-19细胞LTBP2蛋白表达水平、ROS含量及细胞凋亡率均增加,细胞活力、SOD活性均降低,差异均有统计学意义(均为P<0.05)(见图2)。
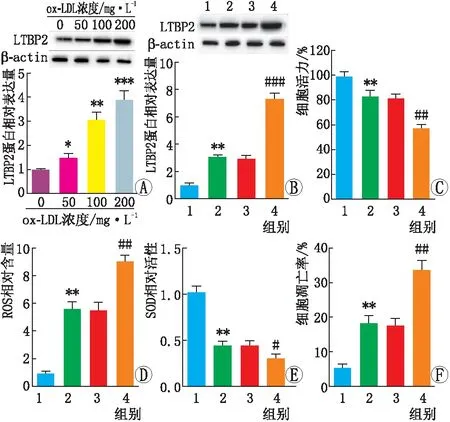
图2 过表达LTBP2对ox-LDL处理后ARPE-19细胞活力、氧化应激和凋亡水平的影响 A:Western blot检测经不同浓度ox-LDL处理后APRE-19细胞中LTBP2蛋白表达;与0 mg·L-1 ox-LDL处理后比较,*P<0.05,**P<0.01,***P<0.001。B-F:转染ov-LTBP2或ov-NC后各组ARPE-19细胞中LTBP2蛋白表达水平、细胞活力、ROS含量、SOD活性及细胞凋亡率;1为对照组,2为ox-LDL组,3为ox-LDL+ov-NC组,4为ox-LDL+ov-LTBP2组;与对照组相比,**P<0.01;与ox-LDL+ov-NC组相比,#P<0.05,##P<0.01,###P<0.01。
2.3 沉默 LTBP2对ox-LDL处理后APRE-19细胞氧化损伤的影响与ox-LDL+si-NC组相比,ox-LDL+si-LTBP2组APRE-19细胞LTBP2的蛋白表达水平、ROS含量及细胞凋亡率均降低,细胞活力、SOD活性均增加,差异均有统计学意义(均为P<0.05)(见图3)。
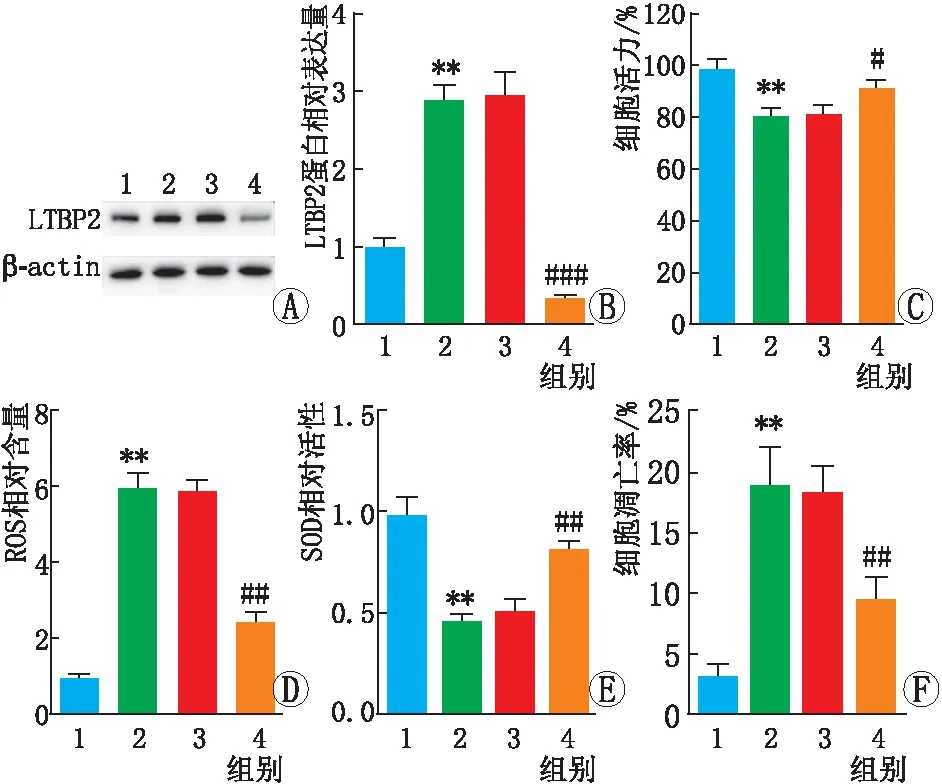
图3 沉默LTBP2对ox-LDL处理后ARPE-19细胞活力、氧化应激和凋亡水平的影响 A-B:Western blot检测转染si-NC或si-LTBP2后各组ARPE-19细胞中LTBP2蛋白表达;C-F:转染si-NC或si-LTBP2后各组ARPE-19细胞中细胞活力、ROS含量、SOD活性及细胞凋亡率。1为对照组,2为ox-LDL组,3为ox-LDL+si-NC组,4为ox-LDL+si-LTBP2组;与对照组相比,**P<0.01;与ox-LDL+si-NC组相比,#P<0.05,##P<0.01,###P<0.001。
2.4 LTBP2 调控VEGF对APRE-19细胞氧化损伤产生影响与对照组相比,ox-LDL+ov-NC组、ox-LDL+si-NC组APRE-19细胞中p-P38/P38比值和VEGF表达量均增加(均为P<0.01)。与ox-LDL+ov-NC组相比,ox-LDL+ov-LTBP2组APRE-19细胞p-P38/P38比值和VEGF表达量均增加(均为P<0.01),而与ox-LDL+si-NC组相比,ox-LDL+si-LTBP2组APRE-19细胞中p-P38/P38比值和VEGF表达量均降低(均为P<0.01)。与ox-LDL+si-LTBP2组相比,ox-LDL+si-LTBP2+VEGF组APRE-19细胞活力和SOD活性均降低,细胞凋亡率、ROS含量均增加(均为P<0.05)(见图4)。
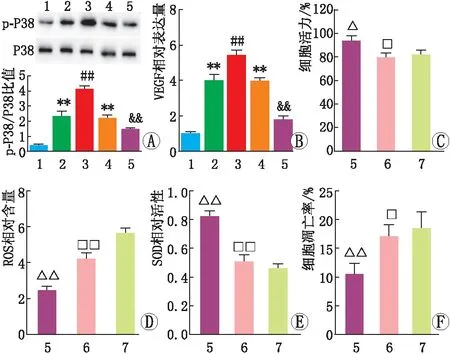
图4 LTBP2 调控VEGF对APRE-19细胞氧化损伤的影响 A:Western blot检测APRE-19细胞中p-P38和P38蛋白表达;B:ELISA检测APRE-19细胞中VEGF表达量;C-F:APRE-19细胞活力、ROS含量、SOD活性及细胞凋亡率检测。1为对照组,2为ox-LDL+ov-NC组,3为ox-LDL+ov-LTBP2组,4为ox-LDL+si-NC组,5为ox-LDL+si-LTBP2组,6为ox-LDL+si-LTBP2+VEGF组,7为ox-LDL组;与对照组比较,**P<0.01;与ox-LDL+ov-NC组比较,##P<0.01;与ox-LDL+si-NC组比较,&&P<0.01;与ox-LDL组比较,△P<0.05,△△P<0.01; 与ox-LDL+si-LTBP2组比较,□P<0.05,□□P<0.01。
3 讨论
LTBP2蛋白是一种细胞外基质蛋白,参与多种眼科疾病的发生发展过程[12]。LTBT2的异常表达不仅影响小梁网和巩膜胶原,还可能阻碍房水流出导致高眼压或青光眼的发生[14]。LTBP2基因沉默可以改善心肌细胞氧化应激损伤和炎症损伤,减少脂质氧化天然产物丙二醛、ROS及炎症因子白细胞介素-6(IL-6)和肿瘤坏死因子α(TNF-α)的表达[13]。本研究结果发现,ox-LDL处理APRE-19细胞后,LTBP2蛋白相对表达量显著增加,过表达 LTBP2 促进了ox-LDL导致的APRE-19细胞损伤,同时沉默LTBP2抑制了ox-LDL诱导的APRE-19细胞活力下降、氧化应激损伤和细胞凋亡增加。
MAPK信号通路在多种细胞过程,如细胞生长、增殖、分化和凋亡的调节中发挥关键作用[15]。多项研究结果表明,MAPK信号通路在RPE细胞的氧化应激过程中被激活[16-17]。本研究同样发现,MAPK信号通路在 ox-LDL 诱导的APRE-19细胞中被激活,且LTBP2加剧了ox-LDL导致的P38 MAPK 磷酸化的增加,而沉默 LTBP2 可以抑制p-P38 MAPK的表达。此结果与Sideek 等[18]报道一致,外源添加LTBP2可以促进p38 MAPK 激活。人上皮细胞中的VEGF在黄斑变性治疗过程中是一个重要的靶点,玻璃体内注射抗VEGF药物被广泛用于AMD的治疗[19]。因其疗效显著,长期使用相对安全,已成为临床上的主流治疗法[20]。多项研究结果表明,ox-LDL刺激会促进VEGF的产生[21-22],激活ERK1/2、JNK 或P38 MAPK同样可以促进VEGF表达[23]。而抑制JNK或P38 MAPK可以抑制ox-LDL诱导的VEGF合成[23]。本研究发现,过表达 LTBP2 加剧了ox-LDL导致的VEGF和p-P38 MAPK的增加,而沉默LTBP2可以抑制VEGF和p-P38 MAPK的表达。同时,外源添加VEGF部分抑制了沉默 LTBP2 对APRE-19细胞的保护作用。因此,结合文献报道我们认为,LTBP2可能通过激活P38 MAPK信号通路调控VEGF的表达。
Chen等[24]研究发现,LTBP2在鼻咽癌中发挥肿瘤抑制作用,并抑制VEGF分泌。然而众多研究表明,LTBP2是一个致癌基因,在多种肿瘤组织中高表达,与肿瘤的临床分期、不良预后呈正相关关系[25-27]。沉默LTBP2可以抑制胃癌细胞、甲状腺癌细胞的增殖、迁移、侵袭和上皮间质转化[25,28]。在本研究中,LTBP2通过激活P38 MAPK信号通路促进VEGF的表达。因此,还需进一步探索LTBP2和VEGF在不同疾病中是否表现出不同的调节机制。
本研究结果表明,ox-LDL可引起APRE-19细胞氧化应激和凋亡,并导致APRE-19细胞中LTBP2表达水平升高。过表达LTBP2加剧了ox-LDL诱导的氧化应激和凋亡,而沉默LTBP2则缓解了ox-LDL诱导的氧化应激和凋亡。过表达LTBP2通过激活P38 MAPK信号通路促进VEGF的表达。外源添加VEGF部分抑制了沉默LTBP2对APRE-19细胞的保护作用。因此,LTBP2可能通过P38 MAPK信号通路调控VEGF的表达参与ox-LDL引起的氧化应激损伤。但本研究只是在细胞层面探索了LTBP2在AMD发生发展过程中的可能作用机制,在动物体内LTBP2是否发挥同样的作用还需要做进一步的体内实验验证。因此,本实验小组计划使用LTBP2敲除小鼠构建AMD动物模型,进一步揭示LTBP2在AMD发展过程的作用机制,为开发治疗AMD新靶点奠定理论基础。
