人耐紫杉醇去势性前列腺癌细胞系的构建*
2021-07-02吴昌学李毅张婷彭煜晖张健禹文峰柏华张启芳
吴昌学, 李毅, 张婷, 彭煜晖, 张健, 禹文峰, 柏华, 张启芳**
(1.贵州医科大学 地方病与少数民族疾病教育部重点实验室 & 贵州省医学分子生物学重点实验室, 贵州 贵阳 550004; 2.贵州医科大学第三附属医院 医学实验中心, 贵州 都匀 558000)
前列腺癌是男性最常见的肿瘤之一,也是男性癌症相关死亡的主要原因,药物治疗仍然是控制前列腺癌的首要方法[1]。但有20%~30%的前列腺癌患者在确诊后3年内会发展为去势抵抗性前列腺癌(castration-resistant prostate cancer CRPC),大部分CRPC患者在治疗一段时间后会出现耐药的情况,给临床治疗带来困扰[3]。紫杉醇(paclitaxel,PTX)是一种从红豆杉树皮分离提纯、具有抗癌活性的类化合物[4-5],可诱导与促进微管蛋白聚合和装配、防止解聚,从而使微管稳定,并抑制癌细胞的有丝分裂和触发细胞凋亡,进而有效阻止癌细胞的增殖[6]。除肉瘤、淋巴瘤和白血病外,PTX还用于胃食管癌、子宫内膜癌、乳腺癌、晚期宫颈癌及前列腺癌的治疗[7-11],亦是治疗CRPC患者的标准抗癌药物之一,但在治疗过程中患者会发生获得性耐药[12]。因此,阐明人源去势性前列腺癌细胞株细胞对PTX耐药的分子机制,对于CRPC患者新的治疗策略研发至关重要。因此本研究以人源去势性前列腺癌细胞株DU145细胞作为研究对象,通过PTX浓度递增的方法处理DU145细胞、建立人耐PTX去势性前列腺癌细胞系,然后使用低于最高处理浓度的PTX培养基保持细胞株的活性,为后续研究提供人耐PTX去势性前列腺癌细胞模型。
1 材料与方法
1.1 材料
1.1.1细胞系 人源去势性前列腺癌细胞株DU145细胞购于美国模式培养物集存库(American type culture collection,ATCC)。
1.1.2主要试剂和仪器 PTX和二甲基亚砜(dimethyl sulfoxide,DMSO;美国 Sigma),Trizol(美国Invitrogen),cDNA 逆转录试剂盒(日本TaKaRa ),HiffTMq PCR SYBR Green Master Mix荧光定量试剂盒(上海翊圣),兔抗多耐药基因1(multiple drug resistant gene 1, MDR1)抗体、兔抗β-Tubulin抗体及辣根过氧化物酶标记的兔二抗(美国CST),二辛可宁酸(bicinchoninic acid,BCA)蛋白定量试剂盒和蛋白Marker(美国Thermo),超敏化学发光试剂盒(enhanced chemiluminescence,ECL)和聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(美国 Millipore),ELX800UV 酶标仪(美国Bio-Tec)。
1.2 方法
1.2.1细胞培养 DU145细胞培养于含10%胎牛血清、1×Antibiotic-Antimycotic的RPMI 1640培养液中,培养条件为含5%CO2的37 ℃培养箱。
1.2.2人耐PTX前列腺癌细胞株DU145R的构建及细胞核观察 采用浓度递增的方法(以1、4、6、8、10、及12 nmol/L的PTX)处理DU145细胞(处理过程中确保DU145细胞不会死亡),12 nmol/L浓度处理后存活的DU145细胞作为PTX耐药细胞株(命名为DU145R,此后以10 nmol/L的PTX维持培养),收集DU145R细胞,均分为4份,一份用于检测细胞活性,一份在100×显微镜下观察细胞核形态,另外2份用于人MDR1和c-Myc mRNA和蛋白表达水平的检测。以正常培养的DU145细胞作为对照。
1.2.3细胞活性检测 采用细胞增殖检测(cell counting kit-8,CCK8)法检测,将处于对数生长期的DU145、 DU145R细胞悬液调整细胞浓度为1×104个/孔,接种于96孔板中。使用0.25 μmol/L PTX处理 72 h,按照说明,使用CCK8试剂盒检测450 nm处的吸光度(optical density,OD)值,评估细胞活力。
1.2.4MDR1和c-MycmRNA表达水平 采用实时荧光定量PCR (quantitative real-time PCR,qPCR)检测,用Trizol试剂提取细胞总RNA,按cDNA 逆转录和荧光定量试剂盒说明书分别进行反转录和qPCR反应。qPCR 引物由武汉思特进科技发展有限公司合成,MDR1上游引物为5′-GCAGCTGGAAGACAAATACACAAA-3′,下游引物为5′-CCCCAACATCGTGCACATC-3′。c-Myc基因上游引物为5′- TACCCTCTCAACGACAGCAG-3′, 下游引物为5′- TCTTGACATTCTCCTCGGTG-3′。内参照次黄嘌呤磷酸核糖基转移酶(hypoxanthine-guanine phosphoribosyl transferase,HPRT)基因上游引物为5′-CATTATGCTGAGGATTTGGAAAGG-3′, 下游引物为5′-CTTGAGCACACAGAGGGCTACA-3′。反应条件为95 ℃预变性30 s,95 ℃变性5 s、 60 ℃退火30 s,40个循环。采集目的基因CT值,以内参照HPRT作为标准,计算MDR1和c-Myc基因相对表达量(RQ),RQ=2-ΔΔCt。
1.2.5MDR1 和c-Myc蛋白表达水平 采用Wes-tern blot法检测,提取细胞总蛋白,测定蛋白浓度,采用SDS聚丙烯酰胺凝胶电泳分离蛋白,将蛋白转移到PVDF膜上,常规一抗和二抗孵育后,ECL超敏免疫印迹检测试剂 (Amersham公司) 检测蛋白表达。
1.2.6c-MyCmRNA表达分析 用在线软件TIMER2.0 (http://cistrome.dfci.harvard.edu/TIMER/)的 Gene_差异表达模块分析癌症基因图谱( the cancer genome atlas ,TCGA)中所有肿瘤(20多种肿瘤数据, 包括患者的临床预后资料),分析c-Myc基因在肿瘤与邻近正常组织间的表达差异,其中包括前列腺癌。
1.3 统计学分析
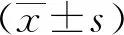
2 结果
2.1 DU145R细胞核变化
按照1、4、6、8、10、及12 nmol/L的PTX浓度处理DU145细胞后获得DU145R细胞,显微镜下观察发现,与正常培养的DU145细胞比较,耐药DU145R细胞出现多核化。见图1。
DU145 DU145R注:白色箭头所示为多核化。
2.2 DU145细胞与耐药DU145R细胞的活性
CCK8法检测结果显示,DU145细胞和DU145R细胞分别加入 0.25 μmol/L PTX处理 72 h后,DU145细胞活力(17.3%)低于DU145R细胞活力(79.2%),差异有统计学意义(P<0.01)。 见图2。
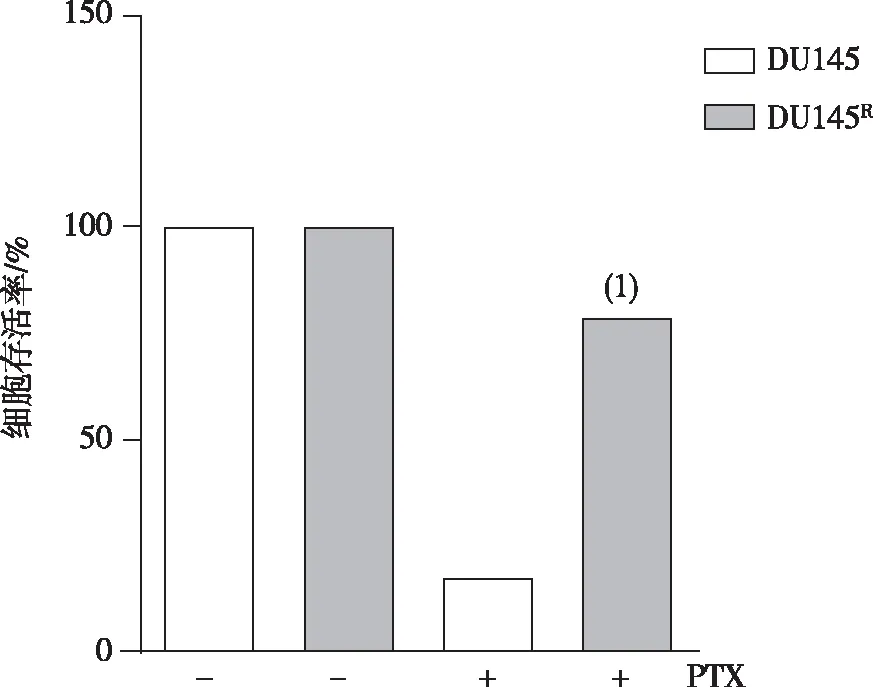
注:(1)与DU145细胞比较, P<0.01。
2.3 耐药细胞DU145R中MDR1表达
MDR1是许多肿瘤细胞耐药的标志。本研究结果显示, DU145R细胞的MDR1 mRNA 表达水平较DU145细胞上调了82.3倍,与DU145细胞比较,差异有统计学意义(P<0.01); MDR1蛋白在DU145细胞的表达很低,在DU145R细胞的表达水平也被上调。见图3。
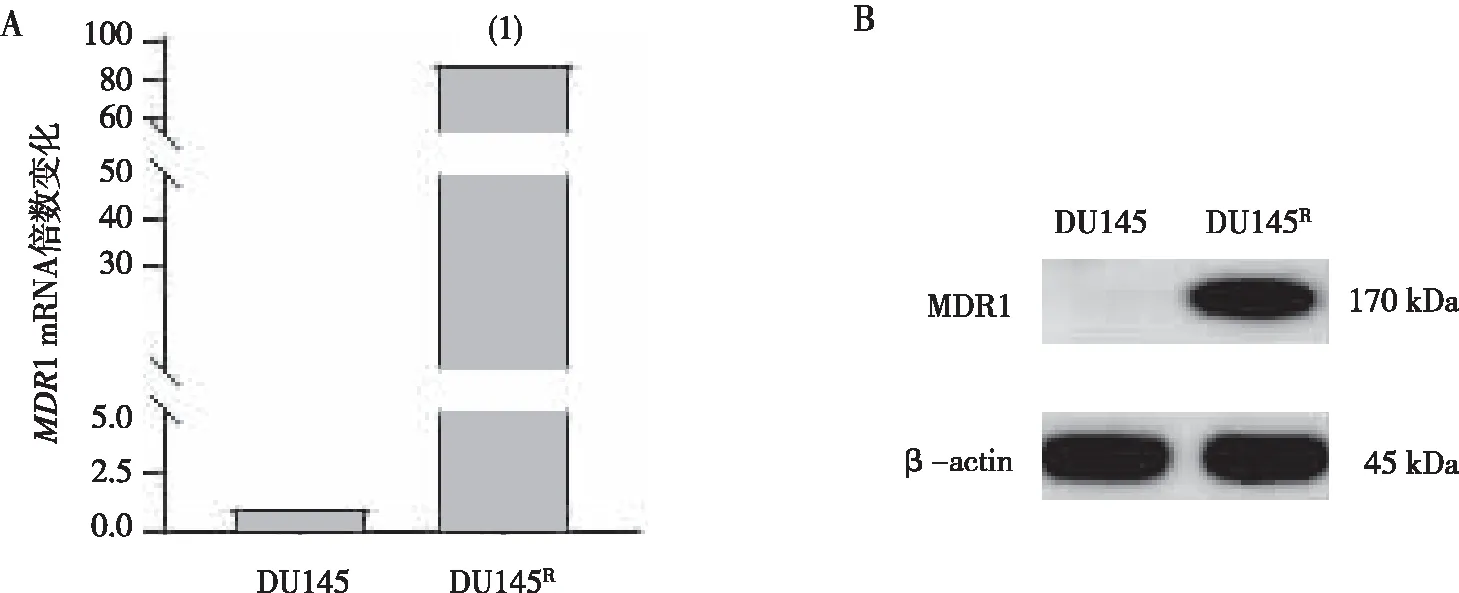
注:A为 MDR1 mRNA 表达,B为MDR1 蛋白表达;(1)与DU145细胞比较,P<0.001。
2.4 耐药细胞DU145R中c-Myc表达
研究结果显示, DU145R细胞的c-Myc mRNA 和蛋白表达水平较DU145细胞升高,差异有统计学意义(P<0.01);在线软件TIMER2.0分析发现, 与邻近正常组织比较,c-MycmRNA在多种肿瘤组织均有表达,但其表达水平有升高也有降低(P<0.05);在前列腺癌组织,c-MycmRNA表达水平升高(P<0.05)。见图4。

注: A为c-Myc mRNA 定量表达,B为c-Myc 蛋白表达及定量结果,C为 c-Myc在多种正常和肿瘤组织的mRNA表达,红色表示肿瘤组织, 兰色表示正常组织;红色方框线内为前列腺癌组织与前列腺组织c-Myc mRNA相对表达量; (1)与DU145细胞比较,P<0.001;与正常组织比较, (2)P<0.001,(3)P<0.05,(4)P<0.01。
3 讨论
运用PTX进行药物治疗能提高CRPC病人的生存率,是目前治疗CRPC患者的主要药物[12]。虽然治疗初期效果良好,但随着治疗时间的延长,可能会出现PTX耐药,影响了PTX的疗效,减少了CRPC患者治疗选择[13]。用化疗药诱导的耐药细胞,比较接近肿瘤患者肿瘤耐药细胞的表型[14], 这也是目前细胞水平研究肿瘤细胞耐药分子机制的主要手段[14]。使用PTX诱导产生的耐药细胞系是在体外单纯环境下诱导的,没有肿瘤微环境的影响,耐药细胞系不可能完全与肿瘤病人肿瘤耐药细胞的表型一致;其次,从肿瘤病人获取肿瘤耐药细胞的前提是病人只使用了一种药物,产生了耐药,这种耐药细胞非常难得[14]。除此之外,相同肿瘤的病人对相同药物耐药的细胞表型也不完全一致。
研究表明耐药细胞多核化是耐药细胞的变化之一,多核多倍体促进人源去势性前列腺癌细胞株细胞PC3多西他赛的耐药性[15];卡巴他赛处理导致人源去势性前列腺癌细胞多核化增强了卡巴他赛的抗性[15]。这些研究支持本研究的结果,建立的DU145R细胞出现多核化。PTX通过作用肿瘤细胞微管起到抑制肿瘤细胞生长,但是长期的PTX刺激,出现多核多倍体,引起细胞增大,暗示PTX改变细胞核的功能,将在后续工作中研究PTX对细胞核的作用。
此外,细胞活力(生长曲线)的测定结果表明在PTX处理后DU145R细胞活性明显高于DU145细胞活性,说明DU145R细胞比DU145细胞对PTX敏感性降低,具有抵抗性。人源去势性前列腺癌细胞PTX耐药的机制比较复杂,其中MDR1 上调是其中之一。MDR1是ATP-结合盒(ATP-binding cassette, ABC)转运蛋白家族成员之一[16],是ATP依赖性药物外排泵, 即MDR1把药物运到细胞外,阻止了药物对细胞发挥作用。MDR1表达上调是肿瘤细胞产生多药耐药(multi-drug resistance, MDR)的重要机制之一。 MDR1的表达在PTX耐药的人源去势性前列腺癌细胞株PC3被上调; 在多西他赛前列腺癌被上调;在卵巢癌细胞MDR1表达促进了PTX和奥拉帕尼耐药[17-19]。与前人研究结果相似, 与DU145相比,MDR1在本研究建立的DU145R细胞的表达在mRNA和蛋白水平被上调,说明DU145R细胞具有耐药性。
除此之外,越来越多的证据表明c-Myc是促进肿瘤细胞化疗耐药的主要原因之一,如持续诱导c-Myc表达有助于胰腺导管癌细胞中的nab-PTX耐药性,抑制 c-Myc可以减轻前列腺癌中的恩杂鲁胺(enzalutamide)耐药性,降低急性白血病对BET抑制剂的耐药[20-22]。c-Myc 协调髓细胞白血病基因-1(myeloid cell leukemia-1,MCL-1)共同促进乳腺癌细胞化疗耐药, 维持c-Myc表达促进人源去势性前列腺癌细胞对BET bromodomain 抑制剂的获得性耐药,沉默c-Myc表达可以增强CRPC细胞对PTX的敏感性[23-25]。这些研究支持本研究的实验结果,c-Myc在DU145R细胞表达明显高于DU145细胞。
综上所述,本次实验成功建立了耐PTX前列腺癌细胞系,为后续研究提供了PTX CRPC细胞耐药模型。
