脊髓集落刺激因子1在大鼠吗啡镇痛耐受中的作用
2021-07-01赵昱,吴军,安扬,常青
赵 昱,吴 军,安 扬,常 青
吗啡镇痛耐受是指吗啡的镇痛效能进行性降低,只有不断加大使用剂量才能维持同等镇痛效果,其严重限制了吗啡在临床重度疼痛治疗中的应用。相关研究[1]证实,脊髓内小胶质细胞激活导致的神经炎性反应在吗啡镇痛耐受的形成中发挥重要作用。集落刺激因子1(colony-stimulating factor 1,CSF1)是一种对单核细胞的增殖、分化及维持活性发挥重要作用的细胞因子。研究[2]表明,使用CSF1受体(CSF1R)拮抗剂可以阻断小胶质细胞的激活。神经病理性疼痛的研究[3]发现,感觉神经元中CSF1缺失可以完全阻断神经损伤诱导的机械性痛觉过敏,并抑制小胶质细胞活化和增殖,相反,鞘内注射CSF1可以诱发机械性痛觉过敏和小胶质细胞增殖。但在吗啡耐受机制研究中对CSF1的研究仍较少,鉴于吗啡镇痛耐受和神经病理性疼痛有着许多相同的神经生物学机制,推测脊髓CSF1可能参与吗啡耐受过程。因此,本文通过鞘内连续注射吗啡建立吗啡镇痛耐受的在体模型[4],旨在探讨吗啡镇痛耐受形成过程中大鼠脊髓CSF1的表达变化,以及CSF1R拮抗剂是否能够抑制吗啡镇痛耐受的形成,以期为阐明脊髓CSF1在吗啡镇痛耐受中的作用提供实验资料。
1 材料与方法
1.1 材料与试剂
1.1.1 动物 清洁级雄性SD大鼠,体质量(220±10)g,购自哈尔滨医科大学实验动物中心。屏蔽系统环境:光照周期12 h,光照时间8:00-20:00,温度(23±1)℃,所有操作和动物处理遵循国家卫生机构制定的实验室动物指南。
1.1.2 药物与试剂 盐酸吗啡(沈阳第一制药厂,生产批号:120909);CSF1R拮抗剂PLX3397(Selleck公司,美国)和IBA-1兔多克隆抗体(1∶400,Wako,日本);荧光素标记羊抗兔二抗(1∶1 000,Millipore,美国);CSF1小鼠单克隆抗体(1∶1 000,Millipore,美国);β-Tubulin兔多克隆抗体(1∶1 000,Abcam,英国)。
1.2 方法
1.2.1 大鼠鞘内置管术 腹腔注射苯巴比妥钠(35~45 mg/kg)麻醉大鼠。以髂嵴连线确定第5腰椎间隙。切开L5背部皮肤,分离椎旁肌,钳去L6腰椎部分脊突,暴露出第5腰椎间隙。用8号针头倾斜60°角插入椎间隙。大鼠尾部或后肢突然抽动表明针头进入蛛网膜下腔。退出针头,将事先充满0.9%氯化钠溶液的microspinal导管插入第5椎间隙,管腔中有清亮液体反流表明导管进入蛛网膜下腔。将导管朝头端方向插入2~2.5 cm,使导管末端位于脊髓腰骶部。封闭导管外口并把皮肤外的导管固定于腰部的皮肤。以4-0手术线分层缝合肌肉与皮肤。大鼠术后至少恢复4 d 后开始实验。术后出现后肢或尾部瘫痪、运动功能障碍的动物从实验中排除并立即注射过量苯巴比妥钠注射致死。实验结束取材时观察导管位置,确定导管末端位置。位置不正确的大鼠行为学数据从该组中排除。
1.2.2 分组与给药 成功鞘内置管SD大鼠60只,按随机数字表法分为0.9%氯化钠溶液组(NS组)、吗啡组(MOR组)、CSF1R抑制剂组(PLX3397组)、CSF1R抑制剂+吗啡组(PLX3397+MOR组),各15只。其中NS组连续7 d鞘内及灌胃给予等容积0.9%氯化钠溶液;MOR组连续7 d鞘内给予15 μg吗啡(20 μL);PLX3397组连续7 d鞘内给予等容积0.9%氯化钠溶液,灌胃给予CSF1R抑制剂PLX3397(290 mg/kg);PLX3397+MOR组连续7 d鞘内给予15 μg吗啡(20 μL),并灌胃给予CSF1R抑制剂PLX3397(290 mg/kg)[5]。分别于鞘内注射1、3、5、7 d进行大鼠疼痛行为学测量,并于注射吗啡7 d后断头处死大鼠,Western blotting法测定腰段脊髓CSF1表达,免疫荧光染色法检测腰段脊髓小胶质细胞活化情况。
1.2.3 疼痛行为学测试 (1)甩尾潜伏期法(tail flick latency,TFL):于给药30 min后,用热水(50±0.2)℃甩尾法测定甩尾阈值。待大鼠尾巴迅速甩离水面时用秒表记录从大鼠尾部入水到开始甩尾的时间,此时间为大鼠热水甩尾潜伏期(s)。大鼠尾部在热水中停留最长时间为15 s(cut-off time),以免对尾部造成损伤。给药前为基础甩尾潜伏期(basal tail flick latency,BL),给药后为实验甩尾潜伏期(test tail flick latency,TL)。按照上述方法连续测定3次,每次间隔2 min。将3次潜伏期的平均值作为痛阈值。基础阈值3~5 s,阈值超过5 s的动物从实验中排除。(2)机械缩足反射阈值法(mechanical withdrawal threshold,MWT):用von Frey纤维丝以up-down法推算50%机械缩足反射阈值。将一有机玻璃箱(22 cm×12 cm×22 cm)置于金属筛网上,待大鼠在有机玻璃箱中适应15 min后,用von Frey纤维丝垂直刺激大鼠后肢足底中部,持续时间≤4 s,大鼠出现抬足或舔足行为视为阳性反应,否则为阴性反应。测定首先从2 g开始,当该力度的刺激不能引起阳性反应,则给予相邻大一级力度的刺激;如出现阳性反应则给予相邻小一级力度的刺激,如此连续进行,直至出现第一次阳性和阴性反应的骑跨,再连续测定4次。最大力度为15 g,大于此值时记为15 g。每次刺激间隔30 s。给药前为基础缩足反射阈值(BL),给药后为实验缩足反射阈值(TL)。每次给药前及给药后30 min分别测定阈值,将所得的BL、TL带入公式%MPE=(TL-BL)/(cut-off time-BL)×100%。以%MPETFL和%MPEMWT作为行为学结果。
1.2.4 Western blotting法检测脊髓CSF1表达 戊巴比妥钠腹腔注射深麻醉后断头处死大鼠(n=4),迅速分离腰段脊髓(L4~L6节段)组织,液氮速冻后-80 ℃深低温冰箱保存。提取蛋白时,将组织放入2 mL匀浆器中,按1 mL/100 mg比例加入预冷的蛋白提取液(KeyGEN全蛋白提取试剂盒),充分匀浆后冰上裂解15 min,转移至洁净EP管后4 ℃、12 000 r/min离心15 min,取上清液即为蛋白提取液。用BCA蛋白质测定试剂盒(Peirece,美国)进行蛋白定量。配制12% SDS-PAGE凝胶,每个泳道上样量均为100 μg,120 V恒压电泳70 min,待溴酚蓝染料到达凝胶底部时停止电泳。80 V恒压湿法转膜80 min,将凝胶上的蛋白转移至0.45 μm孔径PVDF膜上,转膜后使用封闭液室温封闭1 h,一抗(CSF1小鼠单克隆抗体1∶1 000,β-Tubulin兔多克隆抗体1∶1 000)4 ℃孵育过夜,辣根过氧化物酶标记种属特异性二抗(山羊抗小鼠及山羊抗兔抗体1∶5 000)室温摇床孵育1 h,使用ECL化学发光液于荧光和可见光凝胶成像系统(Alpha Innotech)显影并进行条带灰度分析,通过计算目的蛋白条带灰度值与内参照蛋白条带灰度值的比值,半定量分析目的蛋白表达情况。
1.2.5 免疫荧光染色法检测脊髓小胶质细胞激活 疼痛行为学测定结束后,戊巴比妥钠腹腔注射深麻醉后断头处死大鼠(n=3)。用预冷的0.9%氯化钠溶液100 mL和4%多聚甲醛400 mL经左心室灌注固定。将腰段脊髓(L4~L6)即腰膨大取出,4%多聚甲醛后固定2 h后置入蔗糖溶液梯度脱水。冰冻切片机(LEICA)切片(片厚12 μm)。IBA-1兔多克隆抗体(1∶400)4 °C 孵育过夜,荧光素标记羊抗兔二抗(1∶1 000)37 °C避光孵育1 h,各步骤间用PBS冲洗3次,5分钟/次,50%甘油封片后荧光显微镜拍片,并用Image pro-Plus 6.0软件进行数据分析。
1.3 统计学方法 采用方差分析和q检验。
2 结果
2.1 CSF1R拮抗剂对吗啡镇痛耐受的影响 MOR组和MOR+PLX3397组在吗啡注射1 d时均产生最大镇痛作用(P<0.05),2组%MPETFL和%MPEMWT差异均无统计学意义(P>0.05)。注射吗啡3 d时MOR组大鼠开始出现镇痛耐受,至7 d时形成明显耐受,MOR组%MPE进行性降低(P<0.05)。MOR+PLX3397组大鼠接受吗啡注射后3、5、7 d时,与MOR组%MPE差异均有统计学意义(P<0.05)。PLX3397组与NS组各时点%MPE差异均无统计学意义(P>0.05)(见表1)。
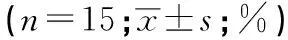
表1 4组大鼠鞘内注射给药后不同时点%MPETFL和%MPEMWT比较
2.2 CSF1R拮抗剂对脊髓小胶质细胞激活的影响 注射吗啡7 d后,MOR组小胶质细胞标志物IBA-1在大鼠腰段脊髓背角表达较NS组增加(P<0.05),MOR+PLX3397组大鼠IBA-1表达较MOR组减少(P<0.05),NS组与PLX3397组大鼠腰段脊髓背角IBA-1表达差异无统计学意义(P>0.05)(见表2)。
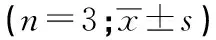
表2 4组大鼠IBA-1阳性细胞比较
2.3 CSF1R拮抗剂对脊髓CSF1表达的影响 注射吗啡7 d后,MOR组和MOR+PLX3397组大鼠腰段脊髓CSF1表达均较NS组增加(P<0.05),MOR组和MOR+PLX3397组CSF1表达差异无统计学意义(P>0.05),NS组与PLX3397组CSF1表达差异无统计学意义(P>0.05)(见表3)。
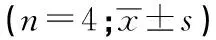
表3 4组大鼠脊髓CSF1蛋白表达比较
3 讨论
本实验结果证实,慢性吗啡处理能激活大鼠脊髓CSF1的表达,而给予CSF1R拮抗剂,不仅可以明显抑制吗啡镇痛耐受的形成,还可以抑制脊髓背角小胶质细胞的激活。提示脊髓CSF1参与吗啡镇痛耐受形成。
吗啡等阿片类药物用于治疗疼痛已有数千年历史。吗啡耐受是慢性吗啡诱导的一种适应性过程,表现为μ阿片受体在分子水平以及突触和细胞水平上的复杂变化。现已证实,吗啡可以引起中枢神经系统神经炎性反应[6],这与吗啡镇痛的抑制以及吗啡诱导的耐受性、依赖性和药物滥用直接相关[7]。有研究[8]表明,激活的小胶质细胞和星型胶质细胞在吗啡镇痛耐受中发挥重要作用,而抑制胶质细胞激活可以降低吗啡耐受发生。
有研究[9]发现,阻断CSF-1R信号通路可以有效减轻坐骨神经部分结扎引起的神经病理性疼痛,并能够抑制脊髓内小胶质细胞激活。CSF-1R是一种受体酪氨酸激酶,在巨噬细胞、破骨细胞、朗格汉斯细胞、非造血细胞和中枢神经系统小胶质细胞上均有表达,CSF-1R具有两种同源配体,即CSF-1和IL-34,它们在中枢神经系统表达区域呈现出不重叠性,调节小胶质细胞增殖和存活。CSF-1R的表达随脑发育而显著下降,而IL-34和CSF-1的表达则维持在较高水平。CSF-1又称巨噬细胞集落刺激因子,是调控组织巨噬细胞和破骨细胞的主要生长因子。小胶质细胞是广泛分布于中枢神经系统的巨噬细胞,是免疫防御的第一道防线,在炎症反应中被激活。本研究选用的PLX3397是一种口服有效的CSF1R抑制剂,具有高度选择性及能透过血脑屏障的特点,可用于特异性的小胶质细胞的消除[5]。
鉴于吗啡镇痛耐受和神经病理性疼痛有着许多相同的神经生物学机制,本研究发现,慢性吗啡处理可以上调脊髓内CSF1表达,以及激活脊髓背角小胶质细胞,而CSF1R抑制剂PLX3397可以抑制吗啡镇痛耐受的形成,及抑制脊髓背角小胶质细胞的激活,这些结果表明CSF1可能介导了吗啡镇痛耐受的形成。在神经病理性痛模型中,脊髓CSF1来源于受损感觉神经元分泌已有报道[3],但在吗啡镇痛耐受模型中,导致脊髓内CSF1表达增加的细胞来源还有待实验进一步证实。
综上所述,CSF1介导了吗啡耐受的形成。本文为深入阐明吗啡耐受机制提供了新的实验资料,为防治吗啡耐受提供了新的研究方向。
