血清miR-182、SP-D水平与脓毒症患者预后的关系*
2021-07-01吴梅秋邱名耀王海曼黎晓虹
吴梅秋,邱名耀,王海曼,黎晓虹
海南医学院第一附属医院:1.创伤ICU;2.急诊科,海南海口 570102
脓毒症是严重感染、创伤、休克、大手术后常见的并发症及患者死亡原因之一,是由各种致病微生物感染引起的全身炎症反应综合征(SIRS),可进一步导致多器官功能衰竭,其中肺是最易发生感染的器官[1-2]。近年来,脓毒症发病率及病死率呈逐年上升趋势,已对人类健康造成严重威胁。既往研究多以白细胞计数及其分类、C反应蛋白等指标来评估脓毒症患者的预后,但上述指标特异度较低[3-4]。因此,积极探索与脓毒症预后有关的分子生物学指标,制订完善的预后评价系统,将有利于防止脓毒症患者病情恶化并改善其预后。微小RNA(miRNA)是一类高度保守的内源性非编码核苷酸,在细胞生长、发育、分化中发挥重要的调节作用[5]。miRNA-182是miRNA家族的一员,定位于人7号染色体(7p32.2),与肿瘤发生发展、炎性反应有关[6]。肺表面活性蛋白D(SP-D)属于C型凝集素超家族成员,参与病原体的清除及免疫反应﹑炎性反应和过敏反应的调节,与肺部疾病有关[7]。目前,有关血清miR-182、SP-D在脓毒症患者中的表达情况及与预后关系的研究较少,本研究对此进行了相关探讨,以期为临床诊治工作提供参考。
1 资料与方法
1.1一般资料 选取2018年6月至2020年5月本院创伤ICU收治的脓毒症患者120例作为脓毒症组,其中男59例,女61例;年龄40~83岁,平均(62.18±10.52)岁。根据脓毒症患者28 d时的预后情况又将其分为死亡组26例,存活组94例。另选取同期非脓毒症引起的SIRS患者120例作为SIRS组,其中男60例,女60例;年龄40~83岁,平均(62.55±10.19)岁。选取同期健康体检者120例作为对照组,其中男63例,女57例;年龄41~83岁,平均(62.27±10.26)岁。脓毒症组、SIRS组与对照组性别、年龄等基线资料比较,差异均无统计学意义(P>0.05),具有可比性。纳入标准:(1)脓毒症组患者均符合脓毒症相关诊断标准[8],即存在感染、序贯器官衰竭评分(SOFA)[9]≥2分;(2)SIRS组患者符合SIRS相关诊断标准[10],即体温>38 ℃或<36 ℃,心率>90次/分,呼吸频率>20次/分或二氧化碳分压(PaCO2)<4.6 kPa,白细胞计数>12×109/L或<4×109/L;(3)临床资料完整者。排除标准:(1)近期使用免疫抑制剂治疗的患者;(2)不愿意配合本研究的患者。本研究获得本院医学伦理委员会批准后实施,所有受试对象及其家属均签署知情同意书。
1.2仪器与试剂 SP-D酶联免疫吸附试验(ELISA)试剂盒(货号SEA480Hu-1)购自上海恒斐生物科技有限公司;Trizol试剂(货号MN562J2)、反转录试剂盒(货号J6547M)、SYBR Premix Ex Taq荧光定量PCR试剂盒(货号N5643MJ)购自美国Sigma公司;miR-182及内参U6引物由生工生物工程(上海)有限公司合成;荧光定量PCR分析仪(型号QuantGene 9600)购自杭州博日科技有限公司。
1.3方法
1.3.1资料收集 收集脓毒症组患者的临床资料,包括性别、年龄、感染部位、降钙素原(PCT)水平。采用急性生理与慢性健康状况Ⅱ(APACHE Ⅱ)评分对脓毒症组患者入院时疾病严重程度进行评分,以急性生理评分、年龄评分、慢性健康评分3项指标为评分依据,最高分为71分,分数越高,病情越严重[11]。
1.3.2标本采集 收集所有患者入院后24 h内及体检者体检当日空腹肘静脉血5 mL,静置25~30 min,室温条件下以4 000 r/min离心10 min,取上清液,于-80 ℃冰箱中保存,备用。
1.3.3血清SP-D水平检测 从-80 ℃冰箱中取出血清标本,解冻,采用ELISA检测血清SP-D水平,操作均严格按照试剂盒说明书进行。
1.3.4血清miR-182水平检测 从-80 ℃冰箱中取出血清标本,按照试剂盒说明书提取总RNA,参照反转录试剂盒说明书将RNA反转录为cDNA。参照荧光定量PCR试剂盒说明书进行实时荧光定量PCR反应,所用引物序列见表1。反应体系为20 μL:SYBR Premix Ex Taq 10 μL,cDNA 1 μL,H2O 8 μL,上下游引物各0.5 μL。反应步骤:95 ℃预处理20 s,95 ℃ 10 s,60 ℃ 20 s,72 ℃ 10 s,共40个循环。以U6作为内参基因,采用2-ΔΔCt法计算血清miR-182相对表达水平。

表1 引物序列
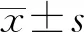
2 结 果
2.1对照组、SIRS组、脓毒症组血清miR-182、SP-D水平比较 与对照组比较,SIRS组、脓毒症组血清miR-182、SP-D水平均明显升高,差异有统计学意义(P<0.05);与SIRS组比较,脓毒症组血清miR-182、SP-D水平均明显升高,差异有统计学意义(P<0.05)。见表2。
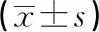
表2 对照组、SIRS组、脓毒症组血清miR-182、SP-D水平比较
2.2存活组与死亡组临床资料比较 存活组与死亡组性别、年龄、感染部位比较,差异无统计学意义(P>0.05);死亡组APACHE Ⅱ评分、血清PCT水平均明显高于存活组,差异有统计学意义(P<0.05)。见表3。

表3 存活组与死亡组临床资料比较
2.3存活组与死亡组血清miR-182、SP-D水平比较 与存活组比较,死亡组血清miR-182、SP-D水平均明显升高,差异有统计学意义(P<0.05)。见表4。
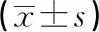
表4 存活组与死亡组血清miR-182、SP-D水平比较
2.4脓毒症患者血清miR-182、SP-D、PCT水平与APACHE Ⅱ评分的相关性分析 Pearson相关分析结果显示,脓毒症患者血清miR-182、SP-D、PCT水平与APACHE Ⅱ评分均呈正相关(r=0.623、0.597、0.433,P<0.05)。见表5。

表5 血清miR-182、SP-D、PCT水平与APACHE Ⅱ评分的相关性
2.5血清miR-182、SP-D水平与脓毒症患者28 d短期生存率的关系 根据miR-182、SP-D水平均值(3.96、172.53 ng/mL)将脓毒症患者分为miR-182高表达组(58例)与miR-182低表达组(62例),SP-D高表达组(60例)与SP-D低表达组(60例)。miR-182高表达组与SP-D高表达组的28 d累积生存率分别为65.52%(38/58)、70.00%(42/60);miR-182低表达组与SP-D低表达组的28 d累积生存率分别为90.32%(56/62)、86.67%(52/60)。miR-182低表达组的28 d累积生存率明显高于miR-182高表达组,差异有统计学意义(χ2=11.742,P=0.001);SP-D低表达组的28 d累积生存率明显高于SP-D高表达组,差异有统计学意义(χ2=5.447,P=0.020)。Kaplan-Meier生存曲线见图1、2。
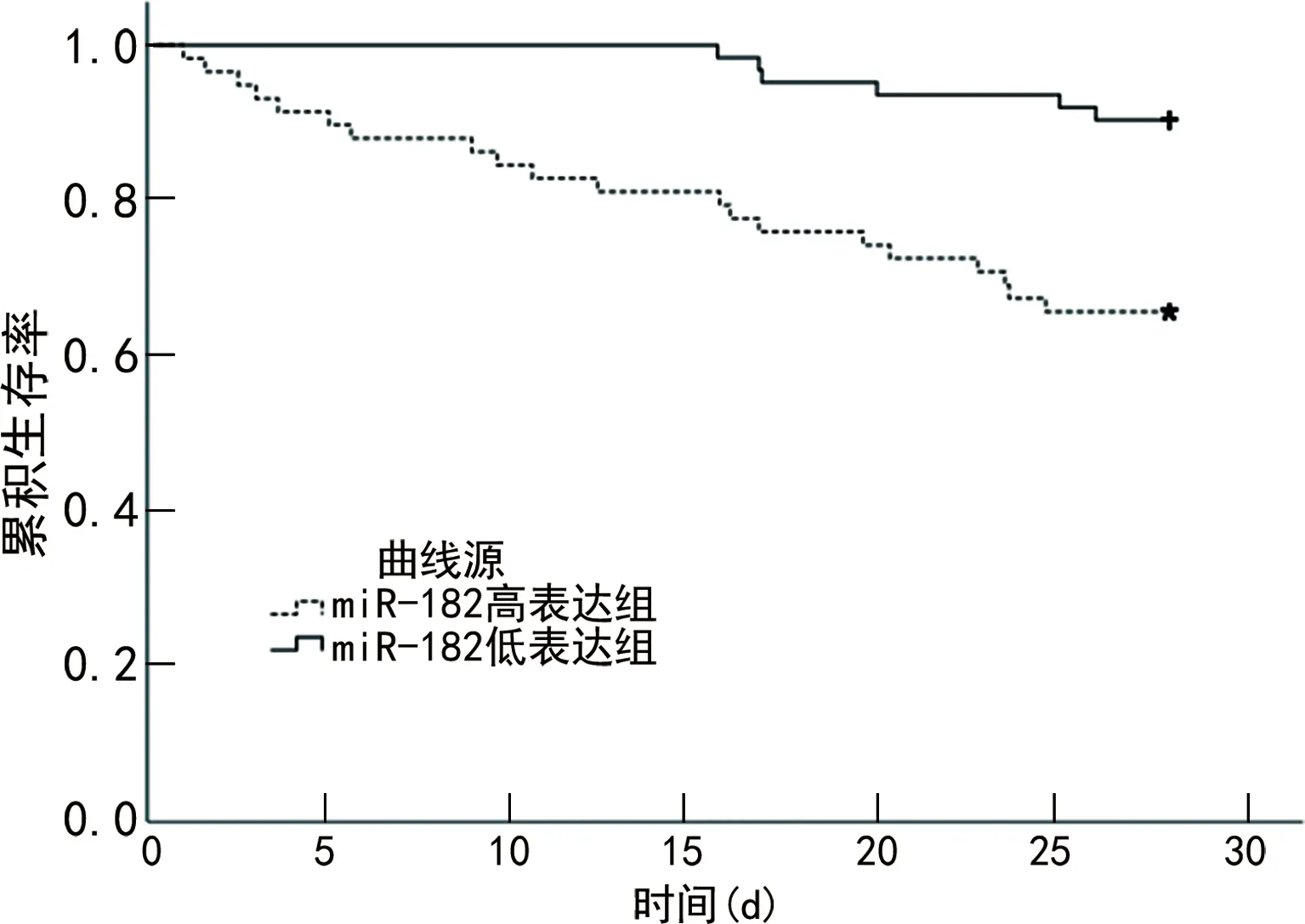
图1 miR-182高、低表达组患者的Kaplan-Meier生存曲线
2.6脓毒症患者死亡的危险因素分析 以脓毒症患者是否死亡为因变量,以血清miR-182、SP-D、APACHEⅡ评分、PCT水平为自变量进行多因素Logistic回归分析,结果显示,miR-182、SP-D、APACHEⅡ评分、PCT水平升高是脓毒症患者死亡的独立危险因素(P<0.05)。见表6。
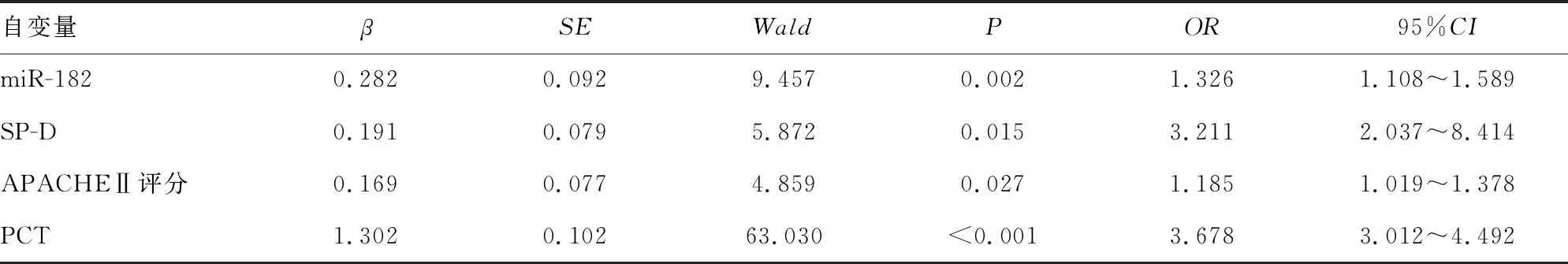
表6 脓毒症患者死亡的危险因素分析
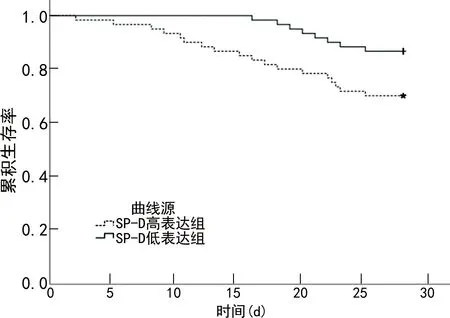
图2 SP-D高、低表达组患者的Kaplan-Meier生存曲线
3 讨 论
脓毒症作为一种SIRS,由感染引起,是ICU常见的危重症,极易引发多器官功能衰竭,若不及时诊断、治疗,其病死率可高达80%[12]。因此,积极探寻分子生物学指标,及早评估脓毒症预后并及时采取相应措施,对降低脓毒症患者的死亡风险,改善患者预后有重大意义。
miRNA是一类非编码短链RNA,长度为18~25个核苷酸,可以调节细胞早期发育,参与组织细胞分化与成熟,调控基因表达[13]。研究证实,miRNA可通过影响多种靶基因的表达及生物合成来调控炎性反应的发生[14]。miR-182的表达水平受基因转录和miRNA加工等调控,与免疫炎性反应关系密切。既往研究显示,脓毒症大鼠血清miR-182水平明显高于健康大鼠[15]。也有研究发现,与健康对照者比较,早期脓毒症患者血清miR-182水平明显升高,可作为早期脓毒症的诊断标志物[16]。本研究结果显示,脓毒症组血清miR-182水平明显高于对照组和SIRS组,死亡组血清miR-182水平明显高于存活组,提示血清miR-182高表达可能与脓毒症的发生、发展及预后关系密切,原因可能是脓毒症发生、发展过程中存在着明显的免疫功能紊乱,Toll样受体(TLR)信号通路是发挥抗炎及修复作用的重要调节通路,涉及多种炎症因子,而miR-182是TLR信号通路的调控因子,其与白细胞介素-1β、肿瘤坏死因子-α等炎症因子的产生有关[17]。SP-D属于肺表面活性物质,能降低肺表面张力,维持肺泡腔内肺表面活性物质磷脂的正常结构及功能,促进免疫系统对病原菌的清除,进一步抑制炎症因子的释放及淋巴细胞的增生[18]。当肺部受到感染后,肺血管内皮细胞抗凝血酶-2的完整性受损,肺血管通透性增加,促使肺泡中的SP-D向血管内渗透,进入血液循环,使血清中SP-D水平升高[19]。因此,血清SP-D水平变化可用于判断脓毒症患者病情变化及指导临床治疗。周江等[20]研究发现,与健康对照组比较,脓毒症组血清SP-D水平明显升高,且SP-D水平对脓毒症所致靶器官损伤的病情评估有一定指导意义。本研究结果显示,脓毒症组血清SP-D水平明显高于SIRS组及对照组,死亡组血清SP-D水平明显高于存活组,提示血清SP-D高表达可能与脓毒症发生、发展及预后关系密切,原因可能是脓毒症患者极易出现肺损伤,使肺血管通透性增加,促使肺泡中的SP-D向血管内渗透,进入血液循环,从而使血清SP-D水平异常升高。APACHEⅡ评分是根据患者年龄和既往健康状况对生命体征进行的评分,能够反映疾病严重程度[21]。PCT与细菌感染有关,对炎性反应有较高的敏感性及特异性[22]。本研究中,死亡组APACHE Ⅱ评分、PCT水平明显高于存活组,提示APACHE Ⅱ评分及PCT水平与脓毒症患者的预后有关。Pearson相关分析结果显示,死亡组血清miR-182、SP-D、PCT水平与APACHE Ⅱ评分均呈正相关,提示miR-182、SP-D、PCT也可用于反映脓毒症患者的病情严重程度。
对脓毒症患者28 d短期预后进行评价,对死亡的高危患者进行甄别,并早期给予适当干预,能够减缓或逆转病情恶化、减少病死率。宋中海等[23]研究显示,血清PCT、中性粒细胞CD64百分比等指标联合应用可评价脓毒症患者28 d病情转归情况,对于制订最佳治疗方案,改善患者预后有重要意义。本研究中,miR-182低表达组28 d累积生存率明显高于miR-182高表达组,SP-D低表达组28 d累积生存率明显高于SP-D高表达组;且进一步分析发现,miR-182、SP-D、APACHEⅡ评分、PCT水平升高均是脓毒症患者死亡的独立危险因素。说明监测血清miR-182、SP-D、PCT水平并及时进行APACHEⅡ评分对临床评估脓毒症患者的预后有重要意义,APACHEⅡ评分、miR-182、SP-D、PCT水平升高的脓毒症患者短期死亡风险较大,对该部分患者在治疗中应予以重点关注。
综上所述,脓毒症患者血清miR-182、SP-D水平异常升高,是患者死亡的独立危险因素,可为脓毒症患者临床预后评估提供一定参考。
