SIRT3过表达抑制肝癌细胞的迁移与侵袭*
2021-07-01宋春丽周义文
宋春丽,张 琰,周义文
南方医科大学深圳医院临床检验医学中心,广东深圳 518100
肝癌是我国常见的恶性肿瘤,其起病隐匿、进展迅速、恶性程度高、病死率高[1]。sirtuin蛋白家族是近年来发现的一类烟酰胺腺嘌呤二核苷酸(NAD)依赖的组蛋白去乙酰化酶,包括沉默信息调节因子(SIRT)1~SIRT7。其中,SIRT3是线粒体内主要的去乙酰化酶,其在被线粒体基质加工肽酶切割后活化,全长SIRT3驻留在细胞核中,在相关因素(例如DNA损伤)影响下,SIRT3会迁移到线粒体内。SIRT3目前已知的功能包括参与细胞凋亡、能量代谢、热量限制、氧化应激等[2-6]。近年来,关于SIRT3在肿瘤发生、发展中的作用受到越来越多的关注。本研究在肝癌细胞株Huh-7中转染pc-DNA3.1质粒(对照)及SIRT3质粒,用细胞划痕实验和细胞侵袭实验来探索SIRT3基因过表达对肝癌细胞迁移能力和侵袭能力的影响。
1 材料与方法
1.1材料来源 人肝癌细胞株Huh-7来自美国典型培养物保藏中心(ATCC)。
1.2仪器与试剂 蛋白质印迹法(Western blot)电泳仪、电转膜仪、实时荧光定量PCR(RT-qPCR)扩增仪均购自美国伯乐公司;高速低温离心机购自德国艾本德股份有限公司;酶标仪购自美国Genecopoeia公司;DMEM培养基、胎牛血清、二甲基亚砜(DMSO)、青链霉素双抗购自美国赛默飞世尔公司;对照pc-DNA3.1质粒、构建在载体pc-DNA3.1上的SIRT3质粒购自美国Addgene公司;SIRT3引物由生工生物工程(上海)股份有限公司合成;SYBR Green PCR反应混合液购自瑞士Roche公司;反转录PCR试剂盒购自美国伯乐公司;蛋白浓度检测试剂盒购自上海碧云天生物技术有限公司;SIRT3抗体购自美国CST公司;辣根过氧化物酶标记二抗购自美国GE公司;Transwell小室购自美国BD公司。
1.3方法
1.3.1细胞培养 人肝癌细胞株Huh-7培养于10%高糖DMEM培养基中(含10%胎牛血清),于37 ℃、5% CO2细胞培养箱中培养,待细胞长满培养皿的80%后进行传代,接种于6孔板中,每孔约8×104个细胞;于5%CO2、37 ℃恒温培养箱中培养24 h,用对照pc-DNA3.1质粒转染Huh-7细胞(对照组),用SIRT3质粒转染Huh-7细胞(实验组),24 h后换液,转染72 h后两组均进行RT-qPCR和Western blot检测。
1.3.2RT-qPCR检测SIRT3 mRNA表达水平 提取细胞总RNA,以随机引物进行反转录合成cDNA,于-20 ℃下保存。取1.0 μL cDNA,SIRT3上、下游引物各0.2 μL及 5.0 μL SYBR Green PCR反应混合液,并补充去RNA酶水3.6 μL构建成10.0 μL反应体系,进行定量PCR扩增。扩增条件:95 ℃ 2 min(预变性)、94 ℃ 20 s(变性)、60 ℃ 20 s(退火)、72 ℃ 20 s(延伸)、72 ℃ 1 s,34个循环。采用RT-qPCR扩增仪进行SIRT3相对定量分析,SIRT3上游引物:5′-ATCGATGGGCTTGAGAGAGT-3′,下游引物:5′-AGGTTCCATGAGCTTCAACC-3′。β-actin 上游引物:5′-AGTTGCGTTACACCCTTTCTTGAC-3′,下游引物:5′-GCTCGCTCCAACCGACTGC-3′ 。以β-actin为内参,采用2-ΔΔCt法计算 SIRT3相对表达水平。实验组和对照组分别取3管细胞标本进行检测,每管重复检测3次,检测结果取平均值。
1.3.3Western blot 检测SIRT3蛋白表达水平 收集实验组和对照组细胞,冰浴、摇床摇30 min充分裂解后离心,分离出待测蛋白。取30 μg待测蛋白标本经8% SDS-PAGE电泳,移至NC膜;5%脱脂奶粉封闭1 h,加入一抗SIRT3抗体(1∶3 000),4 ℃摇床孵育12 h,洗膜3次,每次5 min;加入辣根过氧化物酶标二抗(1∶3 000),室温孵育2 h,洗膜3次,每次5 min;混合发光底物作用1 min,将NC膜覆于保鲜膜下,暗箱中显影曝光。用相同方法检测β-actin作为内参,实验重复3次。
1.3.4细胞划痕实验检测Huh-7细胞的迁移能力 实验组与对照组转染72 h后用10 μL枪头垂直于培养板中线,比着直尺划线,然后用磷酸盐缓冲液(PBS)洗涤细胞3次,加入DMEM培养基,于37 ℃、5% CO2培养箱中培养48 h,通过在显微镜下观察划痕两侧细胞的距离来比较Huh-7细胞迁移情况。
1.3.5细胞侵袭实验检测Huh-7细胞的侵袭能力 实验组与对照组转染24 h后用胰酶消化,上室(包被Matrigel碳酸酯滤膜,滤膜孔径为8 μm)每孔分别加入含Huh-7细胞2×104个的DMEM培养基(无血清)500 μL,下室加入DMEM培养基(含10%胎牛血清)700 μL,孵育条件为5% CO2、37 ℃、10 h。轻轻擦去上室滤膜未侵袭细胞,固定后用0.1%结晶紫染色40 min,清洗后晾干,20倍倒置显微镜下随机选取两组5个不同视野统计细胞侵袭数量,取其平均值,实验重复3次。
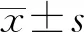
2 结 果
2.1两组SIRT3 mRNA表达水平比较 与对照组相比,实验组SIRT3 mRNA表达水平明显升高,差异有统计学意义(P<0.001),实验组SIRT3质粒在Huh-7细胞中转染成功。见图1。

注:与对照组比较,*P<0.001。图1 RT-qPCR检测SIRT3 mRNA表达水平
2.2两组SIRT3蛋白表达水平比较 与对照组相比,实验组SIRT3蛋白表达水平明显升高,差异有统计学意义(P<0.05)。见图2。

图2 Western blot检测SIRT3蛋白表达水平
2.3细胞划痕实验检测Huh-7细胞的迁移能力 划痕48 h时,对照组两侧边缘的细胞已向中间明显迁移,两侧细胞间距离明显缩短,边缘参差不齐,迁移痕迹较重,而实验组两侧边缘细胞也有缓慢迁移的迹象,但两侧细胞间的距离明显宽于对照组,迁移距离较短。见图3。

图3 细胞划痕实验检测Huh-7细胞的迁移能力
2.4细胞侵袭实验检测Huh-7细胞的侵袭能力 两组细胞接种于上室10 h后收集,显微镜下计数,对照组每个视野为(45±5)个细胞,实验组每个视野为(25±2)个细胞,差异有统计学意义(P<0.05)。见图4。

图4 细胞侵袭实验检测Huh-7细胞的侵袭能力
3 讨 论
SIRT3是一种去乙酰化酶,在肝脏、心脏和褐色脂肪组织等代谢活跃的部位高表达。鉴于目前越来越多的研究将肿瘤定义为代谢性疾病,而线粒体又与代谢密切相关,SIRT3作为线粒体内主要的去乙酰化酶,猜测其必然与肿瘤代谢有着一定联系。SIRT3可以通过调控多种细胞代谢通路影响肿瘤细胞的代谢和生长。SIRT3在一些肿瘤中发挥促进肿瘤生长的作用,如SIRT3可以保护宫颈癌细胞免受基因毒性和氧化应激介导的细胞坏死,还可以通过去乙酰化Ku70,增加Ku70与Bcl-2相关X蛋白(BAX)的结合,防止BAX在线粒体易位和应激条件下引起细胞凋亡[7];SIRT3还可使丝氨酸羟甲基转移酶2脱乙酰化,从而促进结直肠癌的发生[8]。SIRT3在其他一些肿瘤中则发挥抑制肿瘤生长的作用,如SIRT3在骨肉瘤中通过调节活性氧和缺氧诱导因子-1α发挥抑癌基因的作用[9];此外,其还可以通过微小RNA-708-5p抑制胰腺癌的进展[10]。本课题组在前期研究中发现,SIRT3在肝癌中表达水平明显降低,其对肝癌细胞的增殖起抑制作用,并且可以通过糖原合成酶激酶-3β/BAX途径诱导肝癌细胞凋亡[11]。此外,本课题组还发现,SIRT3通过调节P53途径来诱导肝癌细胞老化[12]。
迁移和侵袭是恶性肿瘤的重要生物学特征。sirtuin蛋白家族中的一些成员也陆续被发现有影响肿瘤迁移和侵袭的能力,比如SIRT5通过调节乙酰辅酶A乙酰转移酶1促进前列腺癌细胞的增殖、侵袭和迁移[13];SIRT6通过细胞外调节蛋白激酶(ERK)1/2-基质金属蛋白酶9(MMP9)途径促进骨肉瘤细胞的迁移和侵袭[14];SIRT7通过激活ERK/信号传导与转录激活因子3信号通路促进神经胶质瘤细胞的增殖和侵袭[15],其还可以通过抑制E-钙黏蛋白促进结直肠癌细胞的增殖和侵袭[16]。SIRT3与肿瘤侵袭、迁移的关系也有较多报道,如其通过调节脂肪酸合酶促进宫颈癌细胞的侵袭和转移[17];通过缺氧诱导因子-1α/磷酸肌醇依赖性蛋白激酶1/丙酮酸脱羟酶E1α亚蛋白抑制胆管癌的发生[18]。因此,sirtuin蛋白家族成员在不同的肿瘤组织中有不同的功能,而且同一成员在不同肿瘤中的功能也有明显差异,说明sirtuin家族成员的功能具有细胞和肿瘤特异性。
本研究初步探讨了SIRT3对肝癌细胞迁移和侵袭能力的影响。与对照组相比,实验组SIRT3 mRNA、蛋白的表达水平明显升高,提示SIRT3过表达的肝癌细胞模型构建成功,进一步通过细胞划痕实验和细胞侵袭实验分析过表达SIRT3对肝癌细胞迁移和侵袭能力的影响。细胞划痕实验结果显示,48 h时实验组两侧细胞间的距离明显宽于对照组,说明SRIT3过表达抑制了肝癌细胞的迁移能力。细胞侵袭实验结果显示,实验组穿膜细胞数明显少于对照组,表明高表达SIRT3的肝癌细胞侵袭能力受到抑制,但目前关于高表达SIRT3抑制肝癌细胞迁移、侵袭能力的具体分子机制尚不明确,这也将成为本课题组接下来的研究方向。
综上所述,SIRT3与肝癌的发生、发展密切相关,SIRT3的高表达可以抑制肝癌细胞的迁移与侵袭,其有望为肝癌个体化治疗和抗肿瘤药物的开发提供新的方向。
