苦杏仁醇溶蛋白酶解抗氧化肽的制备工艺优化
2021-06-30徐杨林严宏孟高蕾伊力夏提艾热提靳红周建中
徐杨林,严宏孟,高蕾,伊力夏提·艾热提,靳红,周建中
(新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830000)
杏原产于我国,有文献记载的栽培时间就有4000多年之久[1],主要集中在我国的北方各地,以新疆、吉林、辽宁、山东、陕西地区最多[2]。仁用杏根据口味差别又可分为甜杏仁和苦杏仁两种[3]。苦杏仁富含油脂,虽然无异味,但是味较苦[4],我国苦杏仁产量丰富,但是未充分发挥苦杏仁加工增值率优势[5]。据统计[6],绝大多数苦杏仁没有得到高效的利用,将苦杏仁进行加工、提取的方式,提高苦杏仁资源的利用价值[7]。
多肽具有大分子蛋白质和游离氨基酸所不具备的生物学功能[8],具有抗氧化活性,且更容易被人体吸收[9]。抗氧化肽是蛋白质被水解释放后,表现出抑制、延缓脂质氧化等抗氧化活性的物质[10]。石宁蕙[11]等人对甜杏仁粕蛋白酶解动力学特性进行了研究,揭示了水解度与生物活性的关系。刘媛[12]等以杏仁粕为原料,研究了不同蛋白酶种类,加酶量,时间,温度等因素对水解度和DPPH自由基清除率的影响。代晨曦[13]等人采用响应面法优化双酶酶解杏仁蛋白工艺条件。目前主要以碱法和酶法两种方式提取多肽,但是碱法提取会多肽理化性质改变[14],酶法提取则具有反应条件温和,对环境友好[15]。
本文通过研究苦杏仁醇溶蛋白酶解抗氧化肽的制备工艺,拓展苦杏仁在食品中的利用途径,根据文献可知[16],醇溶蛋白酶解产物普遍具有较高的抗氧化性;为避免蛋白质资源浪费,效果较差,对醇溶蛋白酶解工艺进行研究以提高苦杏仁蛋白精准利用,增加蛋白质的利用率,同时为苦杏仁蛋白在食品中的利用途径进行了探索,为苦杏仁蛋白在食品中的应用提供了参考。
1 材料及方法
1.1 原料与试剂
1.1.1 原料
苦杏仁蛋白(蛋白质质量分数93%),实验室自制;木瓜蛋白酶(≥20000 U/g),生物酶制剂有限公司;碱性蛋白酶(≥20000 U/g),生物酶制剂有限公司;风味蛋白酶(≥20000 U/g),生物酶制剂有限公司;透析袋(截留分子量300),索莱宝科技有限公司;氢氧化钠、盐酸、甲醛、1,1-二苯基-2-三硝基苯肼(DPPH)、铁氰化钾、三氯乙酸、三氯化铁、无水乙醇、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐、过硫酸钾等试剂均为国产分析纯。
1.1.2 仪器设备
UV-2000型紫外可见分光光度计,尤尼柯仪器有限公司;B-1A磁力搅拌器,山东高密彩虹分析仪器有限公司;仪表恒温水浴锅,上海树立仪器仪表有限公司;FA220B分析天平,上海精科天美科学仪器有限公司;pHS-3C pH测定仪,上海理达仪器厂;LCJ-10D冷冻干燥机,北京四环科学仪器厂有限公司;低速台式离心机,上海安亭科学仪器厂;涡旋振荡器,江苏金仪仪器有限公司。
1.2 实验方法
1.2.1 苦杏仁醇溶蛋白的制备
参考Osborne方法[17],对蛋白质进行分级,制备醇溶蛋白。
1.2.2 单因素试验
醇溶蛋白用蒸馏水进行溶解,配置成4%(W/V)的蛋白溶液,调节酶最适的温度,预热10 min,使用0.5 mol/L的氢氧化钠溶液调节至反应pH,在最适条件下进行酶解。酶解条件如表1所示,酶解过程中每30 min调节一次pH,酶解结束后迅速放入恒温95 ℃的水浴锅中,灭酶15 min,终止反应[18]。

表1 五种蛋白酶的最适酶解条件Table 1 Optimal enzymolysis conditions for five proteases
1.2.3 苦杏仁醇溶蛋白酶解条件优化
选择抗氧化活性最优的一组蛋白酶进行优化,主要优化条件如下:酶添加量(3000、4000、5000、6000、7000 U/g),酶解pH(6、7、8、9、10),底物浓度(1%、2%、3%、4%、5%)和酶解时间(1、2、3、4、5 h),分析以上四个因素对抗氧化活性的影响。
1.2.4 响应面优化实验
采用Design-Expert 8.0.6软件进行响应面分析,以水解度(DH%)、DPPH自由基清除率两个指标为响应值,对显著性影响因素进行优化,筛选出最优的苦杏仁醇溶蛋白酶解工艺,依据Box-Behnken试验设计原理,对酶添加量、pH、底物浓度、酶解时间四个因素进行单因素试验。以单因素试验为基础,确定出响应面的因素和水平。
1.2.5 水解度(DH%)测定
采用甲醛电位滴定法[19]测定蛋白质水解度。取20 mL灭酶酶解液,根据酶解液pH使用0.05 mol/L的氢氧化钠溶液滴定至pH 8.2,加入甲醛20 mL,用0.05 mol/L的氢氧化钠溶液滴定至pH 9.2,记录所消耗的氢氧化钠的体积(V1),以蒸馏水作为空白试验,计算多肽液中氨基氮的含量。氨基氮计算公式如下:

式中:V1:样品稀释液加入甲醛后消耗NaOH标准溶液体积,mL;V2:空白试白试验加入甲醛消耗NaOH标准溶液体积,mL;V3:样品稀释取用量,mL;0.014:1 mL浓度的1.0 mol/L NaOH标准溶液相当于氮的含量;m:称取样品的质量,g。
水解度计算公式如下:

1.2.6 DPPH自由基清除率的测定
将酶解液取0.5 mL加入试管中,再加入3.5 mL 0.5 mmol/L DPPH乙醇溶液,混匀后在37 ℃水浴并避光的条件下反应30 min,于517 nm处测定吸光值(OD),以乙醇溶液作为空白对照,平行测定3次取平均值。自由基清除率公式如下:
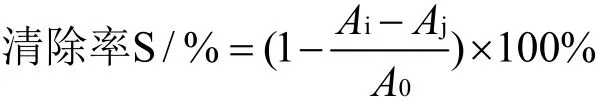
式中:Ai:样品DPPH试剂混合液的吸光值;Aj:样品与乙醇试剂混液的吸光值;A0:DPPH试剂与乙醇试剂混合液的吸光值。
1.2.7 数据处理
采用Origin Pro 2018软件进行数据制图,采用Design Expert 12进行响应面设计及结果分析,每一组试验对其待测指标测定三次,取平均值。
2 结果分析
2.1 蛋白酶的优选
不同的蛋白酶在酶解的过程中,对最终产物的功能效果影响会产生不同的影响[20],以水解度和DPPH自由基清除率为指标,考察五种蛋白酶对苦杏仁醇溶蛋白的酶解效果,由图1可知,在各种蛋白酶最优条件下,碱性蛋白酶DPPH自由基清除率在95%以上,DH则在13%~14%之间,风味、中性、木瓜和胃蛋白酶DPPH自由基清除率在12%~80%之间,DH在5%~12%之间,因此选择碱性蛋白酶作为后续酶解的工具酶。

图1 不同蛋白酶对苦杏仁醇溶蛋白的酶解效果Fig.1 The enzymatic effect of different proteases on the prolamin
2.2 酶解工艺及抗氧化能力单因素试验
2.2.1 酶添加量对水解度和抗氧化能力的影响
由图2可知,随着酶添加量增加,酶的水解作用逐渐增强,酶解液的DH%也逐渐升高,DPPH自由基清除率与DH%存在正相关关系。当加酶量在3000 U/g~5000 U/g时,酶解液的DH%与自由基清除率随着加酶量的增加而迅速升高,当酶添加量达到5000 U/g时,DH%与自由基清除率达到最高,若酶添加量继续增加,则出现了轻微的酶抑制作用,导致DH%出现下降的趋势。根据酶动力学原理,酶的用量过少不利于水解,过多不仅水解效果差[21],还会造成一定程度上的资源浪费。综合考虑酶的作用效果与经济成本,故选取酶添加量在5000 U/g左右。
2.2.2 底物浓度对水解度和抗氧化能力的影响
由图3可知,随着底物浓度的增加,酶解液的DH%和DPPH自由基清除率不断升高,底物浓度达到3%时,继续增加底物浓度,DH%的增加逐渐减弱,而自由基清除率在底物浓度为3%时达到最高点,继续增加底物浓度,由于底物浓度过大,导致酶水解产生抑制,无法高效的进行水解作用,自由基清除率出现下降趋势。由此可以看出,底物浓度在3%较为合适,故选取底物浓度为3%左右。
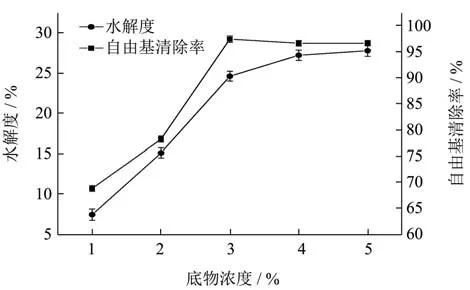
图3 底物浓度对苦杏仁醇溶蛋白酶解的影响Fig.3 The effect of substrate concentration on the proteolysis of amygdalin
2.2.3 pH对水解度和抗氧化能力的影响
根据图4可知,pH在6~10的范围内,酶解液的DH%和DPPH自由基清除率呈现先增加后下降的趋势,当pH达到9时,DH%与自由基清除率达到最高,当pH达到10时,DH%与自由基清除率出现下降的趋势,由此可以看出,当蛋白质水解得到过程中,过酸过碱的环境都会破坏蛋白酶的空间结构[22],导致水解能力下降,因碱性蛋白酶在碱性环境中的效果较好,但不宜过碱,故选取水解pH在9左右。
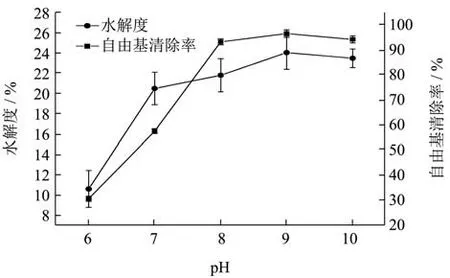
图4 pH对苦杏仁醇溶蛋白酶解的影响Fig.4 The effect of pH on the proteolysis of amygdala
2.2.4 温度对水解度和抗氧化能力的影响
由图5可知,温度在40 ℃~55 ℃范围内,随着温度的升高,DH%与自由清除率也随之增大,且温度在55 ℃时达到最高,当温度超过55 ℃时,酶解液的DH%和自由基清除率出现明显的下降趋势,这是由于当温度达到一定程度会导致蛋白酶分子结构的次级键解离,导致蛋白酶变性[23],从而使酶活性降低,导致水解作用减弱,结合试验结果,决定蛋白酶酶解最佳水解温度为55 ℃。
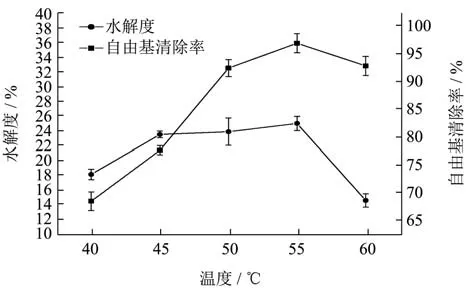
图5 酶解温度对苦杏仁醇溶蛋白酶解的影响Fig.5 The effect of enzymolysis temperature on the proteolysis of Amygdalus
2.2.5 时间对水解度和抗氧化能力的影响
由图6可知,水解时间为1 h~3 h时,酶解液的DH%和自由基清除率随着时间的增加而升高,并在3 h后逐渐趋于平稳,在水解时间为3 h时,酶解液的DH%与自由基清除率达到最高值,这是由于水解产物与底物之间形成了抑制现象所引起[24],以致DH%与自由基清除率无增加趋势,综合考虑DH%、自由基清除率与水解时间成本,故选取水解时间在3 h左右。
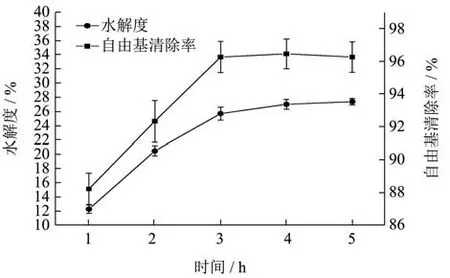
图6 酶解时间对苦杏仁醇溶蛋白酶解的影响Fig.6 The effect of enzymolysis time on the proteolysis of amygdala
2.3 响应面优化试验设计及结果
响应面优化试验设计及结果见表2,利用Design Expert 8.0.6软件对表2试验数据进行方差分析,结果见表3,表4。

表2 响应面设计试验因素水平及编码表Table 2 Response surface design test factor level and coding table
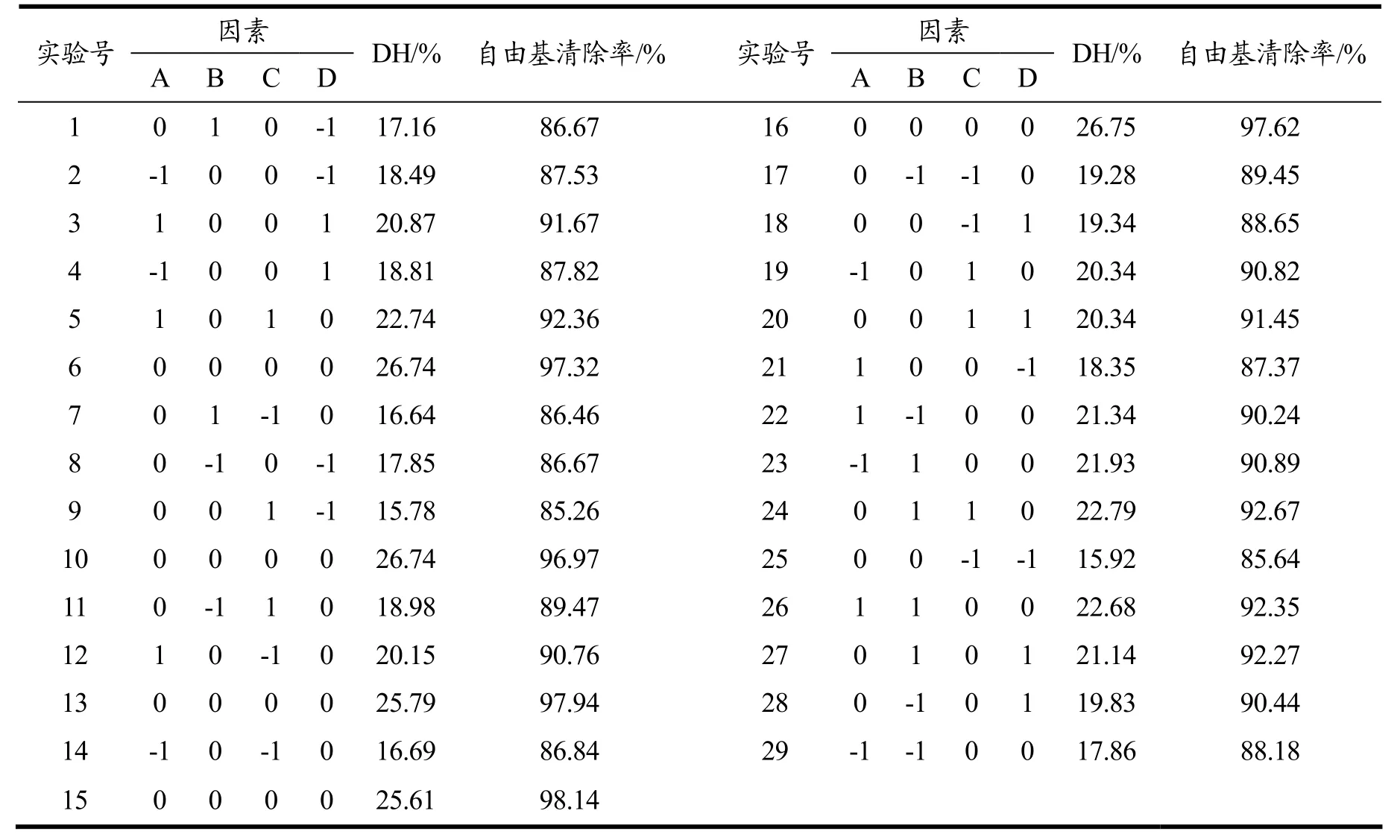
表2 响应面试验设计及结果Table 2 Response surface test design and results

表3 响应面试验结果方差分析(水解度)Table 3 Analysis of variance of response surface test results (degree of hydrolysis)
利用Design Expert对表1 DH%与自由基清除率进行非线性拟合,方程如下。
水解度二次多项回归模型方程:

DPPH自由基清除率二次多项回归模型方程:

由Design Expert软件进行回归及方差分析,见表3、表4。对数学模型进行方差分析,结果表明模型的总回归也极显著(p<0.01),决定系数R2分别为0.9515、0.9724,说明该模型在试验范围内拟合度较高,对数学模型进行失拟检验,显示失拟性不显著(p>0.05),说明该模型在试验范围内拟合度也是比较高。对该数学模型的回归系数检验可知:水解度结果方差分析中,pH与底物浓度对试验的影响极显著(p<0.01)。通过F值的大小判断可得各个因素对苦杏仁醇溶蛋白水解度影响力为XC>XD>XB>XA,即pH>底物浓度>酶添加量>时间。DPPH自由基清除率结果方差分析中,pH与底物浓度对试验的影响极显著(p<0.01),时间与酶添加量对试验的影响显著(p<0.05),通过F值的大小判断可知各因素影响力XD>XC>XA>XB,即底物浓度>pH>时间>酶添加量。
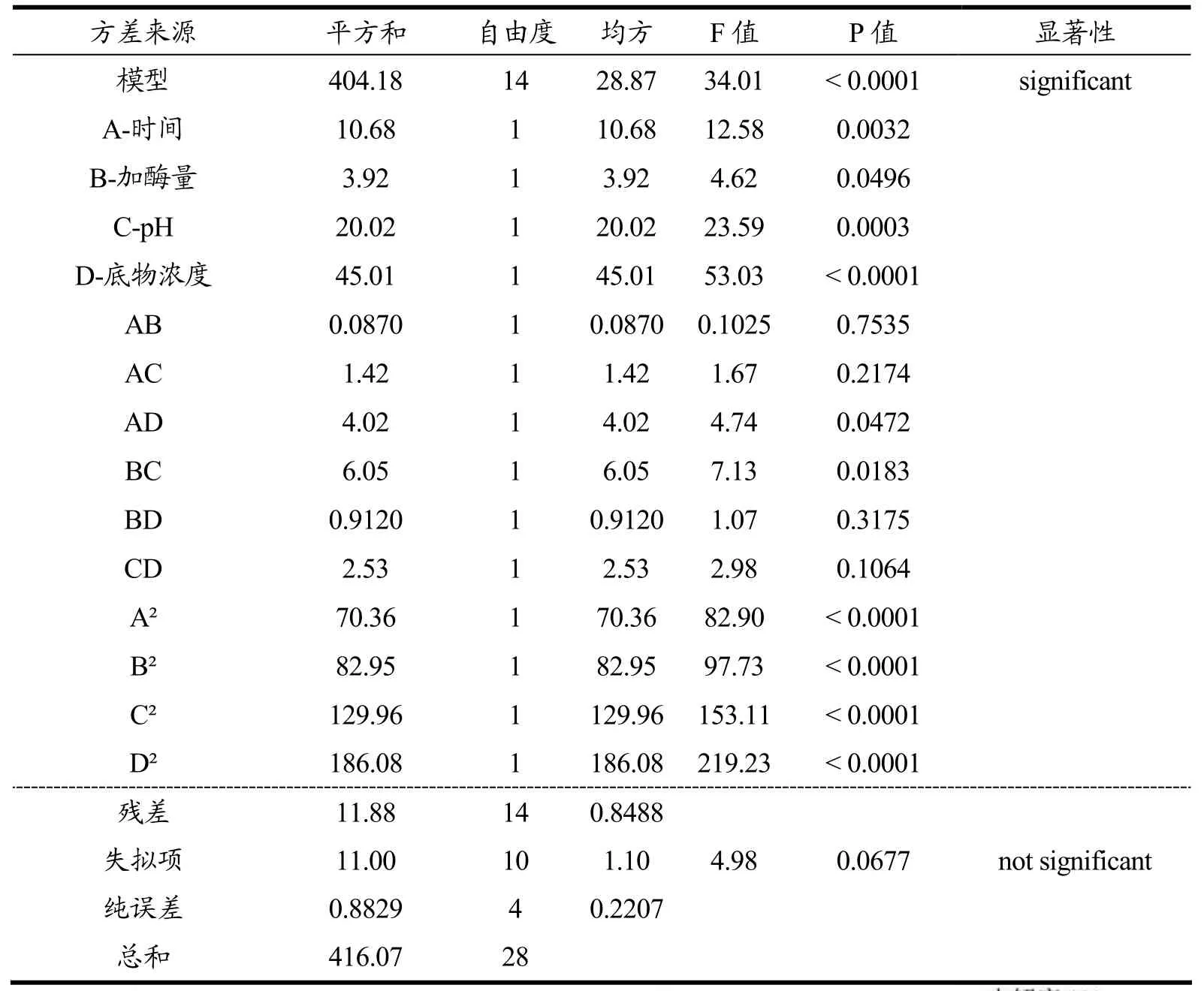
表4 响应面试验结果方差分析(DPPH自由基清除率)Table 4 Analysis of variance of response surface test results (DPPH free radical scavenging rate)
2.3.1 水解度的因素交互效应分析
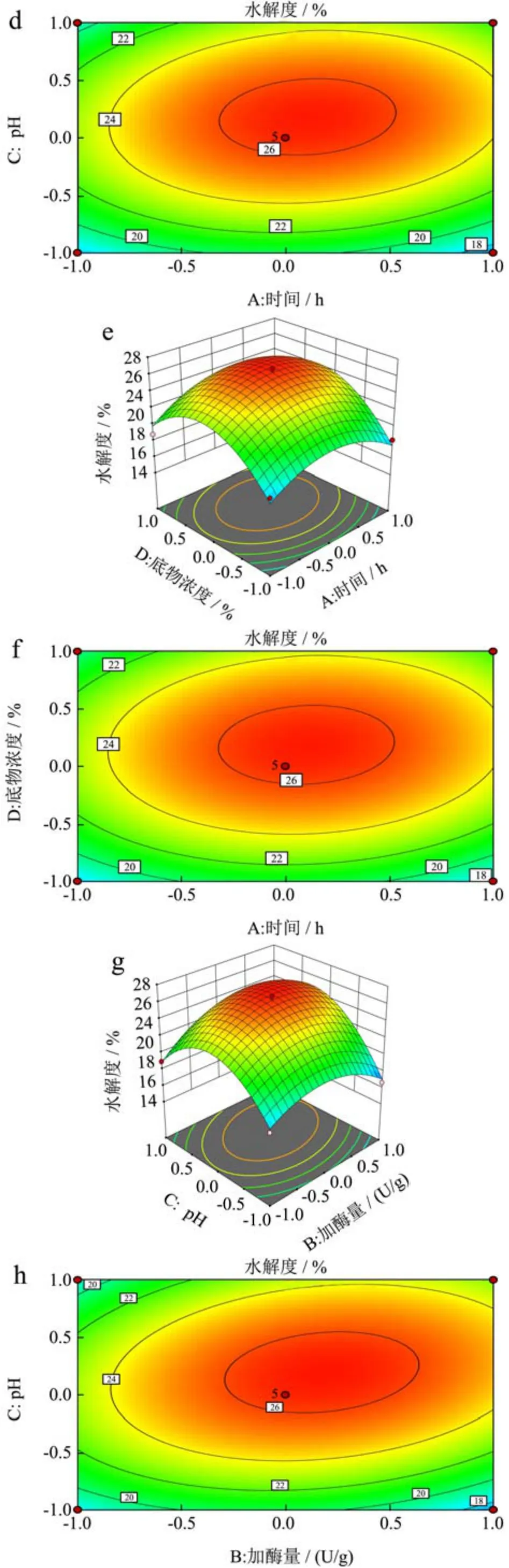
从图7可看出,三维图总体趋势为向上凸起,说明该数学模型具有最大值。利用Design Expert软件对试验数据进一步分析,并对拟合的回归方程进行计算,理论水解度最大为26.75%,实际测得的结果为26.74%±0.54%,软件在该点的估计值为26.75%与预测值相比,误差仅为0.1%接近预测值,表明在该试验模型下得到的最佳工艺条件具有较高的可靠性,可以用于预测苦杏仁醇溶蛋白酶解最终的水解度。
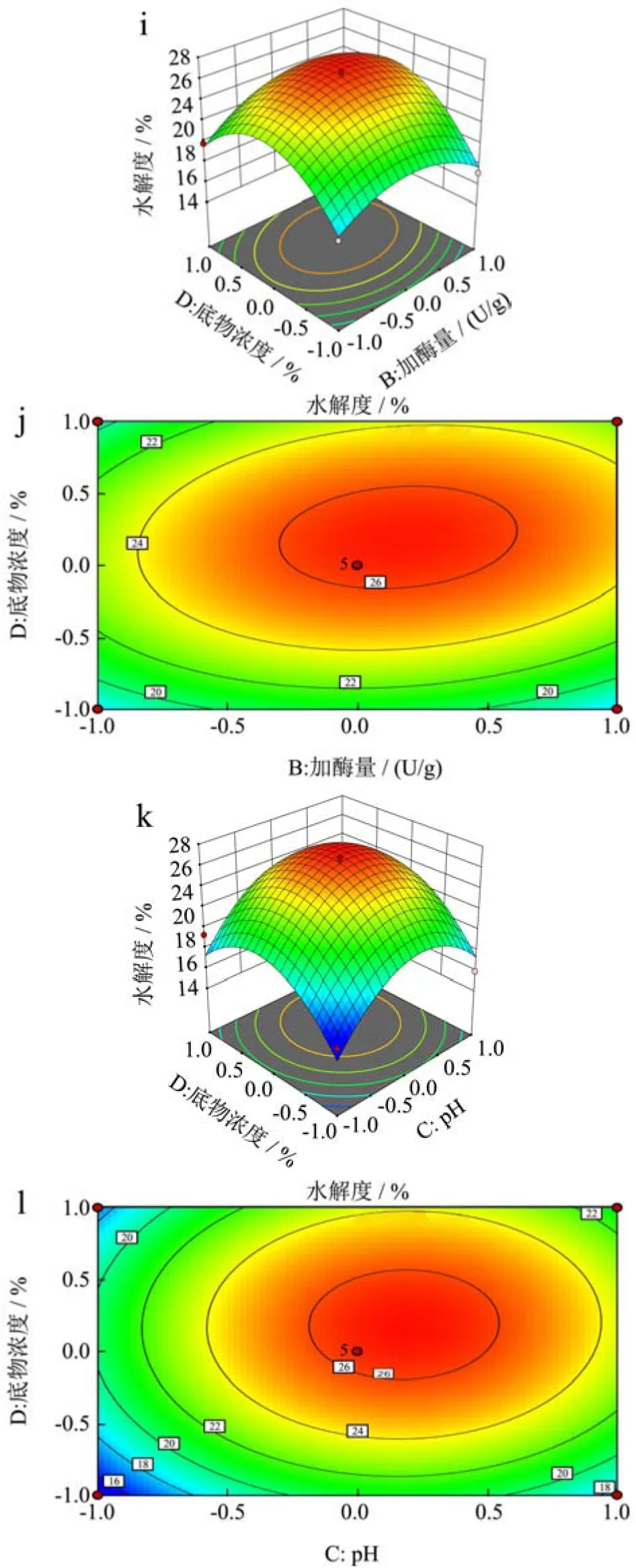
图7 各因素交互作用对苦杏仁醇溶蛋白水解度影响的响应面图Fig.7 Response surface diagram of the effect of each factors interaction on the degree of hydrolysis of amygdalin


2.3.2 自由基清除率的因素交互效应分析

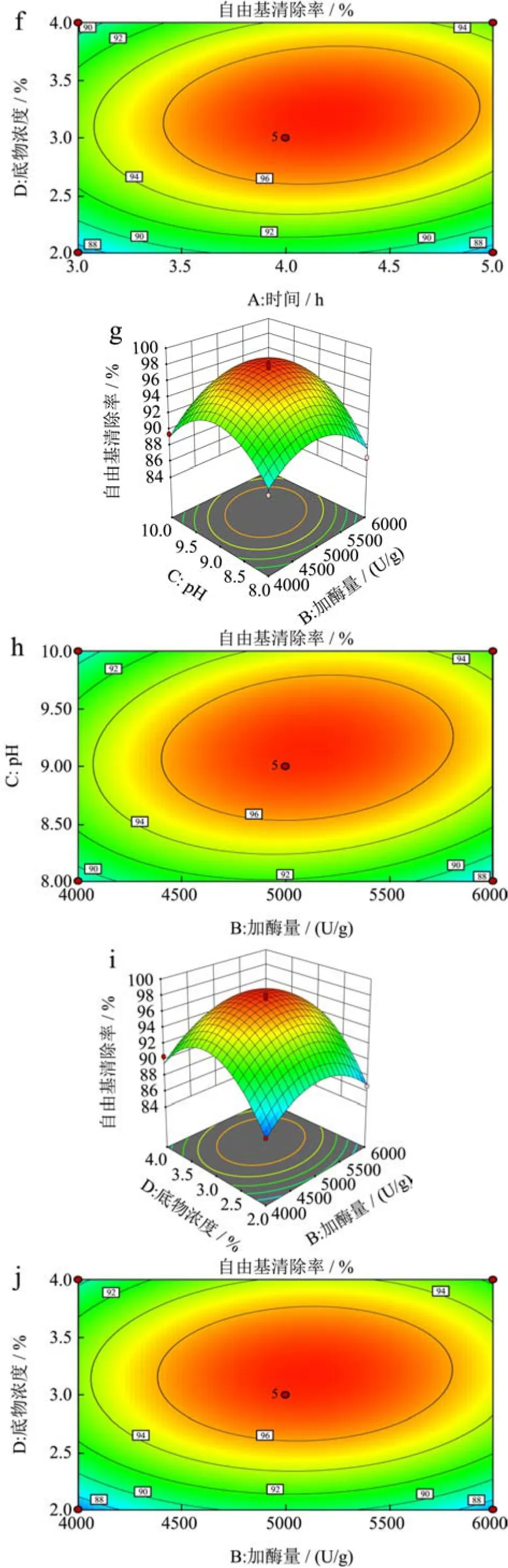
根据图8中6组响应面及等高线的形状来分析酶添加量、酶解pH、酶解温度和酶解时间四个主要因素间的交互作用对苦杏仁多肽DPPH自由基清除率的影响,结果发现自由基清除率响应值呈现先升高后下降的趋势,酶添加量与pH(BC)、酶解时间与底物浓度(AD)交互作用与其他几组相比更强。
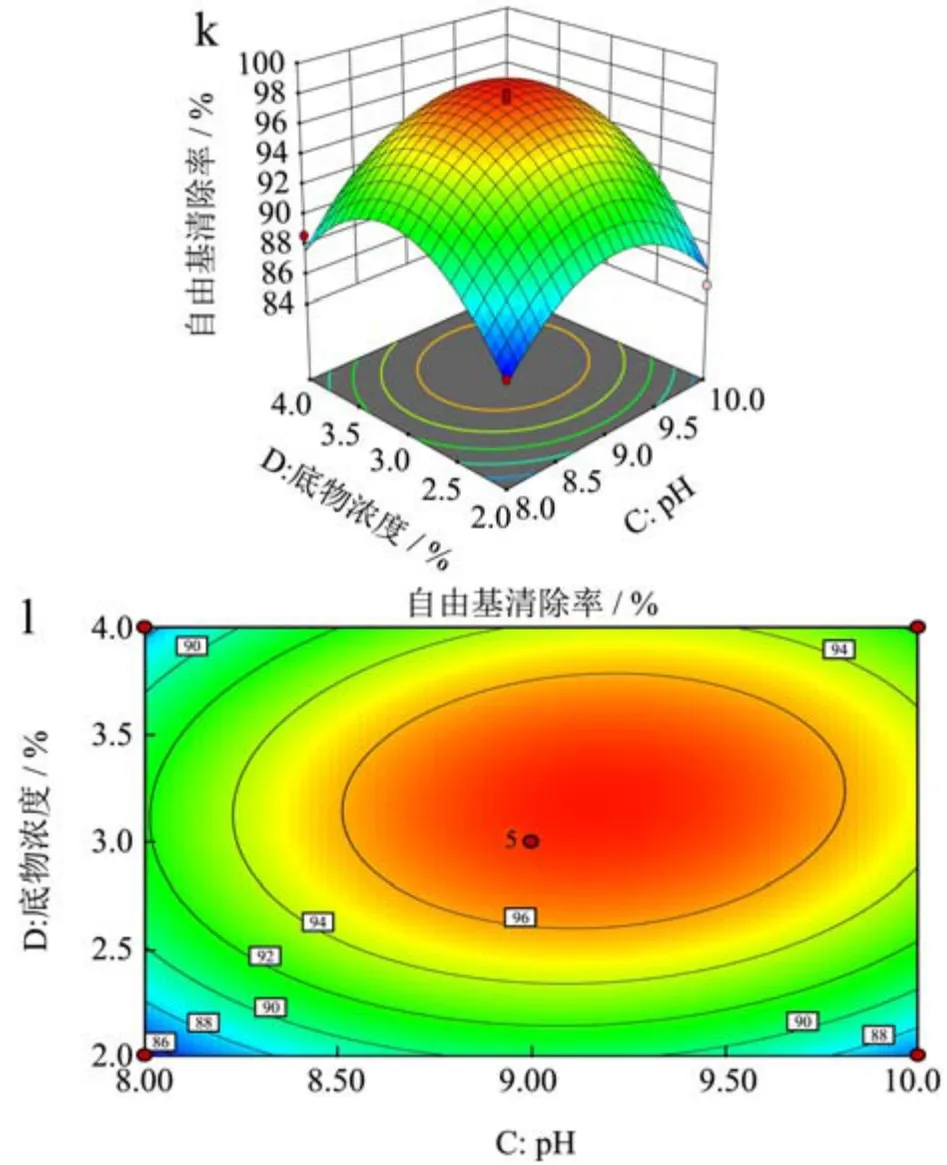
图8 各因素交互作用对苦杏仁醇溶蛋白DPPH自由基清除率的影响Fig.8 The effect of the interaction of each factors interaction on the scavenging rate of DPPH free radical of amygdalin
根据图8可知,三维图总体趋势为向上凸起,说明该数学模型具有最大值。预测苦杏仁醇溶蛋白酶解多肽的最佳工艺条件当预测最优工艺条件为时间:4.121 h、酶添加量5208.930 U/g、底物浓度3.21%、pH 9.22,理论自由基清除率最大为98.02%,由于实验条件限制,将该条件修订为酶添加量为5000 U/g,pH为9,底物浓度为3%,酶解时间为4 h时,对该条件进行验证试验,实际测得的结果为97.86%±0.58%,软件在该点的估计值为98.02%与实测值相比,误差仅为0.16%,接近预测值,可以用于预测苦杏仁醇溶蛋白酶解的工艺条件。
根据文献可知,刘媛[12]等人通过响应面法优化了杏仁粕酶解工艺,研究其酶解液的抗氧化活性,其最终水解度与DPPH自由基清除率分别为29.36%和86.16%,与本文的研究相比较,水解度优化程度相差2.61%,但是本文的DPPH自由基清除率优化程度明显优于对方,高出11.7%。
3 结论
本研究通过响应面实验设计优化了苦杏仁醇溶蛋白抗氧化肽的制备工艺。通过响应面分析可知,酶解时间、pH、底物浓度,酶添加量都对水解度和自由基清除率存在影响,最终通过软件得到优化酶解条件为时间4 h,酶添加量5000 U/g,底物浓度3%,pH 9,此时苦杏仁醇溶蛋白的水解度与DPPH自由基清除率均为最高,通过验证试验实际测得水解度与DPPH自由基清除率分别26.74%±0.54%与97.86%±0.58%,与预测值相差较小,证明此响应面可以准确地预测苦杏仁醇溶蛋白酶解抗氧化肽最优工艺。本研究结果可以为苦杏仁在食品工业上的实际运用提供参考。
