特异性识别K1荚膜大肠杆菌的噬菌体PNJ1809-36生物学特性及全基因组分析
2021-06-30巩倩雯李一昊于沛欣钱新杰王瑜欣戴建君
巩倩雯,李一昊,曾 颃,于沛欣,钱新杰,王瑜欣,戴建君,汤 芳
(南京农业大学动物医学院 教育部动物健康与食品安全国际联合实验室 农业农村部细菌学重点实验室, 南京 210095)
大肠杆菌(Escherichiacoli)为埃希菌属(Escherichia)代表菌,它包括动物或人共生菌株和致病性菌株,致病性菌株又分为肠道致病菌株和肠道外致病菌株[1]。肠道致病性菌株有产肠毒素大肠杆菌、产志贺毒素大肠杆菌等,可以引起人和动物的肠炎和腹泻[2],某些血清型甚至会导致死亡[3]。肠道外致病性菌株能引起人或动物的肠道外感染,如引起人或动物的尿路感染[4],新生儿脑膜炎及败血症以及禽的呼吸系统疾病从而导致禽的急性死亡。致病性大肠杆菌给人和动物健康造成危害,也给农业生产带来了巨大的损失。
大肠杆菌有4种表面抗原:O、K、H和F抗原,分别为脂多糖抗原、荚膜多糖抗原、鞭毛抗原和菌毛抗原。4种表面抗原是对大肠杆菌进行分型的基础,也是重要的毒力因子。K抗原是大肠杆菌重要的毒力因子之一[5],可能存在于荚膜、被膜或菌毛中。目前已发现的K抗原有80多种,其中K1荚膜抗原备受关注。引起新生儿细菌性脑膜炎的肠道外致病性大肠杆菌大多有K1荚膜,它能够穿过血脑屏障致病,而K1荚膜则是主要致病因子[6]。具有K1荚膜的大肠杆菌能够抵抗补体杀菌作用,增强其在脑微血管内皮细胞中的存活,从而减弱巨噬细胞对细菌的吞噬能力[7-8]。Mellata等[9]构建了K1基因缺失株,发现缺失株的增殖能力大大降低。目前,针对细菌性脑膜炎已经有治疗方案,但经治疗后也会伴有神经后遗症及发育异常[10]。尽管使用了先进的抗生素,但与大肠杆菌K1引起的脑膜炎相关的疾病发病率和死亡率在过去几十年中并没有下降[11-12]。另外,由于近年来耐药性大肠杆菌K1菌株的数量激增,死亡率可能会进一步增加[13]。
近年来,噬菌体治疗被认为是能够缓解细菌多重耐药的有效方案之一。噬菌体具有分布广泛、种类多样、宿主特异性强等特点,可作为治疗细菌感染的新型生物制剂。目前已经发现多种具有多糖专一性的噬菌体,可以特异性降解细菌胞外多糖,从而使细菌毒力下降。K1专一性噬菌体可以特异性降解K1荚膜的多聚唾液酸,从而使细菌毒力减弱[14]。同时,这些噬菌体可用于大肠杆菌的分型[15]。本研究分离得到可裂解K1荚膜大肠杆菌的噬菌体PNJ1809-36,并对其进行生物学特性和全基因组分析,期望为临床疾病治疗和细菌防控提供参考。
1 材料与方法
1.1 材料
1.1.1 细菌及样品 大肠杆菌DE058及其他用于宿主谱检测的大肠杆菌(表1)均为本实验室保存。用于分离噬菌体的样品为采集自青龙山养殖场的鸡粪。
1.1.2 实验仪器及试剂 参照《分子克隆实验指南》第3版[16]配制LB液体培养基、LB固体培养基、半固体培养基以及SM缓冲液。LB培养基所用试剂购自北京索莱宝科技有限公司;NaCl、MgSO4·7H2O购自市科密欧化学试剂有限公司;酶标仪为TECAN NanoQuant PlateTM;电子透射显微镜为日立H7650。
1.2 方法
1.2.1 噬菌体分离和纯化 参考Jamalludeen等[17]的方法对采集的鸡粪样品进行噬菌体分离与纯化:用棉签蘸取适量鸡粪,放入含有SM液的EP管中4 ℃浸泡过夜。将该样品5 000g离心10 min,随后将上清用0.45 μm的滤器过滤,所得滤液在涂有大肠杆菌的平板上点样,然后将平板置于37 ℃温箱培养过夜,次日观察平板上是否有空斑。如有空斑出现,则用双层平板法对噬菌体进行纯化:将宿主菌与该滤液各取100 μL混合,37 ℃静置10 min后,将该混合液加入含0.5%琼脂的LB半固体培养基中,混合均匀后铺在LB固体平板上,37 ℃培养过夜,次日观察噬菌斑。随后用一次性无菌枪头吸取单个空斑,放入含有SM液的EP管中4 ℃ 浸泡过夜,使其中的噬菌体充分释放。将该SM液与宿主菌各取100 μL混合,再用双层平板法培养噬菌体,重复该过程5次,直至平板上形成清晰、透明、大小一致的噬菌斑。取5 mL SM液加入该平板,4 ℃浸泡过夜,次日收集平板上的SM液,5 000g离心10 min,上清用0.22 μm滤器过滤,所得滤液即为纯化的噬菌体,将其保存在4 ℃条件下备用。
1.2.2 电镜观察 将保存的噬菌体用双层平板法富集并过滤,用2%的磷钨酸(PTA)进行负染,使用透射电子显微镜观察噬菌体的形态。
1.2.3 宿主谱分析 使用双层平板法进行宿主谱分析。取100 μL培养至对数期的108株E.coli待检菌培养液与100 μL噬菌体或PBS混合后铺双层琼脂平板,PBS作为阴性对照。待平板晾干后,将其置于37 ℃ 温箱培养5~6 h,记录结果。
1.2.4 K1荚膜型大肠杆菌的鉴定 对用于宿主谱鉴定的细菌进行K1荚膜的鉴定。以F(上游引物):5′-CATCCAGACGATAAGCATGAGCA-3′,R(下游引物):5′-GCGCATTTGCTGATACTGTTG-3′为鉴定K1荚膜的特异性引物[18],使用PCR方法对宿主谱中的细菌进行K1型荚膜鉴定,扩增产物长度约为270 bp。PCR反应体系包括12.5 μL GreenTaqMix(Vazyme),上、下游引物各1 μL,超纯水 8.5 μL,菌液模板2 μL。PCR扩增条件为95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸20 s,30个循环;72 ℃终延伸10 min,4 ℃保存。取7 μL PCR产物进行琼脂糖凝胶电泳,鉴定目的条带。
1.2.5 最佳感染复数的检测 参照Carey-Smith等[19]的方法进行噬菌体的感染复数(multiplicity of infection,MOI)的检测。将细菌培养至浓度约为3×108CFU·mL-1,用LB液体培养基稀释10倍。取不同稀释浓度的噬菌体和浓度为3×107CFU·mL-1的宿主菌各200 μL,按照感染复数分别为0.001、0.01、0.1、1、10和100的比例混合,37 ℃,180 r·min-1震荡培养5 h,10 000g离心8 min, 收集上清并用0.22 μm滤器过滤。将滤液进行梯度稀释后,用双层平板法测定噬菌体效价,效价最高的感染复数即为最佳感染复数(optimal multiplicity of infection)。
1.2.6 一步生长曲线测定 参照Ellis等[20]的方法测定噬菌体PNJ1809-36的一步生长曲线。取噬菌体和细菌各1 mL按照最佳MOI混合,37 ℃静置10 min,然后10 000g离心10 min,并用2 mL LB液体培养基洗涤沉淀2次,以去除没有吸附在细菌上的噬菌体,随后用预热好的5 mL LB液体培养基重悬沉淀,迅速置于37 ℃摇床震荡培养。将置于37 ℃摇床震荡开始的时间记为T0,每隔5 min或10 min取样1次,分别在T0、T5、T10、T15、T20、T30、T40、T50、T60、T70、T80、T90、T100、T110、T120各取混合液100 μL,用双层平板法测定噬菌体效价。试验重复3次。试验结果以时间为横坐标,噬菌体的滴度为纵坐标,绘制一步生长曲线。
1.2.7 温度及酸碱敏感性测定 参照文献[21]描述的方法进行噬菌体温度及酸碱敏感性测定。向每个1.5 mL EP管中加入1 mL噬菌体后,将其分别置于40、50、60、70、80 ℃的金属浴中进行孵育。在30和60 min各取出100 μL噬菌体,稀释后用双层平板法检测效价。每组重复3次。用HCl和NaOH调节SM液的pH至3~12,分别取900 μL不同pH的SM液加入1.5 mL EP管中,再向每管中加入100 μL噬菌体,37 ℃培养1 h,用双层平板法检测噬菌体的效价,每组重复3次。
1.2.8 体外裂解曲线测定 取500 μL浓度为3× 108CFU·mL-1的宿主菌用液体LB洗涤3次,用10倍体积的LB重悬。按照最佳MOI将细菌和噬菌体各取100 μL混匀,加入96孔板中,每孔200 μL, 重复5孔。取重悬后的菌液和液体LB各100 μL混匀加入96孔板中,每孔200 μL,重复5孔, 作为菌液对照。将200 μL LB加入96孔板中,重复5孔作为空白对照。将酶标仪参数设置为恒温37 ℃,180 r·min-1震荡,持续15 h,每30 min检测1次OD600nm,用所得数值绘制体外裂解曲线。
1.2.9 全基因组测序及生物信息学分析 使用苯酚-氯仿法[22]提取噬菌体的基因组DNA,用双蒸水溶解后,-20 ℃保存。将噬菌体DNA送至北京化工大学进行全基因组测序,采用Illumina Hiseq测序平台,TruSeqTMDNA Sample Prep Kit构建DNA文库。使用Newbler V3.0软件(Roche 454)和CLC软件(CLC Bio)组装拼接噬菌体的完整基因组序列。基因组序列拼装结果由北京化工大学提供。利用NCBI在线工具BLASTp(http://blast.ncbi.nlm.nih.gov/)对噬菌体基因组开放阅读框(ORF)作功能注释,并利用GC view Sever绘制噬菌体的全基因组图谱。以噬菌体的RNA连接酶和全基因组为基准,使用MEGA-X绘制噬菌体的系统发育树,利用Maximum Likelihood最大似然法进行同源进化分析。
2 结 果
2.1 形态学观察
以K1荚膜大肠杆菌DE058为宿主菌,用双层平板法进行噬菌体分离。经反复纯化后,得到以DE058为宿主菌的噬菌体PNJ1809-36。在双层琼脂上产生的噬菌斑大小均一,边缘整齐,斑清澈透亮(图1A)。经过负染后,进行电镜观察,该噬菌体的头部直径为80 nm,为正多面体;具有可以收缩的尾部,长度大约100 nm,底板上有较多的短尾丝(图1B),表明PNJ1809-36为肌尾科噬菌体。

A. PNJ1809-36形成的噬菌斑形态;B. PNJ1809-36负染后的电镜图(比例尺为20 nm)
2.2 宿主谱分析
对实验室保存的108株大肠杆菌使用双层平板法测定噬菌体PNJ1809-36的裂解谱。其中21株菌可以被裂解(表1),经PCR鉴定这些菌株均为K1荚膜菌株。图2列举了部分PCR鉴定结果,其中泳道1、5、9、19在270 bp处出现条带,鉴定为K1荚膜型大肠杆菌。该试验结果表明,该噬菌体对K1型大肠杆菌具有广谱抗菌活性。
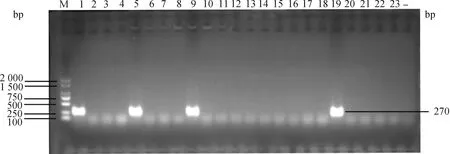
M. DL2000 DNA相对分子质量标准;1~23.检测K1荚膜的基因条带;-.阴性对照
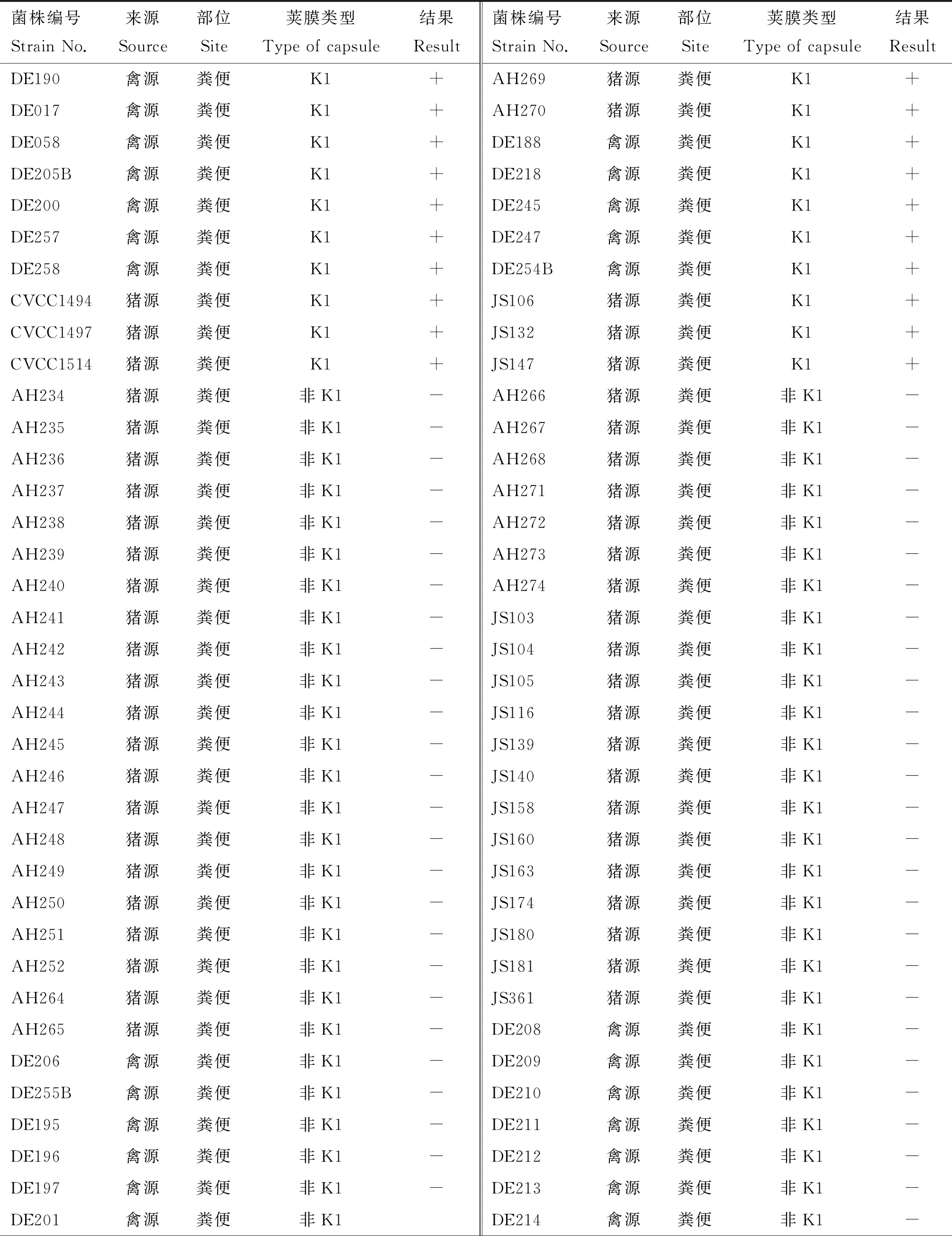
表1 噬菌体PNJ1809-36宿主谱
2.3 一步生长曲线
一步生长曲线测定结果显示(图3 A),前10 min噬菌体效价无明显变化,10~50 min噬菌体的效价急剧升高,然后趋于稳定。即噬菌体PNJ1809-36的潜伏期为10 min,爆发期为40 min。爆发期时噬菌体效价最高可达1.84×108PFU·mL-1。由“爆发量=噬菌体末期数量/初期细菌数量”可知,噬菌体PNJ1809-36的爆发量为122。
2.4 最佳MOI
如图3 B所示,将噬菌体和细菌按照不同的MOI混合后测定噬菌体的滴度,比较在不同的MOI情况下产生噬菌体的数量。在MOI为0.01时,噬菌体的滴度最高,因此PNJ1809-36与DE058宿主菌的最佳MOI为0.01。
2.5 热稳定性及酸碱耐受性
通过对噬菌体PNJ1809-36的热稳定性检测可知(图3 C),在40 ℃时,噬菌体的效价比较稳定;50 ℃ 孵育30 min时,噬菌体存活率为94.34%,孵育60 min时,存活率为67.65%;60 ℃时,噬菌体存活率明显下降,孵育时间为30 min时,存活率仅为0.2%,孵育时间为60 min时,存活率为0;70和80 ℃ 时,孵育30和60 min噬菌体存活率均为0,表明60 ℃以上30 min可使噬菌体几乎完全灭活。

(续表1 Continued)
图3D表示噬菌体PNJ1809-36对于不同酸碱度的耐受情况。在pH为3~11,PNJ1809-36均可存活;pH为6时,噬菌体的活性最高;pH为2或12时, PNJ1809-36完全失活。
2.6 体外裂解曲线
将噬菌体PNJ1809-36和宿主菌以最佳MOI混合培养,持续观察15 h,结果如图3 E所示,在前6 h内,噬菌体PNJ1809-36可完全抑制宿主菌DE058的生长;而未加噬菌体的宿主菌则保持持续增长,大约在12 h后进入平台期;空白对照则未见细菌生长,表明该体系没有被污染。

A.噬菌体PNJ1809-36一步生长曲线;B.最佳 MOI检测;C.温度敏感性检测;D.酸碱度耐受性检测;E.噬菌体体外裂解曲线
2.7 全基因组测序及分析
噬菌体PNJ1809-36基因组为线性的双链DNA,已将该基因组上传至GenBank(Accession number:MT944117)。经分析可知,其基因组长度为152 343 bp;GC含量为39.11%;A、T、G、C含量分别为30.76%、30.13%、19.27%、19.83%。根据基因功能预测,该基因组共有277个开放阅读(ORF),11个tRNA基因。277个ORF中,仅有36个注释了可能存在的功能(表2),包括与噬菌体的结构和包装相关的基因、DNA复制过程中的相关酶、裂解宿主相关基因以及噬菌体的尾部纤维基因,无噬菌体整合酶基因。剩余的87% ORF均为未知功能的蛋白。
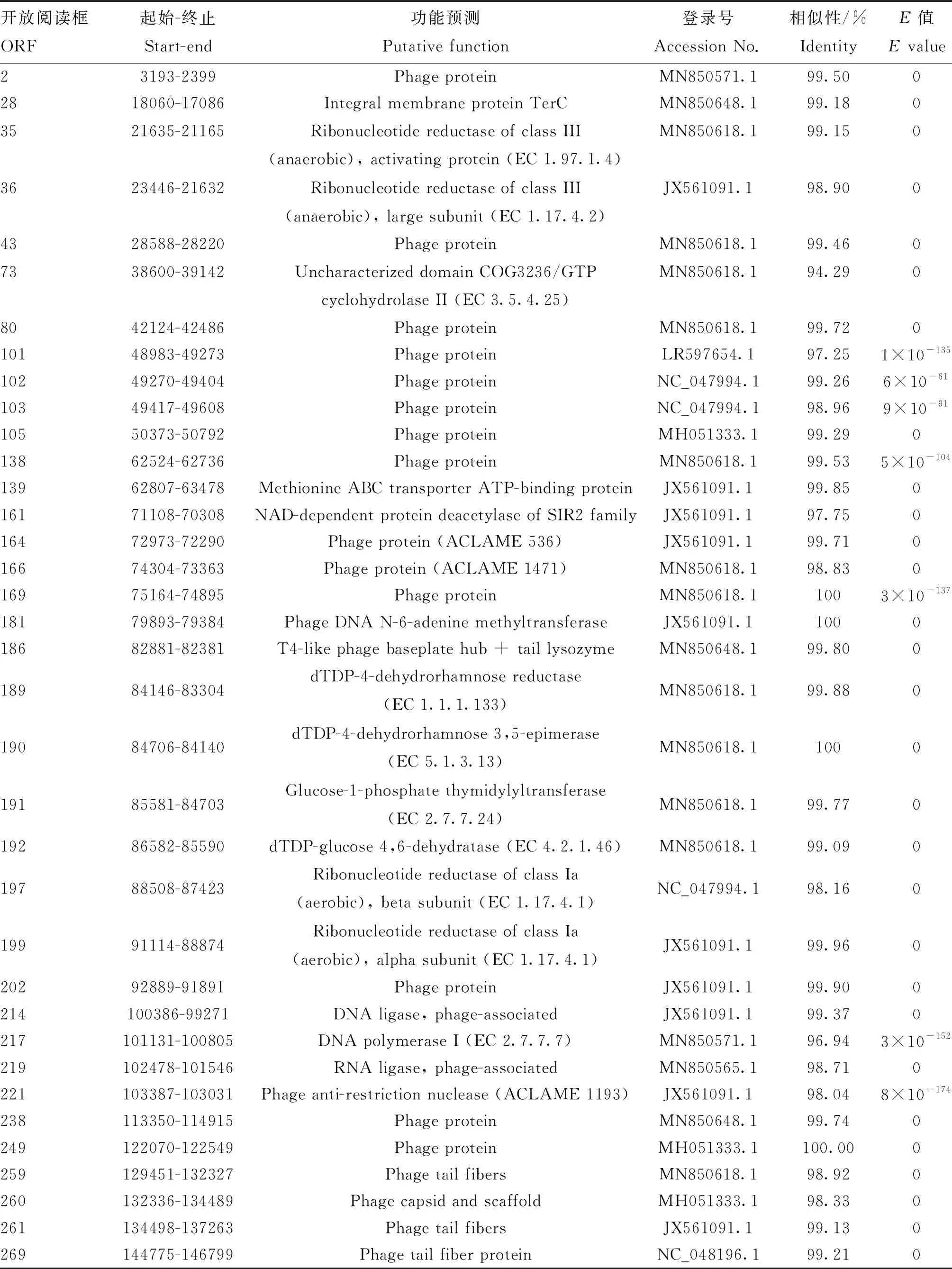
表2 噬菌体PNJ1809-36部分ORFs预测
使用GC view Server[23]绘制了全基因组图谱(图4),并用不同的颜色进行标注。粉色代表假定蛋白,蓝色为噬菌体结构蛋白,黄色标注基因与噬菌体复制和包装有关,红色为尾部纤维蛋白。由于该噬菌体的大多数基因与其他噬菌体的同源性较低,因此存在大量的未知功能的假定蛋白,可见该噬菌体基因异质性较强,有待继续研究和验证。

粉色为假定蛋白;蓝色为噬菌体结构蛋白;黄色为DNA复制和外壳包装有关蛋白;红色为噬菌体尾部蛋白;黑色代表GC含量;绿色和紫色代表正、负平均GC偏差
2.8 系统发育树分析
为了解噬菌体PNJ1809-36与其他噬菌体之间的进化关系,选择相对保守的且具有进化意义的基因进行系统发育树分析,例如头部蛋白、末端酶大亚基[24]、RNA聚合酶[25]、RNA连接酶[26]以及全基因组等。本研究以RNA连接酶为基准,采用MEGA-X软件中的Maximum Likelihood绘制同源进化树(图5)。分析结果显示,噬菌体PNJ1809-36与噬菌体vB EcoM-Ro121c4YLVW(2019年分离)、噬菌体nepoznato(2019年分离)亲缘性较近,这两株噬菌体基因组中均含有与K1荚膜降解相关的蛋白,Korf等[27]建议将这类噬菌体归于肌尾科噬菌体中的新属,并将该新属命名为“Phapecoctavirus”。

分支点上的数字. 可信度,数值越接近100,可信度越强;标尺.代表遗传距离;黑色三角.PNJ1809-36
3 讨 论
随着细菌耐药现象的持续恶化,寻找新的抗生素替代品乃当务之急。而噬菌体作为一种细菌病毒,具有特异性分解某些细菌的能力,在克服耐药领域具备一定的潜力。本研究分离得到的大肠杆菌噬菌体PNJ1809-36是一株肌尾科噬菌体,透射电镜下可以发现其头部大小约为80 nm且呈正多面体,具有可以收缩的尾部,大约100 nm。它可以在双层琼脂上形成大小均一、透亮的噬菌斑。一步生长曲线显示该噬菌体PNJ1809-36的潜伏期为10 min,爆发期持续40 min,裂解量为122,说明其吸附宿主菌所需时间较短,复制子代效率较高。最佳MOI为0.01,表明噬菌体在裂解细菌时所需数量较少,在实际应用中较低的MOI会降低纯化及应用成本。其温度和酸碱耐受性显示,在40 ℃以下活性完全不会被抑制,60 ℃以上被灭活。pH为6的弱酸性条件下活性最好。这提示该噬菌体可能适用于体内细菌感染的治疗。体外裂解曲线显示了在最佳MOI的比例下,噬菌体可以在6 h内持续抑制细菌的生长,给使用该噬菌体进行治疗时的给药时间提供了参考。在噬菌体的基因组分析中没有发现噬菌体整合酶基因,结合其培养特征,可以证明该噬菌体为烈性噬菌体。
PNJ1809-36对20株K1荚膜大肠杆菌均有裂解作用,这提示噬菌体PNJ1809-36可能是一个K1荚膜特异性的噬菌体。具有K1荚膜的大肠杆菌能够引起新生儿脑膜炎,尤其是近几年随着耐药性K1菌株的出现,情况变得严峻。针对K1荚膜菌株的噬菌体能够降解K1荚膜,使细菌毒力下降,在治疗K1菌株引起的疾病上具有潜力。
噬菌体PNJ3809-36与nepoznato亲缘性非常高,提示PNJ1809-36可能和近期发现的噬菌体同属于能够分解K1荚膜且具有可收缩尾部的肌尾科噬菌体。且Lavigne等[28]提到,这些噬菌体应当属于新的肌尾科系统发育分支。荚膜特异性噬菌体是一种特殊的能够降解胞外多糖的噬菌体。根据荚膜类型的不同,对应的噬菌体也进行了分类[15]。研究最多的是针对K1荚膜的噬菌体。K1荚膜是一种单一的多聚唾液酸[29]。在早期发现的针对K1荚膜的噬菌体多为短尾噬菌体:如K1E[30]、K1F[31]等。后来发现了长尾噬菌体63D[32]也能够特异性分解K1荚膜。近十年又发现了与早期发现的这些噬菌体同源性较低的新的降解K1荚膜的噬菌体,如沙门菌噬菌体 PVP-SE1[33](2011年分离)、大肠杆菌噬菌体phAPEC8[34](2010年分离)、ESCO5、ESCO13[35](2017年分离)、nepoznato(2019年分离)等。
噬菌体宿主特异性主要取决于其尾部蛋白与细菌表面受体的结合,宿主菌的外膜蛋白、荚膜、菌毛或鞭毛上都存在特异性的受体,这些受体以蛋白质、多糖或脂多糖形式存在。在本研究中,噬菌体PNJ1809-36的受体为K1荚膜,是一种胞外多糖,其成分为多聚唾液酸[36]。据报道裂解K1荚膜型大肠杆菌的噬菌体存在一种尾部蛋白,即内切唾液酸酶,能够将多聚唾液酸分解成2,8唾液酸单体,从而降解K1荚膜[37]。通过基因比对发现,PNJ1809-36基因组中ORF261与K1荚膜特异性噬菌体的内切唾液酸酶的氨基酸相似性为74%[34],由此可推测ORF261可能具有内切唾液酸酶的功能,后续我们会进一步验证该酶的功能。
4 结 论
噬菌体PNJ1809-36是1株特异性高,裂解能力强的噬菌体。它具有能够针对性裂解K1荚膜大肠杆菌的特性,提示该噬菌体具有防控K1荚膜大肠杆菌感染的潜力。
