酵母过氧化物酶体的形成机制
2021-06-30周靖垚张建国
周靖垚, 张建国
(上海理工大学医疗器械与食品学院 食品科学与工程研究所,上海 200093)
真核细胞的单膜细胞器过氧化物酶体的形成和吞噬是当前的研究热点[1-2]。与内质网、高尔基体、溶酶体等单膜细胞器单独能合成蛋白质不同,过氧化物酶体则需从细胞质中获取基质蛋白和膜蛋白。过氧化物酶体的最大直径为1 μm[3],不仅在多种代谢途径中发挥重要作用,而且其功能和形态会根据外部环境和自身需求的改变而变化[4-6]。过氧化物酶体最具代表性的功能为脂肪酸β-氧化和过氧化氢的酶解[5]。过氧化物酶体的必需基因pex编码的过氧化物酶蛋白(Peroxins,不包括转录调节因子)与过氧化物酶体的生成密切相关。由于人细胞中过氧化物酶体的pex基因会发生突变从而引起多种疾病,如过氧化物酶体生成障碍(PBDs)[7-9]。酵母具有过氧化物酶体含量高、稳定性好、成本低等优点是研究过氧化物酶体的良好模型。因此,以酵母为模型进行过氧化物酶体突变体研究对多种与过氧化物酶体相关疾病的预防和治疗有重要意义。目前已鉴定的36个pex基因(表1)的功能大致分为三类:基质蛋白导入、过氧化物酶体生长、调节过氧化物酶体的大小或丰度[3-4,7]。酵母的大多数过氧化物酶体突变体,如pex1、pex2、pex6、pex8、pex13、pex14等,仍含有过氧化物酶体残留物[5,8,10]。这是由于部分过氧化物酶体膜(含有膜蛋白PMP)被运输到过氧化物酶体中,形成残体。而pex3突变体和pex19突变体没有过氧化物酶体膜残留[11],并且回补pex3和pex19后细胞可重新生成功能化的过氧化物酶体[12-13]。这说明细胞不仅通过生长和分裂的方式增加过氧化物酶体数量,还可通过自身从头合成的方式形成新的过氧化物酶体。因此,pex3和pex19被确定为过氧化物酶体膜早期合成的关键基因。基于过氧化物酶体的形成取得了大量研究成果,本文总结了过氧化物酶体的起源和细胞生成过氧化物酶体的研究进展,初步阐述过氧化物酶体的形成机制,为预防和治疗与过氧化物酶体相关的疾病提供参考。

表1 pex基因在过氧化物酶体的作用
1 过氧化物酶体起源
传统意义上认为过氧化物酶体起源于内质网(Endoplasmic reticulum,ER)和线粒体(Mitochondrion),并逐步发展为成熟的过氧化物酶体[14]。过氧化物酶体的形成过程先由内质网芽生,再以小泡形式运送至高尔基复合体进行加工和分选,最后在高尔基的反面(成熟面)以分泌泡的形式释放而成。Agrawal等[15]和Novikoff等[16]在过氧化物酶体附着于豚鼠肾小管细胞中的某个特定区域发现了光滑的ER茎状结构,其实是囊泡状的过氧化物酶体与ER相连,证实过氧化物酶体生成与ER有关。在酵母和哺乳动物细胞中有多种过氧化物酶体膜蛋白(PMP)通过ER运至过氧化物酶体[17]。大多数过氧化物酶体膜脂质在ER中合成,由ER转运或者通过泡囊运输至过氧化物酶体[18-19]。David等[20]提出过氧化物酶体膜通过ER上含PMP的囊泡出芽,并且ER形状也影响过氧化物酶体繁殖,pex30位于与过氧化物酶体紧密关联的ER亚结构中。 在ER亚结构域中建立与过氧化物酶体的接触位点,过氧化物酶体增殖依赖于管状的完整性,因此ER亚结构的形状也会影响过氧化物酶体繁殖。ER亚结构会逐步形成新的过氧化物酶体。毕赤酵母在只有少量葡萄糖或甘油的培养基中,只会产生几个体积很小的过氧化物酶体。当碳源转为甲基营养物时,过氧化物酶体会进一步组装、分裂并且成为占有80%细胞体积的细胞器。过氧化物酶体作为受体接受过氧化物酶体分裂和组装过程的PMP和内容物,使过氧化物酶体成熟并能代谢甲基营养物(图1)。由图1可见,前过氧化物酶体囊泡从ER出芽,协同线粒体相关蛋白(DRP)和线粒体动力样蛋白(DLP)等相关因子,它们提供动力等作用,在pex3、pex19共同作用下形成过氧化物酶体。毕赤酵母在利用甲醇发酵过程中,与基质蛋白导入作用相关的基因进行作用,过氧化物酶体变大,并进行甲醇代谢。
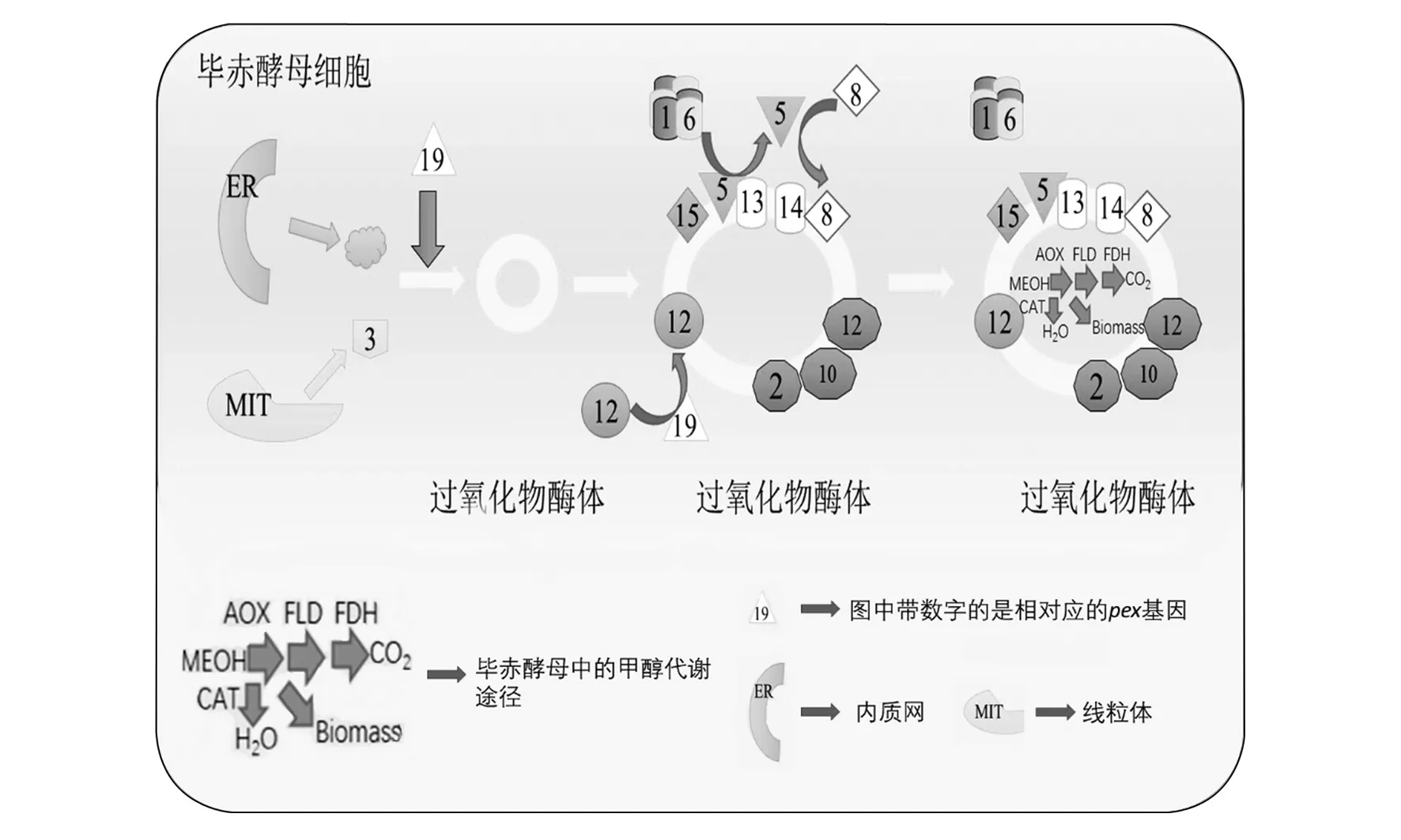
图1 毕赤酵母过氧化物酶体的成熟过程Fig.1 Maturation of peroxisome in Pichia pastoris
2 过氧化物酶体生成方式
过氧化物酶体的生成方式有以下两种模型。第一种模型为过氧化物酶体通过ER生成,并发展为成熟的过氧化物酶体[21],称为从头合成方式;第二种模型为细胞内现存的过氧化物酶体吸收由ER提供的脂质等物质进行生长再进行分裂[22],称为分裂方式。
2.1 从头合成方式
基于解脂耶氏酵母(Yarrowialipolytica),研究者首次提出通过ER从头合成过氧化物酶体的方式是由囊泡运输系统完成的[21]。当过氧化物酶体以从头合成的方式从ER出芽时,是以前过氧化物酶体囊泡(Pre-peroxisomal vesicles,ppVs)的状态出现的,新产生的ppVs之间互相发生融合,融合后产生新的过氧化物酶体囊泡,融合前的囊泡和融合后的囊泡含有不同的蛋白亚群,这个结果也在酿酒酵母(Saccharomycescerevisiae)中得到了验证[23]。这两类囊泡揭示了蛋白质分选机制的存在。分选机制通过控制基质蛋白进入过氧化物酶体,直至出芽完成。ER的蛋白质组成决定其形成前过氧化物酶体囊泡的蛋白质成分。ER上的蛋白需要蛋白复合体的帮助先到达ppVs再由ppVs向过氧化物酶体进行输送,蛋白复合体由识别ER蛋白质组分(例如PEX1、PEX5、PEX7)和RING(锌指型结构域,例如PEX2、PEX10、PEX12组成的泛素化复合物)构成。新产生囊泡融合后形成具备运输能力的过氧化物酶体。融合过程中,前过氧化物酶体囊泡不能与成熟过氧化物酶体融合,这保证了成熟过氧化物酶体中有正确的蛋白质组分。过氧化物酶体中AAA型ATPase PEX1/PEX6复合物负责基质蛋白进入前过氧化物酶体囊泡[24]。因为这种多途径运输机制也参与其他功能性复合物的组装[25-26],途径多变、功能复杂,还可能是一种广泛性的机制,PEX蛋白是如何影响过氧化物酶体生物发生途径还需要进行继续研究。可以依靠检测蛋白质相互作用的方法来进行研究,例如采用可视化多色BiFC方法来比较蛋白质之间的相互作用网络,可视化的方法能够反映在正常生理环境下生物发生途径中蛋白质之间的相互作用并且利用亚细胞进行定位。
缺乏pex3或pex19的马兜铃欧格氏霉(Ogataeapolymorpha)的ppVs与ER(pn-ER)之间存在网状结构[27],这些ppVs在具有pex3或pex19的细胞中未被检测到,表明缺少pex3和ATG1(自噬相关1)或pex19和ATG1的细胞也存在ppVs。当缺乏pex3的细胞重新引入pex3并表达时,胞内的ppVs可以成熟为功能性过氧化物酶体[28-29]。然而缺乏ppVs的细胞是如何形成新的过氧化物酶体,以及细胞由于缺乏ppVs时如何强制性地将不对称过氧化物酶体分到子细胞中从而形成新的过氧化物酶体等现象还无法说明,需要继续研究。基于以上信息,过氧化物酶体通过内质网从头合成过程分为五步:①将PMP导入ER;②PMP到特定的pn-ER域内分选;③包装PMP和发芽到囊泡载体中;④携带了1组特定的互补PMP囊泡载体进行融合;⑤组装重要的复合体,然后导入基质蛋白(图2)。
2.2 分裂方式
通过对酵母过氧化物酶体突变体研究证实,过氧化物酶体也能通过分裂的方式增殖[23,26-29]。过氧化物酶体通过基质蛋白和膜组分的加入而体积变大,当达到一定体积时,过氧化物酶体进行不对称分裂,形成两个新的过氧化物酶体[21,30-32]。其中较小的过氧化物酶体继续生长,导致细胞内出现异质化的过氧化物酶体群[19]。过氧化物酶体生长通过裂变协调,再通过囊泡将内质网的蛋白质转移到成熟的过氧化物酶体中。从头合成过程中的囊泡不能与成熟的过氧化物酶体融合,所以分裂方式所使用的囊泡与从头合成的囊泡截然不同。
过氧化物酶体的分裂增殖分为五步[23]:①过氧化物酶体结构发生变化,膜加速生长,体积变大;②过氧化物酶体膜的一侧突出;③过氧化物酶体突出膜伸长;④基质蛋白进入伸长的膜;⑤原有的过氧化物酶体通过裂解方式形成单个过氧化物酶体(图2)。

图2 过氧化物酶体生物发生过程示意图Fig.2 Schematic diagram of peroxisome biogenesis
首先,pex11介导过氧化物酶体裂变。裂变过程还需要线粒体相关蛋白(DRP)和线粒体动力样蛋白(DLP)等相关因子提供动力[33]。裂变中,激活的pex11介导过氧化物酶体形态微管化,具备膜锚定功能的动力相关蛋白在膜伸长的部位富集,然后过氧化物酶体膜收缩,DRP被招募到细胞质中促进膜分裂形成新的过氧化物酶体。虽然裂变在分子水平上尚未得到良好的表征,但在酵母中PEX11确实与FIS1(fission 1)发生相互作用,进行磷酸化调节[26,28,34],并且PEX11的寡聚状态(单体与二聚体)对氧化还原反应十分敏感,可以对成熟的过氧化物酶体分裂进行协调[32]。
酿酒酵母(Saccharomycescerevisiae,Sc)、巴斯德毕赤酵母(Pichiapastoris,Pp)和多形汉逊酵母(Hansenulapolymorpha)都在同源位置S165/S173/S174出现Pex11磷酸化。在过氧化物酶体增殖情况下,Sc和Pp的pex11p磷酸化增加[27]。除了这些观察结果外,酵母中pex11p的产生通过pex11基因的转录进行调控并且与过氧化物酶体生物发生有着紧密联系,但仍不清楚是否以及如何通过快速信号传导调节pex11p活性。有研究者提出,ScPex11在ER进行磷酸化,而其他研究者通过研究过氧化物酶体形成中的作用,发现PpPex11磷酸化与裂变因子的募集有关[24,28]。除Pex11外,过氧化物酶体动力相关蛋白DLP1/DRP1及其线粒体裂变因子Mff(mitochondrial fission factor)均已被磷酸化[25-26]。
过氧化物酶体的从头合成模型和分裂增殖模型的主要区别在于,过氧化物酶体由内质网产生还是通过自身的裂变产生。虽然这两种途径都能形成新的过氧化物酶体,但它们的不同点在于从头生成方式动力学较慢,但新产生的过氧化物酶体包含所有“新”物质;而分裂方式动力学更快,但细胞内需要预先存在过氧化物酶体。
3过氧化物酶体两种生长机制的协调
考虑到碳源代谢和活性氧在过氧化物酶体生成中会有一定作用,会破坏蛋白质和脂质,因此新生成的过氧化物酶体会受到细胞状态和环境的影响。这些蛋白质和脂质的破坏影响了过氧化物酶体起源的研究,导致持续性地存在差异。例如,过氧化物酶体从头合成和分裂方式的共存问题[35-37]。多形汉逊酵母pex25、pex11双缺失菌株阻断了从头生成和裂变,不能形成过氧化物酶[9,38]。双缺失菌株分别回补pex25、pex11基因并分别恢复了过氧化物酶体的从头合成和裂变方式。说明多形汉逊酵母拥有这两种独立的过氧化物酶体形成方式。这两种方式分别受到遗传和环境扰动的影响[39-40]。
4 展 望
随着研究的深入,酵母过氧化物酶体的两种形成机制已经被证实:从头合成和分裂方式形成。但是,与过氧化物酶体形态和生长繁殖相关的蛋白的作用和协调关系还有待于进一步研究。目前,多种相似模式系统中的基因和蛋白质分析表明跨物种甚至同一物种内部的过氧化物酶体相关基因和蛋白质的作用均存在差异,可见过氧化物酶体的形成过程非常复杂,尤其内部协调过程(包括从头开始)、调节过氧化物酶体起始、裂变、输入、蛋白质降解和遗传的活动。近几年来,已经通过酵母与其他细胞合作并产生了关于过氧化物酶体动力学过程的数据集[41-43],有助于建立广泛的过氧化物酶体通信的预测网络模型。利用网络模型建立蛋白质相互作用模型,现阶段研究者已经可以利用酵母双杂交系统、G蛋白偶联受体(GPCR 和 G Protein)方法、双分子荧光互补(Bimolecular Fluorescent Complimentary, BiFC)等可视化技术为确立蛋白质相互作用网络提供了可能。另外,酵母菌的pex基因突变与过氧化物酶体形态之间的关系还有待进一步完善。现阶段的酵母菌过氧化物酶体研究主要集中在pex基因突变的筛选、过氧化物酶体形态的控制、过氧化物酶体的形成动力学和其形成的关键分子确认。近年来,研究者们对过氧化物酶的结构和功能的了解影响了对过氧化物酶体蛋白质进口机制的组成和结构的看法。但是,对折叠甚至寡聚状态下的蛋白质如何跨过氧化物酶体膜转运的详细机制仍需要进一步研究。在过氧化物酶体膜中发现了足够大并且可以容纳折叠蛋白的蛋白质通道[44],可能为寡聚蛋白质的转运提供初步思路和今后的研究方向。青霉素的合成过程涉及4个基因,其中ACVS(δ-(l-α-aminoadipyl)-l-cysteinyl-d-valine (ACV) synthetase)和IPNS(isopenicillin N synthase)编码胞质蛋白质。pex3是过氧化物酶体定位所需要的基因,Dnm1是细胞器增殖需要的基因。产黄青霉的4个合成青霉素基因在多形汉逊酵母中表达后,成功合成青霉素。pex3突变导致青霉素合成量显著下降[45]。而且pex11也影响青霉素的生成[46]。将这些发现综合到过氧化物酶体生成的数学模型中,可以为生物过程控制和药物开发提供依据。鉴于现阶段建立PEX与酵母过氧化物酶体的体积之间的数学模型仍具有挑战性,因此,需要发现更多的与过氧化物酶体形成相关的蛋白质。随着基因工程技术的发展将有助于更精确阐述过氧化物酶体的形成机制,为预防过氧化物酶体相关疾病服务。
