银杏二萜内酯葡胺注射液对局灶性脑缺血大鼠SIRT1/HIF-1α/VEGF信号通路及突触可塑性的影响
2021-06-30王辉宋爽赵建传
王辉 宋爽 赵建传
(中国人民解放军联勤保障部队第966医院 1.神经内科;2.内科,辽宁 丹东 118000)
脑血管疾病致死、致残率高,预后差,给患者家庭及社会带来严重负担,且发病率呈上升趋势,但目前有效治疗手段仍较少[1-2],银杏二萜内酯葡胺注射液即银杏二萜内酯葡胺注射液,是由本项目组研发的治疗缺血性脑卒中的新型药,具有活血通络之功效,可有效治疗脑卒中、中风等脑血管疾病,改善患者神经功能,但其具体作用机制有待深入探究[3-4]。早期改善缺血性脑血管疾病边缘区血流是改善组织损伤及患者预后的关键,血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种较强的促血管生成因子,缺氧诱导因子-1α(hypoxia-inducible factor 1α,HIF-1α)是在缺血状态下对血管新生其核心调控作用的转录因子,沉默信息调节因子2相关酶1(silent information regulator 2 related enzyme 1,SIRT1)可参与缺血缺氧状态下氧化应激反应、炎症反应等,在缺血性脑疾病脑血管损伤过程中发挥重要作用[5-6]。脑卒中后脑神经功能恢复还依赖于健在神经元轴突发芽形成新的突触联结,即突触可塑性[7]。因此本研究通过观察银杏二萜内酯葡胺注射液对局灶性脑缺血大鼠SIRT1/HIF-1α/VEGF信号通路及突触可塑性的影响,以期揭示其对缺血性脑损伤的保护作用机制。
1 材料与方法
1.1 动物 成年雄性健康6周龄SPF级SD大鼠,体重180 g-200 g,购自南京君科生物工程有限公司。实验动物生产许可证号:SCXK(苏)2018-0011,动物质量合格证号:0019012509。大鼠均于(23±2)℃温度、(50±10)% 湿度,12 h/12 h光照/黑暗环境,自由饮水饮食条件下适应性饲养1周。本动物实验均经本院动物伦理委员会批准。
1.2 药物、试剂及仪器 银杏二萜内酯葡胺注射液(银杏二萜内酯葡胺注射液,规格:每支装5mL,含银杏二萜内酯25mg,批准文号:国药准字Z20120024)购自江苏康缘药业股份有限公司;尼莫地平(规格:4 mg/瓶,批准文号:国药准字H20060182)购自福建省闽东力捷迅药业有限公司;MCAO线栓(型号:503356PK5Re)购自天津敏学科技有限公司;兔源anti-PSD-95(货号:ab18258)、anti-SYN(货号:ab32127)、anti-SIRT1(货号:ab189494)、anti-HIF-1α(货号:ab2185)、anti-VEGF(货号:ab53465)、anti-β-actin抗体(货号:ab179467),二抗羊抗兔IgG(货号:ab6721)均购自英国Abcam公司;MODEL550型酶标仪购自美国Bio-Rad公司等。
1.3 方法
1.3.1 局灶性脑缺血大鼠模型建立及分组 72只SD大鼠随机分为假手术组、模型组、尼莫地平组、银杏二萜内酯葡胺注射液低、中、高组,每组12只。模型组、尼莫地平组、银杏二萜内酯葡胺注射液低、中、高组大鼠参照改良Zea Longa法[8],采用10%水合氯醛(350 mg·kg-1)腹腔注射麻醉后,仰卧位固定,分离颈总动脉,在颈内、颈外动脉分叉处结扎,在颈外动脉距颈内动脉2 mm处剪一小口插入中动脉栓塞(middle cerebral artery occlusion,MCAO)线栓,插入颈内动脉约18 mm,制备右侧大脑局灶性脑缺血大鼠模型。假手术组只分离颈总动脉及颈内、颈外动脉,不插入MCAO线栓。术后24 h尼莫地平组尾静脉注射尼莫地平16.2 mg·kg-1,银杏二萜内酯葡胺注射液低、中、高组分别尾静脉注射银杏二萜内酯葡胺注射液1.3 mg·kg-1、2.6 mg·kg-1、5.2 mg·kg-1[9],假手术组与模型组给予等体积0.9%生理盐水,每天1次,连续7 d。另术后均连续3 d腹腔注射2万U庆大霉素防止感染,并采用保温灯照射保证术后大鼠肛温37℃左右。
1.3.2 神经功能缺损评分测定 参照Bederson评分标准[10],采用双盲法于术后4 h(治疗前)、7 d(治疗后)对大鼠进行神经功能缺损评分:轻提大鼠尾巴远离桌面10 cm,轻推大鼠肩膀,直至前肢滑动数厘米,并选择不同方向重复数次。正常大鼠2个前爪向桌面方向伸直,在不同方向抵抗力一致,而脑损伤大鼠偏瘫侧前肢屈曲。无神经功能缺损记为0分;前肢屈曲,提尾实验阳性记为1分;侧推抵抗力下降,伴前肢屈曲,无转圈行为记为2分;伴自发性转圈行为、自由运动时向偏瘫侧划圈记为3分。
1.3.3 脑含水量及脑梗死率测定 治疗结束后,腹腔麻醉处死大鼠,断头取脑,置于液氮中,沿冠状切成 2 mm切片5片,置于1% TTC中避光孵育10 min,染色后正常脑组织呈红色,梗死脑组织呈白死,拍照后采用Image J软件分析脑梗死区域面积,梗死率=5片梗死区域总面积/5片脑片总面积×100%。断头取脑后称取脑组织湿重(wet,W),之后置于95℃恒温干燥箱中烘干至恒重,称取干重(dry,D),脑含水量=(W-D)/W×100%。
1.3.4 脑组织PSD-95、SYN、SIRT1、HIF-1α、VEGF蛋白表达量检测 采用免疫印迹(western blot,WB)法[11]检测缺血侧脑组织突触重塑标志蛋白突触后密度蛋白-95(postsynaptic density protein-95,PSD-95)、突触素(synaptophysin,SYN)及SIRT1/HIF-1α/VEGF信号通路相关蛋白SIRT1、HIF-1α、VEGF表达量。采用蛋白抽提试剂盒提取脑组织总蛋白,BCA试剂盒检测蛋白浓度,置于-80℃保存备用。取40SymbolmA@g蛋白样品,进行SDS-PAGE电泳,PVDF膜转膜,室温封闭,添加一抗anti-PSD-95(稀释比1∶500)、anti-SYN(稀释比1∶20000)、anti-SIRT1(稀释比1∶1000)、anti-HIF-1α(稀释比1∶1000)、anti-VEGF(稀释比1∶500)、anti-β-actin抗体(稀释比1∶5000)4℃孵育过夜,TBST缓冲液洗膜,二抗IgG(1∶10000)室温孵育1.5 h,显色,曝片,观察并分析各蛋白灰度值。
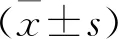
2 结果
2.1 各组大鼠神经功能缺损评分比较 术后4 h,与假手术组比较,模型组、尼莫地平组、银杏二萜内酯葡胺注射液低、中、高组大鼠神经功能缺损评分显著增加(P<0.05)。术后7 d,与假手术组比较,模型组大鼠神经功能缺损评分显著升高(P<0.05);与模型组比较,尼莫地平组、银杏二萜内酯葡胺注射液低、中、高组大鼠神经功能缺损评分显著降低(P<0.05),其中银杏二萜内酯葡胺注射液中、高组依次低于尼莫地平组(P<0.05),见表1。
2.2 各组大鼠脑含水量及脑梗死率比较 与假手术组比较,模型组大鼠脑含水量、脑梗死率显著增加(P<0.05);与模型组比较,尼莫地平组、银杏二萜内酯葡胺注射液低、中、高组大鼠脑含水量、脑梗死率显著降低(P<0.05),其中银杏二萜内酯葡胺注射液中、高组依次低于尼莫地平组(P<0.05),见表2。

表2 各组大鼠脑含水量及脑梗死率比较Table 2 Comparison of brain water content and cerebral infarction rate in each group
2.3 各组大鼠脑组织SIRT1、HIF-1α、VEGF 蛋白表达量比较 与假手术组比较,模型组大鼠脑组织SIRT1、HIF-1α、VEGF蛋白表达量显著降低(P<0.05);与模型组比较,尼莫地平组、银杏二萜内酯葡胺注射液低、中、高组大鼠脑组织SIRT1、HIF-1α、VEGF蛋白表达量显著增加(P<0.05),其中银杏二萜内酯葡胺注射液中、高组高于尼莫地平组(P<0.05)。见图1、表3。

表3 各组大鼠脑组织SIRT1、HIF-1α、VEGF蛋白表达量比较Table 3 Comparison of SIRT1,HIF-1α,VEGF protein expression in brain tissue of rats in each group

图1 WB检测脑组织SIRT1、HIF-1α、VEGF蛋白表达Figure 1 WB detection of SIRT1,HIF-1α,VEGF protein expression in brain tissue
2.4 各组大鼠脑组织PSD-95、SYN蛋白表达量比较 与假手术组比较,模型组大鼠脑组织PSD-95、SYN蛋白表达量显著降低(P<0.05);与模型组比较,尼莫地平组、银杏二萜内酯葡胺注射液低、中、高组大鼠脑组织PSD-95、SYN蛋白表达量显著增加(P<0.05),其中银杏二萜内酯葡胺注射液中、高组高于尼莫地平组。见图2、表4。
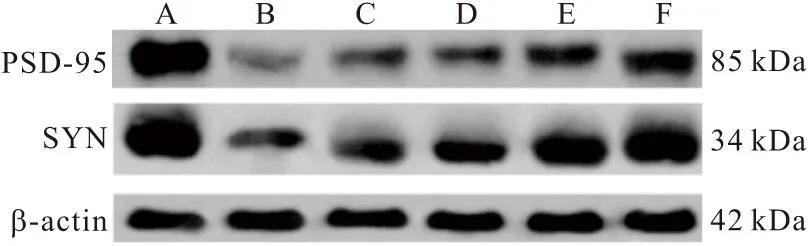
图2 WB检测大鼠脑组织PSD-95、SYN蛋白表达Figure 2 Detection of PSD-95 and SYN protein expression in rat brain by WB注:A.假手术组;B.模型组;C.尼莫地平组;D.银杏二萜内酯葡胺注射液低组;E.银杏二萜内酯葡胺注射液中组;F.银杏二萜内酯葡胺注射液高组

表4 各组大鼠脑组织PSD-95、SYN蛋白表达量比较Table 4 Comparison of PSD-95 and syn protein expression in brain tissue of rats in each group
3 讨论
缺血性脑卒中是由于脑血管阻塞、血流减少导致氧气及其他营养物质缺乏引起脑组织应激反应、炎性损伤等,可导致神经毒性反应和细胞死亡,最终导致神经功能障碍[12-13]。本研究采用MCAO线栓法[14]制备局灶性脑缺血大鼠模型,结果发现,术后4 h即可出现神经功能缺损,提示局灶性脑缺血可导致大鼠神经功能障碍,即模型制备成功。银杏二萜内酯葡胺注射液是治疗缺血性脑疾病的第5类新药,主要由银杏二萜内酯A(约占60%)、银杏二萜内酯B(约占2%)、银杏二萜内酯K(约占26%)组成,研究表明,银杏二萜内酯葡胺注射液可有效抑制缺血再灌注大鼠脑细胞凋亡,改善脑脊液生化水平,调节脑内氨基酸类和单胺类神经递质水平等,对脑损伤有显著保护作用[15-17]。本研究结果发现,大鼠给予尼莫地平或银杏二萜内酯葡胺注射液治疗后,与模型组比较,尼莫地平组、银杏二萜内酯葡胺注射液低、中、高组大鼠神经功能缺损评分、脑含水量、脑梗死率显著降低,其中银杏二萜内酯葡胺注射液中、高组低于尼莫地平组,提示银杏二萜内酯葡胺注射液可显著减轻局灶性缺血性引起的大鼠脑组织水肿及脑梗死,改善其神经功能。
SIRT1是一种烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NAD+)依赖的脱乙酰基酶,可靶向多种转录因子及信号分子,参与多种细胞增殖、凋亡、能量代谢、氧化应激等过程的调控[18]。SIRT1还可参与血管内皮稳定及内皮重塑,是血管生成反应中重要调节因子[19]。马毓等[20]研究报道,缺血脑组织SIRT1过表达及活性增高可减少脑梗死面积,促进脑组织VEGF表达及神经血管新生,降低神经功能缺损评分。血管新生可增加脑梗死局部血流及氧供应,HIF-1α可调节缺血缺氧时细胞内氧平衡,作为转录因子激活下游靶基因VEGF等表达,促进新血管生成,改善脑缺血后能量代谢障碍[21]。Geng等[22]研究报道,促进HIF-1α/VEGF信号通路激活可增强HUVECs细胞的缺氧耐受性和血管稳态,改善小鼠皮瓣缺血再灌注损伤。本研究结果发现,与假手术组比较,模型组大鼠脑组织SIRT1、HIF-1α、VEGF蛋白表达量显著降低;与模型组比较,尼莫地平组、银杏二萜内酯葡胺注射液低、中、高组大鼠脑组织SIRT1、HIF-1α、VEGF蛋白表达量显著增加,提示银杏二萜内酯葡胺注射液可改善局灶性脑缺血大鼠神经功能及脑梗死可能与增加脑组织SIRT1、HIF-1α、VEGF蛋白表达,促进SIRT1/HIF-1α/VEGF信号通路激活有关。
局灶性脑缺血后脑组织梗死损伤,突触后膜N-甲基-D-门冬氨酸(N-methyl-D-aspartate,NMDA)受体激活,钙离子通透性增加,可引起兴奋性氨基酸毒性损伤,造成机体神经功能障碍,而突触结构的可塑性与神经生长、修复等密切相关[23]。SYN是特异性位于轴突终末的突触囊泡膜面上的钙结合蛋白,其表达量可间接反映突触密度,与神经可塑性密切相关。PSD-95是PSD蛋白家族之一,是附着于突触后膜胞质侧的一种超微结构,是神经信息传递的重要基础,是突触功能活动变化的标志性蛋白[24,25]。本研究结果显示,与假手术组比较,模型组大鼠脑组织PSD-95、SYN蛋白表达量显著降低,与模型组比较,尼莫地平组、银杏二萜内酯葡胺注射液低、中、高组大鼠脑组织PSD-95、SYN蛋白表达量显著增加,提示银杏二萜内酯葡胺注射液可改善局灶性脑缺血大鼠神经功能可能与上调脑组织PSD-95、SYN蛋白表达,促进突触可塑性有关。
4 结论
银杏二萜内酯葡胺注射液可对抗局灶性脑缺血,改善大鼠神经功能,可能与促进SIRT1/HIF-1α/VEGF信号通路激活及脑缺血后突触可塑性形成有关,可对银杏二萜内酯葡胺注射液治疗缺血性脑疾病的作用机制研究提供新的参考。
