LC3相关吞噬作用在真菌感染中的作用机制研究进展
2021-06-29关梦琦崔岩李珊山
关梦琦 崔岩,2 李珊山,2
(1.吉林大学白求恩第一医院皮肤科,长春 130021;2.吉林省皮肤性病学重点实验室,长春 130021)
吞噬(phagocytosis)是机体防御真菌感染的重要措施,专业吞噬细胞如巨噬细胞、树突状细胞、中性粒细胞和非专业吞噬细胞如角质形成细胞、上皮细胞,可通过模式识别受体(pattern recognition receptors,PRRs),如toll样受体(Toll-like receptors,TLRs)、C型凝集素受体(C-type Lectins ,CLRs)如Dectin-1或甘露糖受体(Mannose receptor),识别并结合微生物表面的病原相关分子模式 (pathogen-associated molecular patterns,PAMPs),激活胞内级联反应、骨架重排,将病原体内吞形成吞噬泡并与溶酶体融合进行消化微生物[1]。研究发现,细胞自噬过程中重要的标志蛋白LC3(Microtubule-associated protein 1A/1B-light chain 3),在外源刺激下宿主细胞可通过募集LC3向单层膜吞噬泡的聚集,从而提高其吞噬和杀伤病原体的效率,即LC3相关吞噬作用(LC3-associated phagocytosis, LAP)。研究表明,LAP 在清除病原微生物感染过程中具有非常重要的作用,其作用机制不同于传统的吞噬作用和自噬作用。本文重点对现有研究中的真菌感染引起的细胞自噬和LAP相关的过程进行综述。
1 自噬与LAP的差异
1.1 自噬
细胞自噬是细胞中受损、变性或衰老的各种蛋白质及外来入侵物、细胞器等被自噬体包裹并运送到溶酶体内进行消化并降解的过程,通过维持细胞存活和调节炎症来保持细胞稳态。根据细胞内底物运送到溶酶体腔方式的不同,哺乳动物细胞自噬可分为巨自噬(macroautophagy),分子伴侣介导的自噬(chaperone-mediated autophagy, CMA)和微自噬(microautophagy)3种主要方式[2]。在哺乳动物细胞中,巨自噬(本文称为“自噬”)通过形成自噬体的双膜囊泡固定受损的细胞器,蛋白质聚集体或入侵的病原体以进行降解。并且,自噬已经在各种免疫细胞中广泛研究,包括T细胞、B细胞、巨噬细胞、树突状细胞和嗜中性粒细胞[3-4]。自噬可以通过各种诱导(例如饥饿、高温、低氧、外来微生物及其毒素作用等)启动,这些因素通过抑制mTOR来被转导,诱导分隔膜或“吞噬泡”的形成。该过程通过III类PI3K复合体(包括VPS34、Beclin-1)的聚集而促进自噬体的形成。自噬的发生受自噬相关蛋白(autophagy-related,Atg)的调控,Atg参与自噬的不同阶段,Atg12-Atg5-Atg16L1蛋白体复合物存在于外膜上,LC3-II存在于分隔膜的内膜和外膜上,其中LC3-II是细胞自噬过程中重要的标志蛋白[5]。除了维持细胞稳态的作用外,自噬最近被认为对病毒、细菌和原生动物具有免疫抑作用[6]。在细胞质中发现的病原体,如Sindbis病毒[7]或单核细胞增生李斯特菌[8],其周围自噬体的形成导致其通过溶酶体降解而清除。总体而言,自噬是一种动态过程,不仅在基础水平上维持细胞稳态,还可通过细胞应激而诱导发生。
1.2 LAP
LAP是一种非典型性吞噬作用,其特点是在单层膜的吞噬泡上发现了LC3的存在, 该过程被激活后LC3被招募至吞噬体, 加速吞噬泡的成熟, 促进吞噬泡与溶酶体的融合以及抗原呈递作用, 提高机体的天然免疫及适应性免疫反应的效率, 从而更快地杀灭病原体[9]。LAP和细胞自噬过程很相似,启动都需要ROS和PI(3)P,需要共用许多蛋白,如Beclin-1、Atg3、Atg5和Atg7等,因此,ATG5或ATG7的敲除可显著降低吞噬体周围LC3的水平,使哺乳动物或细胞不能同时进行LAP和自噬[10-11]。不同于传统自噬中LC3与双膜自噬体相结合,在LAP中,LC3直接被招募到单膜吞噬体中[11-12],需要Rubicon和NOX2,不需要由ULK1 / 2、FIP200和ATG13组成的自噬预起始复合物[10,13,14]。由于LC3是自噬和LAP共有的蛋白,所以很多关于微生物感染清除机制的研究并不能确定是自噬还是LAP在发挥作用[15]。
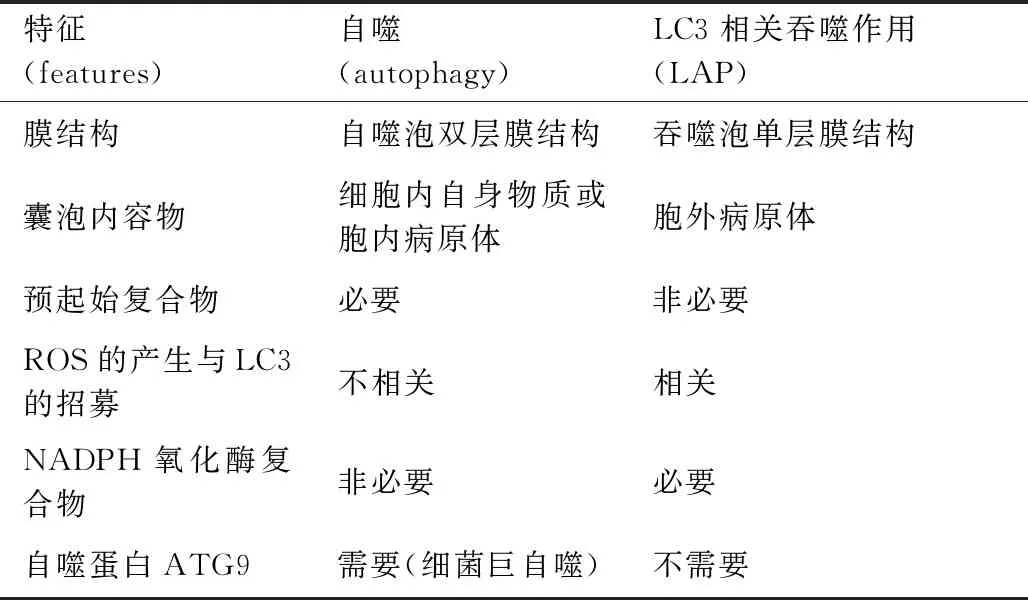
表1 自噬与LAP的特征比较[16]
2 LAP在真菌感染中的作用
由于杀灭病原体的效率较高,LAP被认为是机体天然免疫反应的重要组成部分,可以参与应对多种病原体的感染过程。近年来,LAP与常见病原菌白念珠菌、烟曲霉及新生隐球菌等感染的研究越来越多。
2.1 白念珠菌(Candida albicans)
作为控制白念珠菌感染的主要免疫细胞群,固有免疫细胞通过吞噬作用清除真菌并通过Dectin-1识别白念珠菌壁表面表达的β-1,3-葡聚糖来产生促炎性细胞因子。Ma等[17]的研究显示,不同细胞类型间吞噬体成熟的差异可能导致LC3聚集的结果不相同。在树突状细胞中,真菌抗原触发Dectin-1导致LC3聚集到含有白念珠菌的吞噬体周围,尽管该途径在 TNF-α和IL-6的产生及对白念珠菌的杀伤方面无差异[18],但确实促进了MHC II类真菌抗原的呈递。与树突状细胞的结果相反,巨噬细胞中的研究显示LC3β-/-和野生型原代巨噬细胞在TNF-α、IL-6和IL-1β的产生及白念珠菌的存活方面存在差异,真菌吞噬体周围LC3的聚集对巨噬细胞的杀真菌活性和促炎细胞因子的表达都有重要作用。此外,研究还发现Dectin-1触发的LC3聚集及LAP过程均需要Syk磷酸化和NADPH氧化酶产生ROS[18-20]。最近,有研究揭示了经典自噬和LAP在对抗白念珠菌攻击中的协调机制,Duan等[21]的研究表明在巨噬细胞中白假丝酵母可抑制LC3转换,其吞噬作用会降低自噬通量。此外,研究还验证了LC3聚集是检测LAP诱导的关键方法,但由于LAP过程中是否发生了LC3转换尚不清楚,因此在研究LAP过程时,应避免进行LC3-I至LC3-II转化和LC3-II转换的测定。然而,很多白念珠菌在LAP过程中的分子细节尚不清楚,仍需进一步探索。
2.2 烟曲霉(Aspergillus fumigatus)
除白念珠菌外,最新的数据表明,LAP在控制最常见的霉菌感染烟曲霉中也起着重要作用。与酵母菌不同,许多霉菌感染的发病机理是通过分生孢子或孢子的肺暴露。Kyrmizi等[22]使用人单核细胞和烟曲霉分生孢子共培养,结果显示只有活的烟曲霉分生孢子才能在吞噬作用后2~4 h引发LC3-II形成峰值;而Martinez等[10]对Rubicon缺陷小鼠的研究表明LC3的募集和清除是由LAP介导,而非自噬。研究人员证明对烟曲霉的杀伤需要功能性LAP,缺乏Rubicon、Beclin-1、NOX2或Atg7的巨噬细胞能够吞噬等量的烟曲霉分生孢子,但没有将LC3募集到吞噬体中,研究者对Beclin-1flox/flox, Rubicon-1- / -和Atg7flox/flox小鼠鼻内接种烟曲霉,与野生型对照组相比,在LAP缺陷小鼠中IL-1、IL-6、IL-12和TNF-的显著增加[10]。LAP通过抑制促炎性细胞因子基因的表达和肺中肉芽肿的形成来保护小鼠免受肺曲霉病的侵袭。LAP还可以稳定NOX2 NADPH氧化酶复合物以产生ROS。由此可见,LAP在宿主细胞清除曲霉中起关键作用[10]。
2.3 新生隐球菌(Cryptococcus neoformans)
Qin等[23]通过对果蝇S2细胞的研究证明宿主细胞感染新生隐球菌需要自噬蛋白(包括Atg2a、Atg5和Atg9a)和III类PI3-激酶活性,该报告证明ATGs(ATG5、ATG9a和ATG12)参与但非必需,在巨噬细胞中新生隐球菌被RAW264.7吞噬,蛋白质聚集在含有新生隐球菌空泡附近。感染15 h后,ATG2a、ATG5、ATG9a、ATG12和LC3增强了巨噬细胞内新生隐球菌的胞内复制和从空泡中逃逸。另一篇文章报道了内源性隐球菌孢子的LC3聚集,在骨髓细胞中条件性敲除ATG5并没有改变隐球菌感染小鼠的存活率,然而,基因敲除小鼠表现出肺部真菌负荷的减少和MIP-1α(CCL3)、IP-10(CXCL10)蛋白以及2型细胞因子IL-4、IL-13(50)表达量的降低,但IFN-γ和IL-17的表达似乎没有改变[24]。因而,有待进一步研究以更好地了解LAP在隐球菌感染中的作用。
3 小 结
LAP是细胞对病原微生物感染的一种免疫应答方式,通过将LC3锚定在吞噬泡上加速与溶酶体的融合而提高杀菌效率。近年来,在宿主对病原真菌免疫应答的背景下,真菌感染免疫也被重新定义,由于自噬及LAP的相继提出,仍有很多问题需要探究,例如,自噬与LAP是否可以相互转化;LC3的出现是自噬的指标还是LAP在发挥作用;LAP的发生机制;还有哪些分子参与LAP过程等等。总之,该领域持续研究将揭示自噬及LAP在宿主真菌免疫中发挥作用的新途径,且可能成为新的抗真菌治疗的靶点。
