一株芘好氧降解菌的筛选鉴定及共代谢特性研究
2021-06-29冯清敏王子豪唐家璇林军章谭晓明汪卫东黄婷婷田泊凝
冯清敏,王子豪,唐家璇,林军章,谭晓明,汪卫东,黄婷婷,田泊凝,肖 盟*
(1.青岛科技大学化工学院,山东 青岛 266042;2.中国石化胜利油田分公司石油工程技术研究院,山东 东营 257000)
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是由两个及两个以上苯环稠合而成的持久性有机污染物[1-2],主要来源于石油、煤炭、木材等有机高分子化合物的不完全燃烧过程以及原油的开采过程[3]。多环芳烃具有很强的疏水性和生物毒性[4],其在环境中的积聚严重危害人类的身体健康。目前,环境中的多环芳烃主要通过吸附、光降解、化学氧化、生物法等方法降解[5],其中,生物法,尤其是微生物的矿化作用,具有成本低、绿色环保、降解效果显著、不会残留有毒有害中间代谢产物等优点,是降解多环芳烃的主要手段。多环芳烃高效降解菌的筛选是降解多环芳烃的关键。目前,对于降解菌的报道大多针对低分子量多环芳烃[6],降解机理比较清晰;而高分子量多环芳烃因其水溶性差、生物利用率低、降解难度大[7],相关生物降解途径不够清晰。因此,筛选高分子量多环芳烃降解菌,并探究其降解机理及强化措施,对有效降解环境中的多环芳烃具有一定的指导意义。
共代谢作用是微生物降解多环芳烃的重要手段[8]。共代谢基质主要有葡萄糖、乙酸、蛋白胨等简单碳源以及水杨酸、邻苯二酚等中间代谢产物。添加共代谢基质后,可以显著提高微生物的代谢性能,进而强化其对多环芳烃的降解。然而,随着共代谢基质被微生物吸收殆尽,微生物对多环芳烃的共代谢作用也随之降低,最终导致多环芳烃的残留或不完全降解,产生有毒有害的中间代谢产物。对于受原油污染的环境,共代谢基质的选择最好是“就地取材”,从而避免因共代谢基质消耗而影响微生物对多环芳烃的降解,即将原油中的易降解烃类(如饱和烃和芳烃)作为共代谢基质,原位强化微生物对多环芳烃的共代谢作用。
芘作为高分子量多环芳烃模式化合物,普遍存在于石油污染土壤及油田废水中。然而,有关微生物以石油烃为共代谢基质降解芘的研究相对较少。因此,作者从胜利油田沾三区块石油污染土壤中筛选一株以芘为唯一碳源和能源的降解菌,考察菌株的生长特性及其对芘的降解性能,采用气相色谱-质谱联用仪(GC-MS)和高效液相色谱-质谱联用仪(HPLC-MS)分析中间代谢产物,推测菌株的代谢途径;分别以饱和烃、芳烃和原油为共代谢基质,结合降解酶活性分析,探讨不同共代谢基质对菌株共代谢性能的影响,为高分子量多环芳烃的降解提供一定的理论支持。
1 实验
1.1 材料、试剂与仪器
原油,由中国石化胜利油田分公司石油工程技术研究院提供,其饱和烃、芳烃、非烃和沥青质的含量分别为48.13%、22.15%、10.04%和19.83%,四组分测定方法参照SY/T 5119-2016 《岩石中可溶有机物及原油族组分分析》。
芘(质量分数98%)、双(三甲基硅基)三氟乙酰胺(BSTFA),Aldrich公司;酵母浸粉、蛋白胨,北京奥博星生物技术有限公司;乙酸乙酯、丙酮、无水硫酸钠、氯化钠等均为分析纯,国药集团化学试剂有限公司。
Agilent 6890/5975型气质联用仪、Agilent 1200型高效液相色谱仪、Agilent 6460C型高效液相色谱-质谱联用仪,美国安捷伦科技有限公司;752型紫外可见分光光度计,上海菁华科技仪器有限公司。
1.2 培养基
LB培养基(g·L-1):酵母粉5.0,蛋白胨10.0,氯化钠10.0,pH值7.0。
无机盐培养基(g·L-1):KH2PO41.0,CaCl20.01,K2HPO41.0,FeSO4·7H2O 0.1,MgSO40.5,NH4NO31.0,pH值7.0,加入2%琼脂粉可作为固体培养基,121 ℃高压灭菌20 min。
芘-无机盐培养基:以丙酮为溶剂,配制4 g·L-1芘储备液;取适量储备液于锥形瓶中,置于暗处,待丙酮完全挥发后加入适量无机盐培养基,121 ℃高压灭菌20 min。
1.3 芘降解菌的筛选
取10 g石油污染土壤加入到含有100 mg·L-1芘的芘-无机盐培养基中,在35 ℃、150 r·min-1条件下,于空气浴恒温振荡器中培养7 d;培养结束后,取上层培养液转接于含有300 mg·L-1芘的芘-无机盐培养基中继续培养7 d;重复以上操作,依次以芘浓度500 mg·L-1和700 mg·L-1的芘-无机盐培养基转接富集;富集结束后,取0.1 mL培养液,梯度稀释后涂布于芘-无机盐固体培养基上,置于恒温培养箱中;待长出菌落,挑取菌落大小及形态不同的单菌落并划线分离,即得到以芘为唯一碳源的降解菌。
1.4 芘降解菌的鉴定
菌株形态观察:将筛选菌株于LB培养基中活化至对数期,取适量菌细胞用磷酸盐缓冲液冲洗后,用透射电镜观察菌株大小及形态。
菌株种属鉴定:提取筛选菌株的DNA,用通用引物扩增菌株的16S rDNA序列,引物序列为27F (5′-AGTTTGATCMTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′);然后将扩增产物送至生工(上海)生物工程有限公司测序;将测序所得序列提交至NCBI的Genbank数据库进行序列同源性比对,用MEGA 7.0进行序列同源性分析,依据邻接法构建系统发育树,确定芘降解菌的种属。
1.5 芘降解菌的生长特性
最适生长温度的测定:将活化后的菌液按5%接种量接种至含有100 mg·L-1芘的芘-无机盐培养基中,分别在25 ℃、30 ℃、35 ℃、40 ℃条件下,于空气浴振荡器中150 r·min-1培养7 d,测定不同温度下的OD600值和培养液中芘的含量。以上试样均做3个平行。
最适pH值的测定:调整芘-无机盐培养基的pH值分别为5、6、7、8、9,将活化后的菌液按5%接种量接种至含有100 mg·L-1芘的芘-无机盐培养基中,在35 ℃、150 r·min-1条件下培养7 d,测定不同pH值下的OD600值和培养液中芘的含量。以上试样均做3个平行。
1.6 芘降解率的测定
用等体积乙酸乙酯超声萃取培养液30 min,静置2 h后收集萃取液,重复萃取3次,合并有机相;加入无水硫酸钠,4 ℃静置过夜,旋转蒸发萃取液并定容至1 mL;用0.22 μm有机滤膜过滤后,采用HPLC测定芘的含量,并计算降解率。以上试样均做3个平行。HPLC测试条件:Water C18色谱柱,紫外检测器,柱温35 ℃,流动相为甲醇,流速0.8 mL·min-1,进样量10 μL,检测波长254 nm。
1.7 中间代谢产物分析
取降解7 d后的菌液,用等体积乙酸乙酯超声萃取3次后,合并有机相;然后用6 mol·L-1盐酸调整萃余液pH值为2.0,重复萃取3次,合并中性和酸性萃取液并旋转蒸发至2 mL;有机滤膜过滤后,分别用GC-MS和HPLC-MS测定中间代谢产物组成。
GC-MS样品须氮吹挥干,加入150 μL正己烷,再加入300 μL BSTFA-三甲基氯硅烷(TMCS)(99∶1),60 ℃反应45 min,最后添加正己烷定容至1 mL。GC-MS条件:HP-5毛细管色谱柱(30 m×0.25 mm,0.25 μm),电子轰击(EI)离子源;电离能量70 eV;离子源温度230 ℃;进样口温度250 ℃;四级杆温度150 ℃;全扫描模式,扫描范围:50~550 amu;氮气流速1 mL·min-1。程序升温条件:初始温度120 ℃,保持2 min;以2 ℃·min-1升温至280 ℃,保持2 min。不分流进样,进样量1 μL。
HPLC-MS条件:C8色谱柱(2.1 mm×50 mm,1.7 μm)和XEVO G2-XS Q-TOF高分辨质谱仪,采用软电离,正负离子模式检测;进样量2 μL;检测时间6 min;流动相水-乙腈(90∶10),梯度洗脱:10%乙腈保持0.2 min,1 min后升至99%,保持2.8 min后回到初始比例直到6 min;质谱仪离子源温度120 ℃,脱溶剂气温度350 ℃。
1.8 共代谢实验
为了探究不同共代谢基质对降解菌共代谢性能的影响,分别以100 mg·L-1的饱和烃、芳烃、原油为共代谢基质,以只含有100 mg·L-1芘的芘-无机盐培养基为对照,接种后于35 ℃、150 r·min-1培养30 d,并分别于7 d和30 d测定芘的降解率。
1.9 降解酶活性的测定
按1.8方法培养菌液。待降解至第7 d,分别测定水杨酸羟化酶、原儿茶酸-3,4-双加氧酶、邻苯二酚-1,2-双加氧酶和邻苯二酚-2,3-双加氧酶的活性。粗酶液的制备参照Bradford[9]的方法;水杨酸羟化酶、原儿茶酸-3,4-双加氧酶、邻苯二酚-1,2-双加氧酶和邻苯二酚-2,3-双加氧酶活性的测定分别参照Zhou等[10]、Bubinas等[11]、Xu等[12]和刘娜等[13]的方法。以上试样均做3个平行。
2 结果与讨论
2.1 芘降解菌的筛选与鉴定
以芘为唯一碳源进行芘降解菌的筛选,得到了一株能以芘为唯一碳源和能源的降解菌M4。M4的菌落在芘-无机盐固体培养基上呈浅黄色,边缘清晰(图1a);透射电镜照片显示菌株呈短棒状,长度约1~2 μm,且有鞭毛(图1b)。
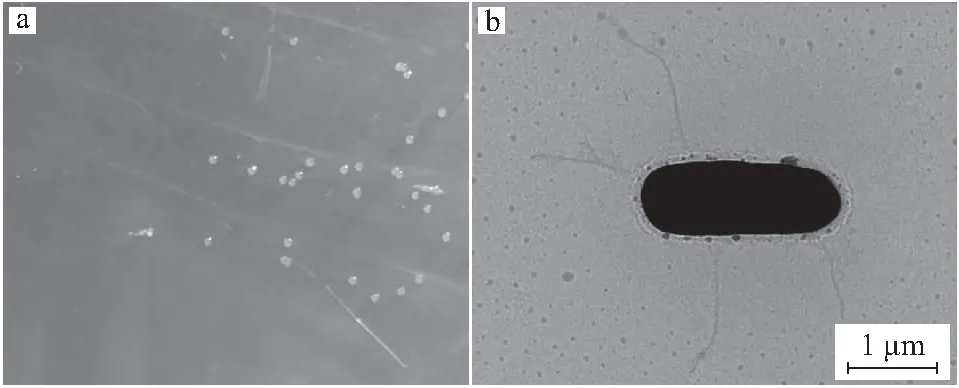
图1 菌株M4的菌落形态(a)及透射电镜照片(b)
根据邻接法构建系统发育树(图2)。经16S rDNA测序并与Genbank数据库比对分析,发现菌株M4与假单胞菌(Pseudomonas)HL22-2的同源性最高,序列相似度为99.41%,推断菌株M4为施氏假单胞菌(Pseudomonasstutzeri),命名为Pseudomonassp.M4。

图2 基于菌株M4 16S rDNA序列构建的系统发育树
2.2 芘降解菌的生长特性
在不同温度和不同pH值下,菌株M4的芘降解率和OD600值如图3所示。

图3 不同温度(a)和不同pH值(b)下,菌株M4的芘降解率及OD600值
由图3可知,随着温度的升高和pH值的增大,芘降解率及菌体浓度(OD600值)均先升高后降低。当温度为35 ℃时,芘降解率及菌体浓度均达到最高,表明菌株M4的最适生长温度为35 ℃;当pH值为7时,芘降解率最高,且具有最高的菌体浓度,表明菌株M4的最适pH值为7。
2.3 中间代谢产物分析
通过GC-MS和HPLC-MS分析菌株M4降解芘的中间代谢产物。根据中间代谢产物的GC-MS总离子流图(图4),共检测到6种中间代谢产物,各代谢产物的碎片离子质荷比(m/z)及结构式如图4所示。
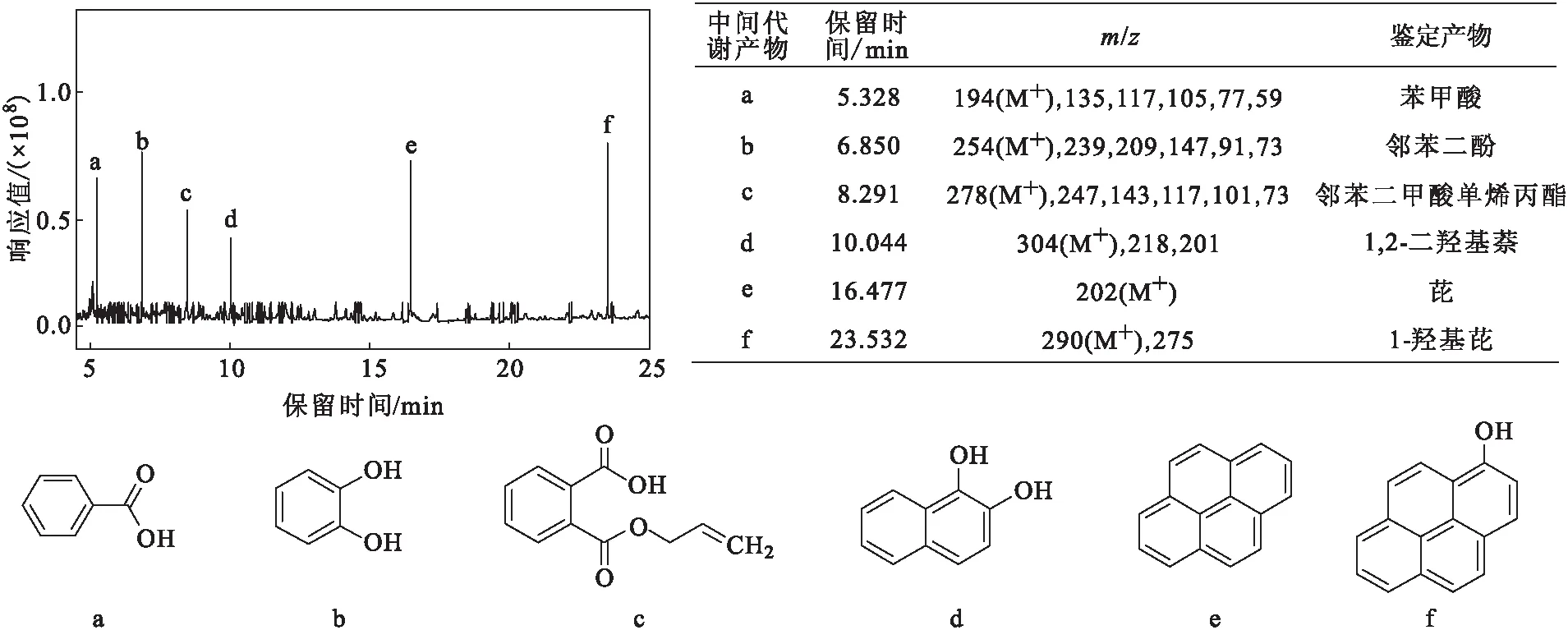
图4 菌株M4降解芘的中间代谢产物的GC-MS总离子流图及GC-MS检测到的中间代谢产物
微生物对芘的降解通常存在两种代谢途径:水杨酸途径和邻苯二甲酸途径[14]。由图4可知,降解过程中产生了下游代谢产物苯甲酸、邻苯二酚、邻苯二甲酸单烯丙酯[15],推测菌株M4对芘的降解过程存在邻苯二甲酸途径。然而,邻苯二甲酸和水杨酸在GC-MS中均未被检出。为了确定是否存在邻苯二甲酸和水杨酸,配制水杨酸、邻苯二甲酸、邻苯二酚和1-羟基-2-萘甲酸的标准样品,采用HPLC-MS在负离子模式下对标准样品和降解样品作进一步检测,结果见表1。

表1 HPLC-MS检测到的中间代谢产物
由表1可知,在降解样品中检测到了4种中间代谢产物,保留时间分别为0.510 min、0.621 min、2.250 min和3.701 min,[M-H]的质荷比分别为165.019 7、137.024 9、208.052 5和232.052 5,分别对应标准物质邻苯二甲酸、水杨酸、3,4-二羟基菲和4,5-二羟基芘。
综合GC-MS和HPLC-MS的分析结果,菌株M4降解芘的中间代谢产物包括上游代谢产物1-羟基芘、4,5-二羟基芘、3,4-二羟基菲和1,2-二羟基萘,以及苯甲酸、邻苯二酚、邻苯二甲酸单烯丙酯、邻苯二甲酸、水杨酸等下游代谢产物。
芘的生物降解过程中,遵循从高环数向低环数转化的规律[16],首先在双加氧酶的作用下发生羟基化反应,生成4,5-二羟基芘,再通过加氧酶、脱氢酶等转化为3,4-二羟基菲,从而进入菲的代谢途径[17]。在菲的降解过程中,会产生标志性代谢产物1-羟基-2-萘甲酸。但本实验并未检测到1-羟基-2-萘甲酸,可能该物质含量很低,产生后被快速消耗。许多芳烃双加氧酶基因的研究可以支持这一推测[18-19]。1-羟基-2-萘甲酸的降解存在两种代谢途径[20],分别为水杨酸途径和邻苯二甲酸途径[21]。1-羟基-2-萘甲酸在还原酶的作用下生成1,2-二羟基萘,本实验代谢产物中存在水杨酸、1,2-二羟基萘和邻苯二酚,表明菌株M4对芘的降解存在水杨酸途径。此外,1-羟基-2-萘甲酸可在双加氧酶、脱氢酶和脱氢异构酶的作用下,转化为顺式-2′-羧基苯丙酮酸盐,进一步生成邻苯二甲酸。根据GC-MS的分析结果,存在邻苯二甲酸单烯丙酯,该物质为邻苯二甲酸的衍生物,而HPLC-MS分析中检测到了邻苯二甲酸,表明在芘降解过程中,也存在邻苯二甲酸途径。因此,根据文献报道的代谢途径,结合GC-MS和HPLC-MS分析结果,推断菌株M4对芘的降解同时存在水杨酸途径和邻苯二甲酸途径,如图5所示。

图5 菌株M4对芘的代谢途径(括号内的物质为已检测到的中间代谢产物)
2.4 不同共代谢基质对降解菌共代谢性能的影响
分别以饱和烃、芳烃和原油为共代谢基质,以只含有芘的芘-无机盐培养基作为对照,分别测定7 d和30 d的芘降解率,结果如图6所示。

图6 不同共代谢基质对芘降解率的影响
由图6可知,添加共代谢基质均能够促进芘的降解,其中添加原油的效果最为明显;7 d芘降解率由高到低依次为原油组、饱和烃组、芳烃组和对照组,降解率分别为26.56%、21.50%、18.20%和17.01%,而30 d芘降解率普遍高于7 d降解率,由高到低依次为原油组、饱和烃组、芳烃组和对照组,降解率分别为61.23%、55.76%、44.71%和42.05%。表明,随着时间的延长,芘降解率逐渐升高。相较于芳烃,饱和烃更容易被微生物降解利用[22],以饱和烃为共代谢基质能够显著提高微生物的代谢活性[23],使得芘降解率显著高于对照组和芳烃组。据文献报道,在Acinetobacterjohnsonii同步降解萘和芘的过程中,萘可被优先降解,同时降解菌的生物量和降解酶活性均显著提高,进而促进芘的降解[24]。由此推断,以芳烃为共代谢基质时,低分子量的芳烃也能够提高相关降解酶的活性,进而促进芘的降解。但芳烃与芘的降解可能存在竞争性抑制[25],因而其降解率低于饱和烃组。当以原油为共代谢基质时,由于饱和烃和芳烃共存,因此,既能提高微生物的代谢性能,又能提高降解酶的活性,因此,以原油为共代谢基质时的芘降解率最高。在实际环境中,饱和烃和芳烃并不可能单独存在,以原油作为共代谢基质能有效模拟实际环境,且不需要添加其它外源营养物质,实现了共代谢基质的“就地取材”,避免了因外源营养物质的耗尽而引起降解菌降解性能的下降。
2.5 降解酶活性分析
为了探究菌株M4利用石油烃的共代谢机理,明确菌株M4降解芘的主要途径,对降解过程中水杨酸羟化酶、原儿茶酸-3,4-双加氧酶、邻苯二酚-1,2-双加氧酶和邻苯二酚-2,3-双加氧酶的活性进行测定,结果如图7所示。

a.水杨酸羟化酶 b.原儿茶酸-3,4-双加氧酶 c.邻苯二酚-1,2-双加氧酶 d.邻苯二酚-2,3-双加氧酶
由图7可知,不同共代谢基质可以强化不同种类的降解酶活性。以原油为共代谢基质时,水杨酸羟化酶的活性显著升高(图7a),仅添加饱和烃对水杨酸羟化酶无明显诱导作用,因此,推断原油能够显著提高水杨酸羟化酶的活性。然而,饱和烃显著提高了原儿茶酸-3,4-双加氧酶的活性(图7b),添加芳烃次之,而后是原油组和对照组,表明以原油为共代谢基质不能强化原儿茶酸-3,4-双加氧酶的活性。邻苯二酚是水杨酸的下游代谢产物,邻苯二酚-1,2-双加氧酶和邻苯二酚-2,3-双加氧酶是邻苯二酚降解的关键酶,经邻苯二酚双加氧酶催化后便可进入TCA循环。添加原油后邻苯二酚-1,2-双加氧酶的活性偏低(图7c),邻苯二酚-2,3-双加氧酶的活性较高(图7d),可见当以原油为共代谢基质时,邻苯二酚的降解主要依赖于邻苯二酚-2,3-双加氧酶。综合降解酶活性分析,以原油为共代谢基质会显著提高水杨酸羟化酶和邻苯二酚-2,3-双加氧酶的活性,即主要通过提高水杨酸途径中降解酶的活性强化菌株M4对芘的共代谢作用。
3 结论
从石油污染土壤中筛选到一株能以芘为唯一碳源和能源的降解菌,命名为Pseudomonassp.M4。菌株M4降解芘的最适生长温度为35 ℃、最适pH值为7。通过GC-MS和HPLC-MS分析,推断菌株M4对芘的降解存在水杨酸途径和邻苯二甲酸途径。共代谢实验结果表明,相较于饱和烃和芳烃,以原油为共代谢基质时芘的降解率最高,30 d降解率达61.23%。降解酶活性分析表明,不同的共代谢基质会强化不同代谢途径中的酶活性。以原油为共代谢基质时,菌株M4主要通过强化水杨酸途径中降解酶的活性实现对芘的共代谢作用。因此,综合生长条件及共代谢性能,菌株M4对原油污染的环境有较好的适应性,不需要添加外源营养物,能够有效利用原油强化高分子量多环芳烃的降解,具有较好的应用前景。
