1,3-偶极环加成构建3,5-二取代异噁唑类衍生物
2021-06-29李子民宁小珺孙绍发汪钢强
邓 斌,程 睿,黄 洁,李子民,宁小珺,袁 成,高 涛,孙绍发*,汪钢强,3*
(1.湖北科技学院药学院,湖北 咸宁 437100;2.湖北科技学院核技术与化学生物学院 辐射化学与功能材料湖北省重点实验室,湖北 咸宁 437100;3.中南民族大学药学院,湖北 武汉 430074)
异噁唑类衍生物是五元杂环化合物中极为重要的一类,在医药、农药及有机合成等领域具有非常广阔的应用前景。在医药领域,被用于抗感染、抗肿瘤、抗结核、抗炎、抗菌、抗HIV等药物以及心血管、神经系统等药物[1-8]的合成,如氯沙西林、异卡波肼、双氯西林、格列沙星、来氟米特、奥沙西林等[9-10]。在农药领域,因其无毒无害的优点使得应用更加广泛,如噁霉灵、异噁唑草酮、异噁隆、异噁草胺等除草剂[11-17],其中异噁唑草酮通过打开异噁唑环形成二酮腈而发挥除草作用,主要用于玉米和甘蔗田阔叶杂草和禾本科杂草的铲除[18]。在有机合成领域,由于异噁唑中N-O键易于断裂,可用于1,3-二羰基的保护,作为有机合成中间体参与多种天然产物的合成[19-20]。
基于异噁唑类衍生物的特点和广泛应用,快速、高效构建各种异噁唑类衍生物已成为有机化学家和药物化学家的关注焦点,尤其是近年来关于异噁唑类衍生物的研究进展很快,每年都有大量关于异噁唑类衍生物合成方法的文献报道[21-25]。几种典型的含异噁唑骨架药物的结构式如图1所示。

图1 含异噁唑骨架药物的结构式
3,5-二取代异噁唑的最常见合成策略包括2-异噁唑啉的氧化脱氢、炔基肟醚的环化、羟胺与α,β-不饱和羰基化合物或1,3-二羰基化合物的缩合、α,β-不饱和肟或β-酮肟的环化[26-30]等。炔烃与氧化腈的1,3-偶极环加成反应是构建异噁唑骨架最直接和广泛的方法,但由于反应过程中会用到Cu/Fe、Cu(Ⅰ)、Cu(Ⅱ)、Ru(Ⅱ)等过渡金属催化剂[31-33],使得产物残留金属,产生细胞毒性,限制了其在生物学和药物研发领域中的应用。因此,研发快速高效合成3,5-二取代异噁唑类衍生物十分必要。作者利用取代氯化肟和端位炔烃在碱作用下发生1,3-偶极环加成反应构建3,5-二取代异噁唑类衍生物,通过1HNMR、13CNMR对所得化合物结构进行表征。合成路线如图2所示。

图2 3,5-二取代异噁唑类衍生物的合成路线
1 实验
1.1 仪器
低温恒温反应浴、红外干燥箱,巩义予华仪器;ZF-6型三用紫外分析仪,上海佳鹏科技有限公司;SHZ-D Ⅲ型循环水式真空泵;85-Ⅱ型恒温磁力搅拌器;KDM型调温电热套;RE-52A型旋转蒸发仪;分析天平;Bruker DPX400型核磁共振波谱仪等。
1.2 方法
1.2.1 取代氯化肟的合成
以苯基氯化肟(Ⅰa)的合成为例(图3)。室温下,将苯甲醛(940 mmol)、盐酸羟胺(80 mmol)、碳酸钠(80 mmol)置于EtOH(50 mL)中,搅拌均匀,反应3 h;减压蒸发大部分EtOH后,将残余物溶于EtOAc(150 mL)中,将有机层用水(3×70 mL)洗涤,用Na2SO4干燥,过滤,蒸发至干,不需提纯直接进入下一步反应。将一部分苯甲醛肟(7 mmol)溶解在CH2Cl2-i-PrOH(15 mL,体积比2∶1)混合溶剂中,冰盐浴下慢慢分批加入t-BuOCl(7.4 mmol,1.2 eq)搅拌反应,薄层色谱法监控反应进程;反应完毕倒入EtOAc(100 mL)中,用水(3×50 mL)洗涤,用Na2SO4干燥,过滤,蒸发至干,即得苯基氯化肟(Ⅰa),备用。
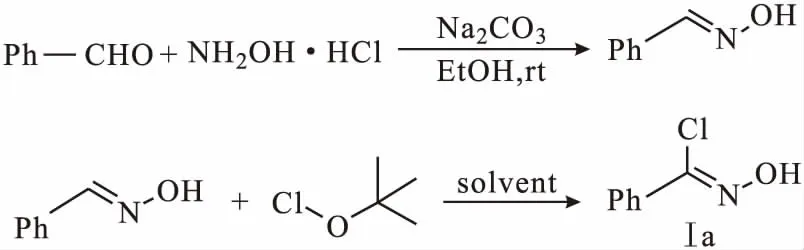
图3 苯基氯化肟的合成
1.2.2 3,5-二取代异噁唑类衍生物的合成
以3,5-二苯基异噁唑(Ⅲa)的合成为例(图4)。将制得的苯基氯化肟(Ⅰa)与苯乙炔(Ⅱa)按1∶1的比例置于10 mL圆底烧瓶中,加入2 mL CH2Cl2溶解,在Cs2CO3作用下室温反应3 h,柱色谱分离,即得3,5-二苯基异噁唑(Ⅲa),收率90%。

图4 3,5-二苯基异噁唑的合成
2 结果与讨论
2.1 反应溶剂和反应用碱的筛选
以苯基氯化肟(Ⅰa)与苯乙炔(Ⅱa)为底物合成3,5-二苯基异噁唑(Ⅲa),考察溶剂、碱、温度等对化合物Ⅲa收率的影响,以确定最佳反应条件。结果见表1。
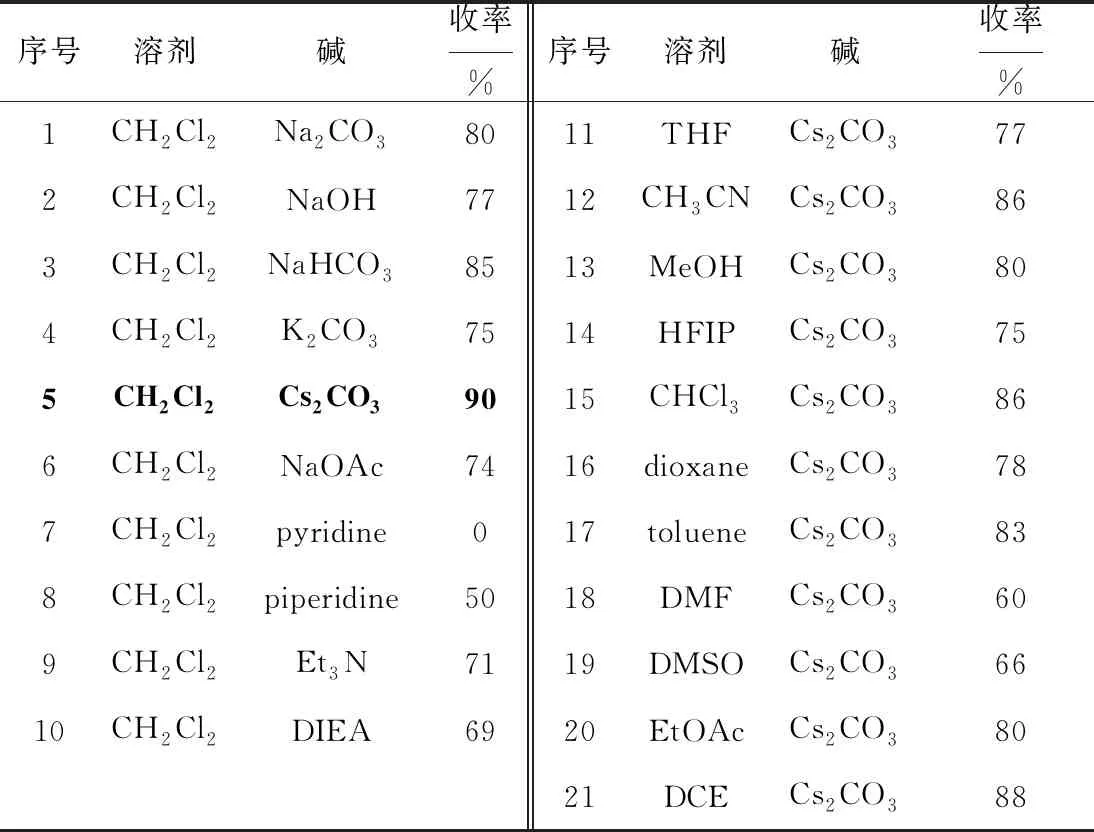
表1 反应条件的优化
由表1可知:(1)以CH2Cl2作为溶剂,分别使用无机碱Na2CO3、NaOH、NaHCO3、K2CO3、Cs2CO3等在室温下反应3 h,均能反应完全,其中以Cs2CO3的收率最高,可达到90%;分别使用有机碱NaOAc、pyridine、piperidine、Et3N、DIEA等在室温下反应3 h,收率较低或者不反应,即使延长反应时间至6 h或升温至60 ℃封管反应,收率也没有明显升高。(2)以Cs2CO3作为反应用碱,分别使用THF、CH3CN、MeOH、HFIP、CHCl3、dioxane、toluene、DMF、DMSO、EtOAc、DCE等溶剂在室温下反应3 h,均能快速反应完全,且收率差别不是很大,其中,以CH2Cl2作为溶剂时的收率最高。因此,确定反应最佳溶剂为CH2Cl2、最佳用碱为Cs2CO3。
2.2 反应普适性研究
改变端位炔烃和取代氯化肟的种类,按1.2方法合成3,5-二取代异噁唑类衍生物Ⅲa~Ⅲn、Ⅳa~Ⅳi,结果如图5所示。
由图5可知:

图5 3,5-二取代异噁唑类衍生物Ⅲa~Ⅲn、Ⅳa~Ⅳi的合成
(1)当苯基氯化肟(Ⅰa)与各类端位炔烃(Ⅱa~Ⅱn)反应时,不仅芳香类端位炔烃能够发生反应,脂肪类端位炔烃、杂环芳香类端位炔烃也可进行1,3-偶极环加成反应。对于芳香类端位炔烃,苯环取代基无论是供电子基团如甲基(Ⅲd)、甲氧基(Ⅲb)还是吸电子基团如氯(Ⅲc、Ⅲe)、溴(Ⅲf),当其处于邻位或间位时对收率影响均不大;当苯环取代基为对位氟(Ⅲi)时,收率略有下降;当苯环取代基为对位强吸电子基团硝基(Ⅲh)时,收率有所下降,这可能与强吸电子基团的电子效应有关。对于杂环芳香类端位炔烃(Ⅲn)以及萘环芳香类端位炔烃(Ⅲm),也得到了不错的收率。对于脂肪类端位炔烃(Ⅲl、Ⅲk),同样可得到高收率产物。
(2)当各类取代氯化肟(Ⅰa~Ⅰn)与苯乙炔(Ⅱa)反应时,不仅芳香类氯化肟能够发生反应,脂肪类、杂环芳香类氯化肟也可以高收率进行1,3-偶极环加成反应。对于芳香类氯化肟,苯环取代基无论是供电子基团如甲基(Ⅳa)、甲氧基(Ⅳd、Ⅳf)还是吸电子基团如氯(Ⅳe、Ⅳg)、溴(Ⅳb)或是强吸电子基团硝基(Ⅳc),对收率的影响均不大;当氯化肟取代基为脂肪烃(Ⅳh)时,收率下降到76%;当氯化肟取代基为杂环(Ⅳi)时,收率下降到79%,这可能与其生成氯化肟的稳定性有关。
以上结果表明,该1,3-偶极环加成反应对合成异噁唑类衍生物具有很强的普适性。
2.3 产物表征
3,5-二苯基异噁唑(Ⅲa):收率90%;1HNMR(400 MHz,CDCl3),δ:7.89~7.84(m,4H),7.52~7.45(m,6H),6.84(s,1H);13CNMR(100 MHz,CDCl3),δ:170.55,163.12,130.37,130.16,129.26,129.15,129.07,127.60,126.96,125.98,97.61。以上数据与文献[34]报道一致。
5-(2-甲氧基苯基)-3-苯基异噁唑(Ⅲb):收率92%;1HNMR(400 MHz,CDCl3),δ:3.98~4.02(s,3H),7.00~7.14(m,3H),7.39~7.55(m,4H),7.87~7.95(dd,J=1.2 Hz、2.6 Hz,2H),7.99~8.10(d,J=1.8 Hz,1H);13CNMR(100 MHz,CDCl3),δ:166.46,163.12,156.31,131.34,129.91,129.68,128.96,127.88,126.98,121.03,116.57,111.34,101.67,55.71。以上数据与文献[35]报道一致。
5-(2-氯苯基)-3-苯基异噁唑(Ⅲc):收率95%;1HNMR(400 MHz,CDCl3),δ:7.26~7.28(s,1H),7.36~7.55(m,6H),7.86~7.95(m,2H),7.98~8.06(m,1H);13CNMR(100 MHz,CDCl3),δ:166.74,163.08,131.84,131.00,130.21,129.55,129.17,129.09,128.83,128.43,127.39,127.01,126.39,102.60。以上数据与文献[36]报道一致。
5-(间甲苯基)-3-苯基异噁唑(Ⅲd):收率93%;1HNMR(400 MHz,CDCl3),δ:2.43~2.46(s,3H),6.81~6.84(s,1H),7.34~7.41(t,J=7.6 Hz,1H),7.44~7.54(m,4H),7.62~7.69(m,2H),7.85~7.94(m,2H);13CNMR(100 MHz,CDCl3),δ:170.71,163.05,138.90,131.15,130.10,129.30,129.08,129.04,129.03,127.48,126.93,126.54,123.12,97.49,21.56。以上数据与文献[36]报道一致。
5-(3-氯苯基)-3-苯基异噁唑(Ⅲe):收率88%;1HNMR(400 MHz,CDCl3),δ:3.75~3.99(d,J=1.5 Hz,3H),6.65~6.74(d,J=1.5 Hz,1H),6.95~7.05(m,2H),7.40~7.54(d,J=6.3 Hz,3H),7.74~7.93(m,4H);13CNMR(100 MHz,CDCl3),δ:169.00,163.18,135.20,130.48,130.32,130.30,129.10,129.08,128.93,126.92,125.99,124.01,98.40。以上数据与文献[36]报道一致。
5-(3-溴苯基)-3-苯基异噁唑(Ⅲf):收率93%;1HNMR(400 MHz,CDCl3),δ:6.83~6.88(s,1H),7.33~7.40(t,J=7.9 Hz,1H),7.44~7.54(m,3H),7.55~7.62(ddd,J=1.0 Hz、2.0 Hz、8.0 Hz,1H),7.75~7.82(dt,J=1.3 Hz、7.8 Hz,1H),7.83~7.92(m,2H),7.95~8.03(t,J=1.8 Hz,1H);13CNMR(100 MHz,CDCl3),δ:168.89,163.20,133.26,130.73,130.32,129.38,129.13,128.95,128.91,126.95,124.48,123.22,98.43。以上数据与文献[36]报道一致。
5-(4-叔丁基苯基)-3-苯基异噁唑(Ⅲg):收率82%;1HNMR(400 MHz,CDCl3),δ:1.27~1.29(s,1H),1.37~1.40(s,8H),6.77~6.85(s,1H),7.44~7.59(m,5H),7.77~7.85(m,2H),7.87~7.95(m,2H);13CNMR(100 MHz,CDCl3),δ:170.72,163.07,153.81,130.10,129.39,129.05,126.97,126.11,125.80,124.89,97.09,35.08,31.32。以上数据与文献[37]报道一致。
5-(4-硝基苯基)-3-苯基异噁唑(Ⅲh):收率81%;1HNMR(400 MHz,CDCl3),δ:6.98~7.06(s,1H),7.45~7.56(dd,J=2.0 Hz、5.1 Hz,3H),7.83~7.93(dd,J=3.0 Hz、6.6 Hz,2H),7.99~8.07(m,2H),8.32~8.43(m,2H);13CNMR(100 MHz,CDCl3),δ:167.97,163.51,148.65,132.97,130.59,129.24,128.59,126.99,126.74,124.60,100.27。以上数据与文献[38]报道一致。
5-(4-氟苯基)-3-苯基异噁唑(Ⅲi):收率84%;1HNMR(400 MHz,CDCl3),δ:6.76~6.81(s,1H),7.14~7.23(m,2H),7.43~7.53(m,3H),7.80~7.92(m,4H);13CNMR(100 MHz,CDCl3),δ:169.58,165.17,163.20,130.24,129.13,129.10,128.09,128.01,126.95,123.99,123.96,116.49,116.28,97.41。以上数据与文献[39]报道一致。
5-(4-甲氧基苯基)-3-苯基异噁唑(Ⅲj):收率85%;1HNMR(400 MHz,CDCl3),δ:7.86~7.83(m,4H),7.56~7.55(m,1H),7.49~7.45(m,4H),7.40~7.38(m,2H),7.15~7.13(m,1H),6.70(s,1H),2.47(s,3H);13CNMR(100 MHz,CDCl3),δ:170.53,163.08,161.28,130.06,129.43,129.03,127.58,126.95,120.46,114.56,96.27,55.55。以上数据与文献[40]报道一致。
5-(1-环己烯基)-3-苯基异噁唑(Ⅲk):收率86%;1HNMR(400 MHz,CDCl3),δ:1.64~1.82(m,4H),2.21~2.30(dh,J=2.9 Hz、6.1 Hz,2H),2.35~2.42(ddq,J=2.3 Hz、4.8 Hz、6.5 Hz,2H),6.36~6.40(s,1H),6.63~6.70(tt,J=1.7 Hz、3.8 Hz,1H),7.37~7.57(m,3H),7.77~7.89(m,2H);13CNMR(100 MHz,CDCl3),δ:171.67,162.48,130.27,129.86,129.51,128.92,126.81,125.42,96.25,25.49,25.27,22.16,21.78。以上数据与文献[41]报道一致。
5-丁基-3-苯基异噁唑(Ⅲl):收率83%;1HNMR(400 MHz,CDCl3),δ:0.93~1.00(t,J=7.4 Hz,3H),1.38~1.48(m,2H),1.70~1.77(m,2H),2.69~2.90(m,2H),6.27~6.30(d,J=0.9 Hz,1H),7.39~7.46(m,3H),7.76~7.84(m,2H);13CNMR(100 MHz,CDCl3),δ:174.38,162.42,129.87,129.53,129.14,129.06,128.97,128.94,126.84,98.87,29.69,26.60,22.30,13.81。以上数据与文献[42]报道一致。
5-(2-萘基)-3-苯基异噁唑(Ⅲm):收率88%;1HNMR(400 MHz,CDCl3),δ:6.91~6.98(s,1H),7.47~7.57(m,5H),7.84~7.99(m,6H),8.35~8.39(d,J=1.6 Hz,1H);13CNMR(100 MHz,CDCl3),δ:170.60,163.24,134.10,133.25,130.20,129.30,129.18,129.11,129.04,128.85,128.45,128.02,127.50,127.11,127.00,125.75,124.85,123.08,98.01。以上数据与文献[36]报道一致。
5-(2-噻吩基)-3-苯基异噁唑(Ⅲn):收率82%;1HNMR(400 MHz,CDCl3),δ:6.67~6.71(s,1H),7.09~7.16(dd,J=3.7 Hz、5.0 Hz,1H),7.41~7.53(m,5H),7.82~7.90(m,2H);13CNMR(100 MHz,CDCl3),δ:165.42,162.98,130.15,129.29,129.08,129.00,128.98,128.90,128.72,128.33,128.16,128.07,127.11,126.88,97.32。以上数据与文献[43]报道一致。
3-(邻甲苯基)-5-苯基异噁唑(Ⅳa):收率87%;1HNMR(400 MHz,CDCl3),δ:2.52~2.57(s,3H),6.68~6.73(s,1H),7.28~7.41(m,3H),7.44~7.61(m,4H),7.81~7.90(m,2H);13CNMR(100 MHz,CDCl3),δ:169.63,163.74,137.02,131.18,130.29,129.60,129.55,129.13,128.96,127.58,126.12,125.94,100.29,21.24。以上数据与文献[44]报道一致。
3-(2-溴苯基)-5-苯基异噁唑(Ⅳb):收率90%;1HNMR(400 MHz,CDCl3),δ:6.92~6.99(s,1H),7.30~7.36(m,1H),7.38~7.54(m,4H),7.67~7.78(dt,J=1.0 Hz、7.7 Hz,2H),7.82~7.90(m,2H);13CNMR(100 MHz,CDCl3),δ:169.67,163.06,133.72,131.43,131.11,130.62,130.35,129.11,127.74,127.47,125.96,122.37,100.97。以上数据与文献[30]报道一致。
3-(3-硝基苯基)-5-苯基异噁唑(Ⅳc):收率90%;1HNMR(400 MHz,CDCl3),δ:6.90~6.93(s,1H),7.43~7.56(m,3H),7.67~7.73(d,J=8.0 Hz,1H),7.82~7.90(m,2H),8.24~8.29(dt,J=1.3 Hz、7.8 Hz,1H),8.29~8.36(ddd,J=1.1 Hz、2.3 Hz、8.2 Hz,1H),8.64~8.71(t,J=2.0 Hz,1H);13CNMR(100 MHz,CDCl3),δ:171.60,161.28,148.83,132.65,131.12,130.81,130.78,130.24,129.30,127.16,126.08,124.77,121.99,97.42。以上数据与文献[45]报道一致。
3-(3-甲氧基苯基)-5-苯基异噁唑(Ⅳd):收率84%;1HNMR(400 MHz,CDCl3),δ:3.90~3.95(s,3H),6.99~7.10(m,3H),7.39~7.52(m,4H),7.82~7.90(m,2H),7.92~8.02(dd,J=1.8 Hz、7.7 Hz,1H);13CNMR(100 MHz,CDCl3),δ:169.31,160.71,157.34,131.29,129.97,129.56,128.99,127.90,125.85,121.02,118.13,111.57,101.16,55.68。以上数据与文献[46]报道一致。
3-(3-氯苯基)-5-苯基异噁唑(Ⅳe):收率89%;1HNMR(400 MHz,CDCl3),δ:6.79~6.83(s,1H),7.38~7.55(m,6H),7.74~7.79(dt,J=1.9 Hz、6.5 Hz,1H),7.80~7.89(m,3H);13CNMR(100 MHz,CDCl3),δ:170.91,161.99,135.06,130.98,130.53,130.36,130.16,129.18,127.33,127.05,125.97,125.03,97.48。以上数据与文献[48]报道一致。
3-(4-甲氧基苯基)-5-苯基异噁唑(Ⅳf):收率82%;1HNMR(400 MHz,CDCl3),δ:3.85~3.89(d,J=9.0 Hz,3H),6.76~6.80(s,1H),6.97~7.03(dd,J=2.5 Hz、9.1 Hz,2H),7.40~7.51(m,3H),7.79~7.87(m,4H);13CNMR(100 MHz,CDCl3),δ:170.26,162.70,161.12,134.11,132.12,130.27,129.11,128.32,127.67,125.94,114.44,97.38,55.49。以上数据与文献[36]报道一致。
3-(4-氯苯基)-5-苯基异噁唑(Ⅳg):收率85%;1HNMR(400 MHz,CDCl3),δ:6.78~6.82(s,1H),7.43~7.54(m,5H),7.77~7.88(m,4H);13CNMR(100 MHz,CDCl3),δ:170.86,162.15,136.19,130.52,129.36,129.20,128.22,127.76,127.41,125.99,97.43。以上数据与文献[36]报道一致。
3-丙基-5-苯基异噁唑(Ⅳh):收率76%;1HNMR(400 MHz,CDCl3),δ:0.97~1.04(t,J=7.4 Hz,3H),1.70~1.80(dt,J=7.5 Hz、15.0 Hz,2H),2.65~2.73(m,2H),6.35~6.39(s,1H),7.40~7.49(m,3H),7.72~7.82(m,2H);13CNMR(100 MHz,CDCl3),δ:169.60,164.66,130.05,129.15,129.02,127.79,125.86,99.23,28.18,21.81,13.88。以上数据与文献[48]报道一致。
3-(2-噻吩基)-5-苯基异噁唑(Ⅳi):收率79%;1HNMR(400 MHz,CDCl3),δ:6.74~6.77(s,1H),7.12~7.17(dd,J=3.6 Hz、5.1 Hz,1H),7.45~7.54(m,5H),7.81~7.85(m,2H);13CNMR(100 MHz,CDCl3),δ:170.51,158.30,131.01,130.51,129.20,129.16,127.81,127.73,127.51,127.34,126.02,97.63。以上数据与文献[43]报道一致。
3 结论
以CH2Cl2为溶剂,取代氯化肟和端位炔烃在碳酸铯作用下通过1,3-偶极环加成反应合成了一系列重要的3,5-二取代异噁唑类衍生物。该合成路线不仅具有原料易得、操作简单、普适性好、收率高等特点,而且在很大程度上降低了反应成本,优化和丰富了异噁唑类衍生物的合成方法。
