生防甲基营养型芽孢杆菌Hg18抗菌蛋白的分离纯化及性质研究
2021-06-29马银鹏孟利强胡基华阎更轩张淑梅
姜 威,马银鹏,陆 佳,孟利强,胡基华,阎更轩,田 缘,张淑梅*
(1.黑龙江省科学院微生物研究所,黑龙江 哈尔滨 150010;2.黑龙江省能源环境研究院,黑龙江 哈尔滨 150027)
芽孢杆菌(Bacillus)是人类较早发现的细菌之一,易于分离和纯化,种类多,分布广,是病害植物生物防治中的优势微生物种群[1]。芽孢杆菌在生长过程中产生次生代谢产物的能力较强,可以产生多种抗菌活性物质,如脂肽类、抗菌蛋白类和聚酮类等化合物[2]。甲基营养型芽孢杆菌(Bacillusmethylotrophicus)是芽孢杆菌属中的新种属,是由Madhaiyan等[3]于2010年率先从水稻的根际土壤中分离到的,其与枯草芽孢杆菌(Bacillussubtilis)、解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、地衣芽孢杆菌(Bacilluslicheniformis)的16S rRNA基因序列同源性为98.2%~99.2%[4],能利用非共价键低碳化合物[5],代谢产物丰富,具有对外界环境条件的抗逆性和无毒无害无污染等优势,近年来被广泛应用于商业、农业、医学等领域[6]。
随着分子生物学研究的不断深入,以甲基营养型芽孢杆菌抗菌蛋白基因为目的基因,构建抗病基因工程植株或生防工程菌株已成为研究热点。目前,已有部分生防芽孢杆菌次生代谢产物作为微生物源农药进行工业化生产,如低分子量多肽类抗生素类[7-9]和抗菌蛋白类[10-12]。生防细菌的生防机制主要包括诱导机制、拮抗机制和竞争机制等,在抗菌过程中产生抗菌蛋白类、脂肽类和聚酮类等抗菌活性物质[13],其中抗菌蛋白是生防细菌作为生防制剂和植物抗病基因改良的基础[14]。因此,对生防甲基营养型芽孢杆菌产抗菌蛋白特性的研究和纯化方法的摸索尤为重要。甲基营养型芽孢杆菌Hg18是从玉米根部周围的冻土中分离到的一株低温生防菌株,作者对其所产抗菌蛋白进行分离、纯化和分析,以揭示其抗菌活性,为其作为一种潜在的生防资源提供理论依据。
1 实验
1.1 材料
供试菌株:甲基营养型芽孢杆菌(Bacillusmethylotrophicus) Hg18,尖孢镰刀菌(Fusariumoxysporum)。
供试培养基:PDA培养基,LB培养基。
1.2 生防甲基营养型芽孢杆菌Hg18抗菌蛋白的分离纯化
1.2.1 抗菌粗蛋白的制备
将在LB固体培养基中活化好的Hg18菌株按2%接种量接种于LB液体培养基中,30 ℃、160 r·min-1振荡培养48 h;培养液于4 ℃、12 000 r·min-1离心20 min,取上清液6份,分别加入20%、30%、40%、50%、60%、80%的(NH4)2SO4饱和溶液;将混合液置于4 ℃冰箱中静置24 h,以析出蛋白沉淀;再于4 ℃、10 000 r·min-1离心20 min,弃上清液,沉淀用0.02 mmol·L-1(pH=8.0)的PBS缓冲液充分溶解,并用0.01 mmol·L-1(pH=7.0)的PBS缓冲液透析除盐24 h,期间每隔4 h换一次缓冲液;冷冻干燥,即得不同浓度(NH4)2SO4饱和溶液沉淀透析除盐的抗菌粗蛋白。
取上述不同浓度(NH4)2SO4饱和溶液沉淀透析除盐的抗菌粗蛋白,用0.01 mmol·L-1PBS缓冲液溶解,以尖孢镰刀菌为指示菌株,通过无菌发酵液抑菌活性实验测定抗菌粗蛋白的抑菌活性,以确定(NH4)2SO4饱和溶液的浓度。
1.2.2 抗菌蛋白的分离纯化
1.2.2.1 凝胶过滤层析
参照王彪等[15]方法,将50%(NH4)2SO4饱和溶液沉淀透析除盐的抗菌粗蛋白在100 ℃水浴中加热20 min,以去除杂蛋白;然后于12 000 r·min-1离心5 min;取上清液上样于Sephadex S-75分子筛层析柱,用50 mmol·L-1(pH=7.0~7.4)的PBS缓冲液洗脱,流速为0.5~1.0 mL·min-1;测定洗脱液在280 nm处吸光度,收集各峰洗脱液,经透析、浓缩、冻干后进行抑菌活性检测;对有抑菌活性的蛋白峰洗脱液进行变性聚丙烯酰胺凝胶电泳(SDS-PAGE)检测,判断是否需要进行离子交换层析进一步分离纯化。
1.2.2.2 离子交换层析
将凝胶过滤层析得到的冻干样品用20 mmol·L-1(pH=7.6)的Tris缓冲液溶解;上样于DEAE Sepharose Fast Flow层析柱,先用Tris缓冲液洗脱,再用0~1.0 mol·L-1NaCl溶液进行梯度不连续洗脱,流速为0.5~1.0 mL·min-1;测定洗脱液在280 nm处吸光度,收集各峰洗脱液,浓缩冻干后检测抑菌活性。
1.2.2.3 SDS-PAGE
将离子交换层析得到的有抑菌活性的蛋白峰洗脱液用超滤管过滤浓缩后进行SDS-PAGE检测。参照Laemmli等[16]方法,选择12%的分离胶和5%的浓缩胶,用考马斯亮蓝G250染色1 h后用脱色液在摇床上轻摇脱色,直至条带清晰、背景干净为止。
1.3 生防甲基营养型芽孢杆菌Hg18抗菌蛋白的性质研究
1.3.1 热稳定性实验
参照熊国如等[17]方法,采用牛津杯法检测抗菌蛋白的热稳定性。将5份抗菌蛋白分别溶于0.2 mol·L-1(pH=7.0)的PBS缓冲液中,其中4份分别在40 ℃、60 ℃、80 ℃、100 ℃下加热处理60 min,1份在121 ℃加热处理30 min;将100 μL尖孢镰刀菌菌液涂布于PDA固体培养平板上,牛津杯放置在平板上;取50 μL加热处理的抗菌蛋白加入到牛津杯中,将平板置于30 ℃恒温培养箱内培养24 h,观察抑菌效果。以未加热处理的抗菌蛋白作为空白对照。
1.3.2 酸碱稳定性实验
将10份抗菌蛋白分别溶于0.2 mol·L-1(pH=7.0)的PBS缓冲液中,每份8 mL,然后用1 mol·L-1HCl溶液和1 mol·L-1NaOH溶液将pH值分别调至3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0,终体积为10 mL;37 ℃水浴加热4 h后将pH值调至中性,采用平皿打孔法检测抗菌蛋白对尖孢镰刀菌的抑菌效果,每组实验重复3次。以自然pH值的抗菌蛋白作为空白对照。
1.3.3 紫外线稳定性实验
将7份抗菌蛋白分别溶于0.2 mol·L-1(pH=7.0)的PBS缓冲液中,于超净工作台上用紫外灯分别照射3 h、6 h、9 h、12 h、16 h、20 h、24 h,采用平皿打孔法检测抗菌蛋白对尖孢镰刀菌的抑菌效果,每组实验重复3次。以未经紫外灯照射的抗菌蛋白作为空白对照。
1.3.4 光稳定性实验
参照李忠等[18]方法,将7份抗菌蛋白分别溶于0.2 mol·L-1(pH=7.0)的PBS缓冲液中,取2 mL于培养皿中,置于40 W日光灯(距光源40 cm)下分别照射3 h、6 h、9 h、12 h、16 h、20 h、24 h,采用平皿打孔法检测抗菌蛋白对尖孢镰刀菌的抑菌效果,每组实验重复3次。以未经日光灯照射的抗菌蛋白作为空白对照。
2 结果与讨论
2.1 抗菌粗蛋白的抑菌活性
经不同浓度(NH4)2SO4饱和溶液沉淀透析除盐的抗菌粗蛋白的无菌发酵液抑菌活性实验结果如图1所示。

图1 经不同浓度(NH4)2SO4饱和溶液沉淀透析除盐的抗菌粗蛋白的抑菌活性
由图1可知,经20%、40%、50%、60%、80%(NH4)2SO4饱和溶液沉淀透析除盐的抗菌粗蛋白对尖孢镰刀菌均有很强的抑菌活性,而经30%(NH4)2SO4饱和溶液沉淀透析除盐的抗菌粗蛋白没有抑菌活性。
2.2 抗菌粗蛋白的分离纯化
通过50%(NH4)2SO4饱和溶液沉淀透析除盐后的抗菌粗蛋白经Sephadex S-75分子筛柱层析,共得到2个主吸收峰(图2);将2个吸收峰的洗脱液浓缩冻干后检测抑菌活性,发现峰1有抑菌活性,峰2没有抑菌活性(图3左);经SDS-PAGE检测,发现峰1显示单一条带(图3右),表观分子量约为25 kDa,说明抗菌蛋白获得了有效分离。

图2 抗菌粗蛋白Sephadex S-75分子筛柱层析纯化结果
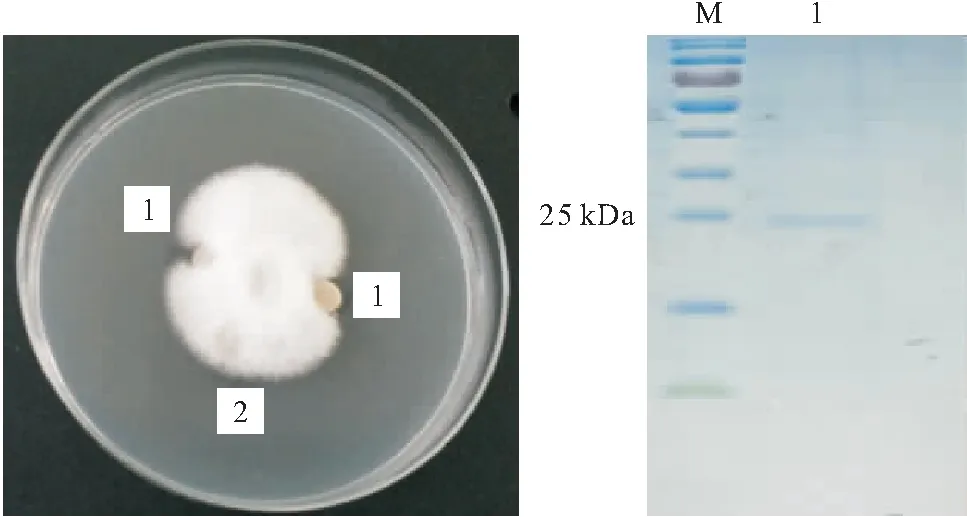
图3 峰1和峰2的抑菌效果(左)及峰1的SDS-PAGE图谱(右)
2.3 抗菌蛋白的性质
2.3.1 热稳定性
温度对抗菌蛋白抑菌率的影响如图4所示。
由图4可知,在100 ℃以下处理60 min,随着温度的升高,抗菌蛋白对尖孢镰刀菌的抑菌率与对照相比变化不明显;在121 ℃处理30 min,抑菌率较对照下降了24.4%。表明该抗菌蛋白对100 ℃以上的温度比较敏感。

图4 温度对抗菌蛋白抑菌率的影响
2.3.2 酸碱稳定性
pH值对抗菌蛋白抑菌率的影响如图5所示。
由图5可知,在pH值为3.0~10.0范围内,抗菌蛋白对尖孢镰刀菌的抑菌率与对照相比变化不明显;在pH值为11.0和12.0时,抑菌率较对照分别下降了18.6%和19.4%。表明该抗菌蛋白在中性和酸性环境中稳定,对强碱环境比较敏感。
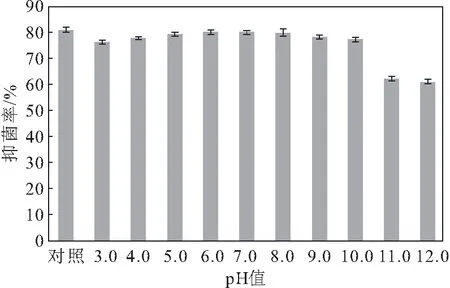
图5 pH值对抗菌蛋白抑菌率的影响
2.3.3 紫外线稳定性
抗菌蛋白经紫外线照射不同时间后,其对尖孢镰刀菌的抑菌率如图6所示。
由图6可知,经紫外线照射不同时间后,抗菌蛋白对尖孢镰刀菌的抑菌率与对照相比无显著变化,抑菌率为76.1%~79.2%。表明该抗菌蛋白对紫外线照射不敏感,具有较强的抗紫外线能力。

图6 紫外线照射时间对抗菌蛋白抑菌率的影响
2.3.4 光稳定性
抗菌蛋白经日光灯照射不同时间后,其对尖孢镰刀菌的抑菌率如图7所示。

图7 日光灯照射时间对抗菌蛋白抑菌率的影响
由图7可知,经日光灯照射不同时间后,抗菌蛋白对尖孢镰刀菌的抑菌率与对照相比无显著变化,抑菌率为77.3%~79.6%。表明该抗菌蛋白对日光灯照射不敏感,具有较强的光稳定性。
3 结论
通过50%(NH4)2SO4饱和溶液沉淀透析除盐,从生防甲基营养型芽孢杆菌Hg18中分离到抗菌粗蛋白,经凝胶过滤层析、离子交换层析、变性聚丙烯酰胺凝胶电泳纯化得到抗菌蛋白,该抗菌蛋白对尖孢镰刀菌有很强的抑菌活性,且抑菌活性具有较好的热稳定性、酸碱稳定性、紫外线稳定性和光稳定性,可以作为潜在的生防资源进行开发与应用。后续可基于该抗菌蛋白活性物质的代谢角度和基因层面进行深入系统研究,明确其作用机制。
