肠道菌群失调加剧变应性鼻炎小鼠肺部炎症机理研究
2021-06-28李一圣段飞鹏潘鑫权邱书奇
冯 月,李一圣,段飞鹏,马 芳,潘鑫权,邱书奇
(1.遵义医科大学 珠海校区,广东 珠海 519041;2.深圳市耳鼻咽喉研究所/深圳市龙岗区耳鼻咽喉医院,广东 深圳 518172)
变应性鼻炎(Allergic rhinitis,AR)是由IgE介导的鼻黏膜非感染性慢性炎性疾病,病情顽固,极易复发,严重影响了患者的日常工作和生活[1]。既往研究认为辅助性T细胞(T helper,Th)Th1/Th2的失衡在AR的发病过程中发挥重要作用,Th2的优势表达是引起Th1/Th2失衡的重要因素[2],同时,调节性T细胞(Regulatory T cell,Treg)也被证明可以有效抑制过量的Th2反应来影响AR的发生[3]。此外,卫生学假说认为AR的发病同儿童时期生活卫生水平及感染有关,儿童时期生活卫生水平越高、感染越少,其生长后期患AR的几率越大,其所对应的肠道菌群多样性越低[4]。目前的证据表明肠道菌群定殖在早期促进和维持免疫平衡中发挥重要的作用[5-6]。肠道菌群失调主要表现为肠道菌群多样性的降低,而多样性降低会导致体内免疫失衡,从而引起一系列的病理变化。在引起菌群失调的众多因素中,抗生素的滥用被认为与过敏性疾病(变应性鼻炎、过敏性哮喘)的发生和发展密切相关[7]。尽管抗生素在医疗保健方面扮演重要角色,但其产生的潜在副作用已然成为日益严重的公共健康问题。
随着研究的深入,大量临床研究表明,肠道菌群多样性同AR的发病呈负相关,而抗生素的滥用致使肠道菌群多样性受到了严重的抑制,这也是近几十年来过敏性疾病发病率迅速增长的重要原因之一[8]。目前,上气道和下气道被认为是一个形态和功能实体,并且有强有力的流行病学、病理生理学和临床证据支持鼻炎和哮喘属同一气道疾病的综合观点,因而肺和鼻在疾病的发生和发展过程中是相互影响的,尤其是在过敏性疾病中[9]。本文假想肠道菌群失调将进一步加剧AR小鼠肺部Th1/Th2失衡,加重AR小鼠症状,故以肺部Th1/Th2平衡为切入点,探讨抗生素干预后肠道菌群失调对AR小鼠肺部Th1/Th2平衡的影响,并初步明确其作用机理。
1 材料与方法
1.1 实验动物 SPF级3周龄雌性BALB/c小鼠21只,体重 (16±2) g,购自广东省医学实验动物中心,实验动物许可证号:SCXK(粤)2018-0002,适应性饲养1周后,开始实验。
1.2 主要试剂与仪器 头孢克肟分散片(广州白云山医药集团股份有限公司,批号:2190022);甲硝唑片(广东华南药业集团有限公司,批号:190903);羧甲基纤维素钠(上海麦克林公司,批号:C10599873);鸡卵清蛋白(OVA,美国Sigma公司,批号:SLBV6597);氢氧化铝凝胶(德国SERVA公司,批号:190457);小鼠OVA-sIgE、Mouse Th1/Th2 ELISA试剂盒(美国Invitrogen公司,批号分别为B314400、219179-004);GATA 3一抗、T-bet一抗(Abcam公司,批号分别为ab106625、ab91109);甘油醛-3-磷酸脱氢酶一抗(GAPDH)(CST公司,批号:5174s);辣根过氧化物酶(HRP)标记二抗、BCA蛋白浓度测定试剂盒、ECL化学发光检测试剂盒、RIPA裂解液、苏木素-伊红(HE)染色试剂盒(中国上海碧云天生物技术有限公司,批号分别为A0216、P0010、P0013B、P0018s、C0105S);小鼠淋巴细胞分离液(深圳市达科为生物工程有限公司,批号:RLS1904);Alexa Fluor®488 anti-mouse CD4抗体、Anti-Mouse CD25抗体PE 、Anti-Mo/Rt Foxp3抗体(美国Invitrogen公司,批号分别为B256618、2161980、2176028);SpectraMax®Paradigm®Multi-mode detection platform型多功能酶标仪(美国Molecular Devices公司);ECLPSE Ci-L型正置显微镜(日本Nikon公司);5424R型冷冻离心机(德国Eppendorf公司);PPDB-21C型石蜡包埋机(中国湖北襄樊徕克生物电子仪器厂);RM2235型石蜡切片机(德国Leica公司);ChemiDocTM.MP Imaging System图像处理系统(美国Bio-Rad公司);FACScan流式细胞分选仪(美国BD Pharmingen公司)。
1.3 实验方法
1.3.1 抗生素暴露及菌群多样性分析 将21只小鼠随机分为3组,正常组(Control)、变应性鼻炎组(Allergic rhinitis,AR)、变应性鼻炎+抗生素组(AR+antibiotic)。将AR+antibiotic组给与抗生素(500 mg 头孢克肟,5 g 甲硝唑溶液溶于 100 mL 0.5% 羧甲基纤维素钠溶液中)灌胃0.2 mL,每天1次;Control组和AR组使用0.5% 羧甲基纤维素钠溶液灌胃0.2 mL,每天1次。饲养2周后,收集6只Control组和6只AR+antibiotic组小鼠粪便,本研究使用的DNA样品采用QIAamp®DNA粪便分离纯化试剂盒(Omega Bio-tek,Norcross,- 10 -GA,U.S.)进行分离纯化,方案按照试剂盒说明书执行。使用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5'-GGACTACHVGGGTWTCTAAT -3’) 对16S rRNA基因 V3-V4 区进行 PCR 扩增。将同一样本的 PCR 产物混合后使用 2% 琼脂糖凝胶回收 PCR 产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA) 进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用QuantusTMFluorometer(Promega,USA) 对回收产物进行检测、定量。使用 NEXTFLEX Rapid DNA-Seq Kit 进行建库。利用Illumina公司的 MiseqPE300 平台进行测序。上传测序数据至上海美吉生物云平台,经序列拼接注释后进行菌群多样性分析。
1.3.2 变应性鼻炎模型构建 AR组及AR+antibiotic组使用卵清蛋白(Ovalbumin,OVA)致敏,取100 μg卵清蛋白,溶于0.2 mL 氢氧化铝凝胶,分别于第0、7、14天进行腹腔注射,第15天至42天每周OVA溶液(300 μg OVA溶于20 μL生理盐水中,每个鼻孔滴10 μL)滴鼻3次,连续激发4周。Control组采用等体积生理盐水滴鼻[10]。
1.3.3 行为学评分 末次滴鼻30 min后观察小鼠挠鼻、喷嚏症状,若总分大于5分,则表明模型构建成功。评分标准:抓鼻次数:1分(0~5次)、2分(6~9次)、3分(大于9次);喷嚏次数:1分(1~3次)、2分(4~9次)、3分(大于9次);流鼻涕:1分(流涕至前鼻孔)、2分(流涕至鼻孔外)、3分(流涕满面)[11]。
1.3.4 脾细胞提取及流式细胞术分析 末次给药1 h后,处死小鼠,按照小鼠淋巴细胞分离液说明书的操作步骤制备脾脏单核细胞,将收集到的脾细胞用1 640培养基重悬,计数,取106个细胞加入1.5 mL离心管,300 g离心5 min,移除上清液,依据参考文献[12]进行操作,最后使用200 μL PBS重悬细胞,进流式分析。
1.3.5 组织病理学分析 处死小鼠后,取小鼠完整鼻腔和肺中叶,于4%多聚甲醛中固定24 h,制成石蜡切片,HE染色,光学显微镜下检查,观察各组小鼠鼻黏膜肿胀及炎性细胞浸润情况。
1.3.6 血清OVA-sIgE及肺泡灌洗液细胞因子检测 末次激发24 h后,摘眼球取血,室温静置1 h后,3 000 r/min离心10 min,收集上层血清。Elisa试剂盒检测血清中OVA-sIgE浓度,具体步骤参考试剂盒说明书。剪开小鼠颈部肌肉,暴露气管,于气管处剪一小口,插入采血针(针头磨平),将注射器连接采血针,缓慢注入1 mL PBS至肺部,缓慢吸出,反复3次,3 000 r/min离心10 min,吸取上清。Elisa试剂盒检测IL-2、IL-4、IL-5、IL-10、IFN-γ含量,具体步骤参考试剂盒说明书。
1.3.7 Western blot 检测肺部T-bet及Gata3表达 取肺组织,用组织蛋白裂解液(含1% PMSF)匀浆,4 ℃裂解30 min,每5 min涡旋30 s,10 000 g离心10 min。使用 BCA检测试剂盒检测各组蛋白浓度。等数量的提取蛋白样品(20 μg)用10% SDS-PAGE(十二烷基硫酸钠聚丙烯酰胺凝胶电泳)分离,并转移到PVDF膜上。用5% BSA封闭膜1 h,加入一抗并在4 ℃条件下孵育过夜(T-bet,1∶500; GATA3,1∶1 000); TBST洗涤5次,每次3 min; 加入HRP标记兔二抗;采用ECL快速发光试剂盒,对PVDF膜进行显影,image J软件计算各条带灰度值。

2 结果
2.1 小鼠行为学评分 结果如图1所示,AR组及AR+antibiotic组评分均大于5分,表明建模成功。同Control组相比,AR组及AR+antibiotic组挠鼻及打喷嚏次数明显增多,流涕明显,具有统计学意义(P<0.001)。同AR组相比AR+antibiotic组挠鼻及打喷嚏次数明显增多,流涕明显,具有统计学意义(P<0.001)。

###:与Control组相比,P<0.001;***:与AR组相比,P<0.001。
2.2 小鼠粪便菌群多样性分析 Alpha多样性是指一个特定区域或者生态系统内的多样性,通过观察各种指数值进而得到物种的多样性等信息,通过比较Control组和抗生素干预组菌群多样性,由图2 shannon指数可知,抗生素干预后,出现肠道菌群失调,菌群多样性受到明显抑制,shannon指数显著降低。通过比较抗生素干预组以及Control组菌群数量,发现抗生素干预两周后种水平菌群数量由178种急剧下降至31种(见图3),表明抗生素干预后肠道菌群种类明显下降,菌群多样性降低。

图2 Shannon指数分析菌群多样性

图3 种水平物种组成比较分析菌群多样性
2.3 小鼠脾脏流式细胞术分析 结果如图4所示,与Control组相比,AR组小鼠脾淋巴细胞中CD4+CD25+Foxp3+Treg/CD4+T 细胞比列明显减少(P<0.01),AR+antibiotic组下降更明显(P<0.001),而AR+antibiotic组与AR组相比出现进一步下降,具有统计学意义(P<0.001)。

###:与Control组相比,P<0.001,##:P<0.01;***:与AR组相比,P<0.001。
2.4 小鼠组织病理学分析 小鼠鼻黏膜病理切片HE染色结果表明,Control组鼻黏膜较完整,有轻微的肿胀。相比Control组,AR组与AR+antibiotic组鼻黏膜明显增厚,组织间质水肿,毛细血管扩张,腺体增生,相比AR组,AR+antibiotic组炎症改变更明显(见图5)。小鼠肺部病理切片HE染色结果表明,Control组肺部气管上皮细胞排列整齐完整,肺细胞无明显炎性浸润,AR组与AR+antibiotic组有明显淋巴细胞聚集,气管上皮细胞排列不整齐,有部分脱落,气管内黏液分泌增多,相比AR组,AR+antibiotic组可见更严重的炎性浸润(见图5)。

A、B、C为鼻组织;A:Control,B:AR,C:AR+antibiotic;D、E、F为肺中叶:D;Control,E:AR,F:AR+antibiotic;放大倍数:200×。
2.5 小鼠血清OVA-sIgE及肺泡灌洗液细胞因子检测 炎性因子检测结果如图6所示,与Control组相比,AR及AR+antibiotic组血清中OVA-sIgE水平均显著升高(P<0.01),且AR+antibiotic组显著高于AR组(P<0.01),表明抗生素干预能够明显升高血清中OVA-sIgE水平;肺泡灌洗液中IL-4、IL-5及IL-2、IL-10、IFN-γ浓度表明,与Control组相比,AR组和AR+antibiotic组IL-4、IL-5水平均有显著增加(P<0.001),IL-2明显下降(P<0.001),IL-10也显著降低(AR组:P<0.01,AR+antibiotic组:P<0.001),AR组IFN-γ结果虽无统计学意义,但也有所降低,AR+antibiotic组则进一步下降(P<0.001)。与AR组相比,抗生素干预后IL-4水平进一步上升(P<0.001),IFN-γ分泌受到显著抑制(P<0.001),IL-2、IL-10的降低也具有统计学意义(IL-2:P<0.05,IL-10:P<0.001)。表明抗生素干预进一步影响了肺组织中IL-2、IL-4、IL-5、IL-10、IFN-γ细胞因子的分泌,导致变应性鼻炎模型小鼠肺部炎症明显加重。
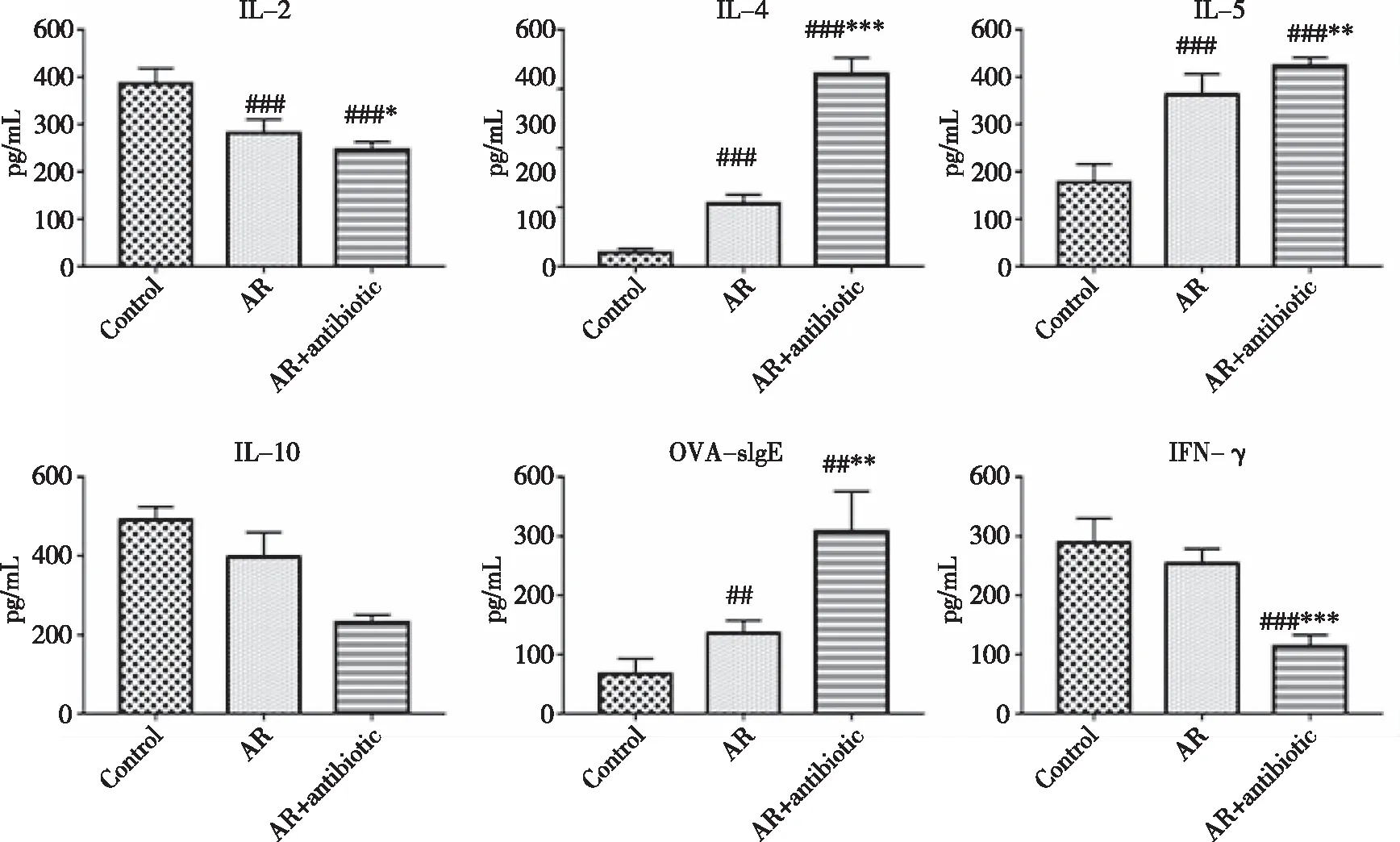
###:与Control组相比,P<0.001,##:P<0.01;***:与AR组相比,P<0.001,**:P<0.01,*:P<0.05。
2.6 小鼠肺组织中T-bet及Gata3蛋白表达 肺组织中T-bet及Gata3蛋白表达结果如图7所示,相对于Control组,AR组及AR+antibiotic组肺部Gata3表达增强(P< 0.001),T-bet表达减弱(AR组:P<0.01,AR+antibiotic组:P<0.001),抗生素干预后的AR+antibiotic组相比AR组,T-bet表达进一步减弱(P< 0.01),Gata3表达进一步增强(P<0.001),均具有统计学差异。表明抗生素干预对AR模型引起的T-bet表达下降及Gata3表达上升均有促进作用。
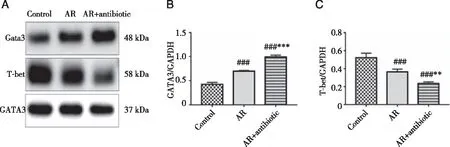
A:Western Blot电泳结果;B:肺组织GATA3蛋白表达水平;C:肺组织T-bet蛋白表达水平;###:与Control组相比,P<0.001,##:P<0.01;***:与AR组相比,P<0.001,**:P<0.01。
3 讨论
肠道菌群包括生活在机体肠道内的所有微生物(细菌、真菌、原生动物和病毒),其组成变化被证明是诱发机体异常组织功能和疾病的重要危险因素,而滥用抗生素引起的肠道菌群失调被认为与过敏性疾病密切相关。AR作为最常见的过敏性疾病之一,以Th2极化为主要特征,包括Th2细胞及其产生的Th2类细胞因子的增加,同时Th1细胞及其产生的Th1类细胞因子减少,致使Th1/Th2平衡向Th2方向移动。Th2型免疫反应的增强在AR的发病中发挥至关重要的作用。GATA3密切影响着Th2细胞的分化以及Th2特征性因子IL-4、IL-5的释放[13],而T-bet则与Th1细胞以及Th1特征性细胞因子IFN-γ的表达关系匪浅[14]。此外,有研究表明,Treg细胞及其特征性细胞因子(IL-2、IL-10)也可以有效控制过敏反应,引起Th2型细胞因子的表达水平降低[15]。
有研究使用万古霉素持续作用于OVA诱导的哮喘小鼠模型中,发现模型小鼠的过敏反应因肠道菌群失调而明显加重[16]。为初步探究抗生素引起的肠道菌群失调对AR的影响机制,本研究采用头孢克肟和甲硝唑联合高剂量给药幼龄小鼠(4周龄)构建肠道菌群失调模型,并在其成年后(6周龄)构建OVA诱导的过敏性鼻炎小鼠模型,结果显示经抗生素干预的小鼠出现肠道菌群失调,表现为肠道菌群多样性显著降低,其过敏症状对比未干预小鼠明显加重,表明肠道菌群失调可加重AR过敏症状。流式结果显示AR组和AR+antibiotic组CD4+CD25+Foxp3+Treg/CD4+T细胞比例显著降低,尤以AR+antibiotic组降低最明显,说明肠道菌群失调可以通过进一步抑制Treg细胞,增强Th2型反应,加重Th1/Th2失衡。同时,小鼠血清OVA-sIgE,肺泡灌洗液IFN-γ、IL-2、IL-4、IL-5、IL-10的检测结果以及肺、鼻部组织HE染色结果进一步表明抗生素干预能够加重AR小鼠过敏反应及其肺、鼻部炎症。据报道,早期肠道菌群失调的婴儿在成年后更容易患AR[17],但对应的分子机制尚不明确。鉴于肺与鼻的气道互通原理,本研究通过检测各组小鼠肺组织中T-bet及Gata3蛋白表达情况,发现与AR组相比,该两种蛋白表达水平在AR+antibiotic组小鼠均出现进一步变化。因此,笔者认为抗生素引起的肠道菌群失调会使小鼠成年后产生更严重的AR过敏症状,其作用机制可能是通过进一步抑制肺部T-bet蛋白表达,促进Gata3蛋白表达来实现的。
西医认为鼻和肺分别在上、下呼吸道,属于同一气道,二者是相互关联的,因而也提出了“一个呼吸道,一种疾病”的观点[18]。中医认为肺开窍于鼻,肺有病则鼻为之不利,有通过治肺而治鼻的传统疗法[19]。故而肺部病变对鼻部病变有着重要的作用,抑制Th2型免疫反应,不仅可以改善肺部炎症,也对鼻部炎症具有缓解作用[20]。因此,本研究以AR小鼠肺部机制为切入点,探讨肠道菌群失调对AR小鼠肺部炎症的影响及初步作用机理。结果提示肠道菌群失调可能通过抑制肺部T-bet蛋白表达,促进Gata3蛋白表达来调控Th1/Th2平衡向Th2方向移动,加剧肺部炎症反应,影响宿主免疫系统的应答,从而加剧鼻部过敏症状。但具体发挥调节作用的肠道菌群种类及其作用机制仍有待进一步探究,后续将筛选出相关性最高的肠道菌群种类进行体外细胞实验完善机制研究。
综上所述,口服抗生素引起的肠道菌群失调对变应性鼻炎小鼠的发病和炎症发展具有重要影响。因此,抗生素在临床上的使用应该做到剂量把控,对症使用,合理合情。
