小鼠肾小管组织中水通道蛋白1、7的动态表达和意义
2021-06-28薄双玲马太芳阎丽菁
薄双玲,马太芳,田 鹤,阎丽菁
(1.山西医科大学 汾阳学院组织学与胚胎学教研室,山西 汾阳 032200;2.锦州医科大学 组织学与胚胎学教研室,辽宁 锦州 121001)
水通道蛋白(Aquaporins,AQPs)是一类高选择性的跨膜蛋白家族,它可以转运水和一些低分子溶质,迄今为止,在哺乳动物体内已经发现有13种AQPs(AQP0-AQP12),根据渗透特性和氨基酸序列同源性可分为3个亚类:传统的水通道、水甘油通道、超水通道[1-2]。AQP1和AQP7分别隶属于前两类,且均表达在肾脏、男性生殖系统等器官[3-5]。
近年来,在肾脏关于AQP1和AQP7基因敲除的研究很多[6-7],但是由于水通道蛋白的选择性抑制剂及效应器知之甚少[8],其在肾脏的病理、生理作用仍没有被完全阐明,尤其是它们与肾小管发生发育之间的关系鲜有报道。为探究AQP1和AQP7与肾小管发育及功能形成之间的关系,本研究采用免疫组织化学结合体视学方法,蛋白印迹法检测肾小管发育过程中AQP1和AQP7的时空表达和含量变化,为研究和治疗肾脏相关性疾病提供实验依据。
1 材料与方法
1.1 实验动物 健康育龄雌性昆明系小鼠44只,雄性小鼠15只,体重25±2 g(购于山西医科大学实验动物中心)。按雌雄1∶1合笼交配,培育孕鼠,观察到阴道栓为胚龄(Embryonic days,E)0 d。孕鼠分笼饲养后,观察子代出生情况,最早时间计为产后 (Postnatal,P)0 d。将受孕小鼠随机分为11组(胚龄12、14、17、18 d及产后1、3、7、14、24、40、70 d),每组4只,孕鼠每只取子代2只,共88只。
1.2 主要试剂 兔抗小鼠AQP1、AQP7多克隆抗体(Santa);PV兔试剂盒、SABC兔试剂盒、DAB显色试剂盒(中杉金桥生物技术有限公司);免疫印迹试剂:膜蛋白提取试剂盒、聚偏二氟乙烯膜、胎牛血清、SDS等由Sigma公司提供。
1.3 肾脏标本制备 腹腔注射100 g/L水合氯醛麻醉孕鼠后,经剖腹术取出胎鼠,全胚固定E12 d胎鼠,E14、17、18 d胎鼠仅取左肾固定。出生后仔鼠断头或脱臼处死,取左肾,沿横轴将肾切成约3 mm薄片,用40 g/L多聚甲醛固定后,乙醇脱水,香柏油透明,定向包埋,制成5 μm厚连续切片。右肾均迅速冷冻并保存在-80 ℃,供蛋白印迹使用。
1.4 免疫组织化学染色 石蜡切片常规脱蜡复水后,用枸橼酸盐缓冲液(pH6.0)微波修复,自然冷却至室温;30 mL/L H2O2孵育10 min,清除内源性过氧化物酶;血清封闭20 min,封闭非特异性反应部位;滴加AQP1或AQP7一抗(按1∶200稀释) 4 ℃过夜,AQP1用PV试剂盒,AQP7用SABC试剂盒,DAB显色5~10 min。常规脱水后透明,封片后光镜观察取图,用PBS代替一抗作为阴性对照。
1.5 体视学测量 所有组织标本等间隔选取5张切片,每张切片油镜下随机选取5个不重复的肾小管集聚视野,方格系统结合交点计数法,计算阳性表达在肾小管游离面和侧基底面的面密度值,Sv(面密度值)= 2Ix/Lc(Lc=ΣPc ·a)[9],其中Ix代表细胞膜的阳性表达与方格系统的交点数,Pc代表方格系统在肾小管(即参照系)的点数,a=0.1 mm,为方格系统两点间距离。
1.6 蛋白印迹 分别取胚龄14、17 d和生后日龄1、3、7、14、24、70 d八组冷冻待用的右肾,称重剪碎后,冰浴中用膜蛋白提取试剂匀浆,离心后收集上清液,考马斯亮蓝检测蛋白质浓度。每种样品抽取20 μg蛋白上样,将目标蛋白湿转到聚偏二氟乙烯膜上,用100 g/L脱脂奶粉封闭,加入AQP1、AQP7抗体(按1∶200稀释),并在4 ℃冰箱中孵育过夜,用碱性磷酸酶标记二抗(按1∶600稀释)摇床室温孵育1.5 h,ECL显色,测定光密度值用Fluorchem V2.0系统,以目的蛋白与β-actin的比值作为A值。

2 结果
2.1 免疫组织化学染色 AQP1和AQP7的阳性表达均开始于E14 d,此时肾髓质部位出现分化早期和发育期肾小管,部分肾小管中可见AQP1和(或)AQP7的阳性表达。E17 d胎鼠肾从浅层到深部出现了区域性分布的、不同发育时期的肾小管,可见髓放线,AQP1表达在髓旁肾单位部分成熟肾小管管腔膜和侧基底膜,浅表肾单位肾小管管腔膜不明显,阳性表达主要弥散于胞质中(见图1B);而AQP7仅表达于髓旁肾单位成熟肾小管管腔膜,且表达微弱(见图1b)。P3 d肾脏发育可见肾乳头和大量髓放线,AQP1在肾乳头、髓放线和皮质中均可见较强阳性表达(见图1C);而AQP7仅表达在髓放线远处近端小管管腔侧(见图1c)。P7 d后,生肾区消失,肾单位达到成体数量,AQP1在肾脏大量表达,主要定位于近端小管,髓袢降支细段以及直小血管降支(见图1D、1E、1F);AQP7在P7 d时主要定位于近直小管刷状缘(见图1d),直到P14 d,AQP7的阳性表达才明显增强,主要集中在肾脏的皮质以及髓质外带外区的近直小管,髓质未见表达(见图1e、1f)。P24 d至P70 d,髓质区分出内带和外带,皮质明显增厚,AQP1和AQP7在近端小管均有表达,但AQP1范围更广。
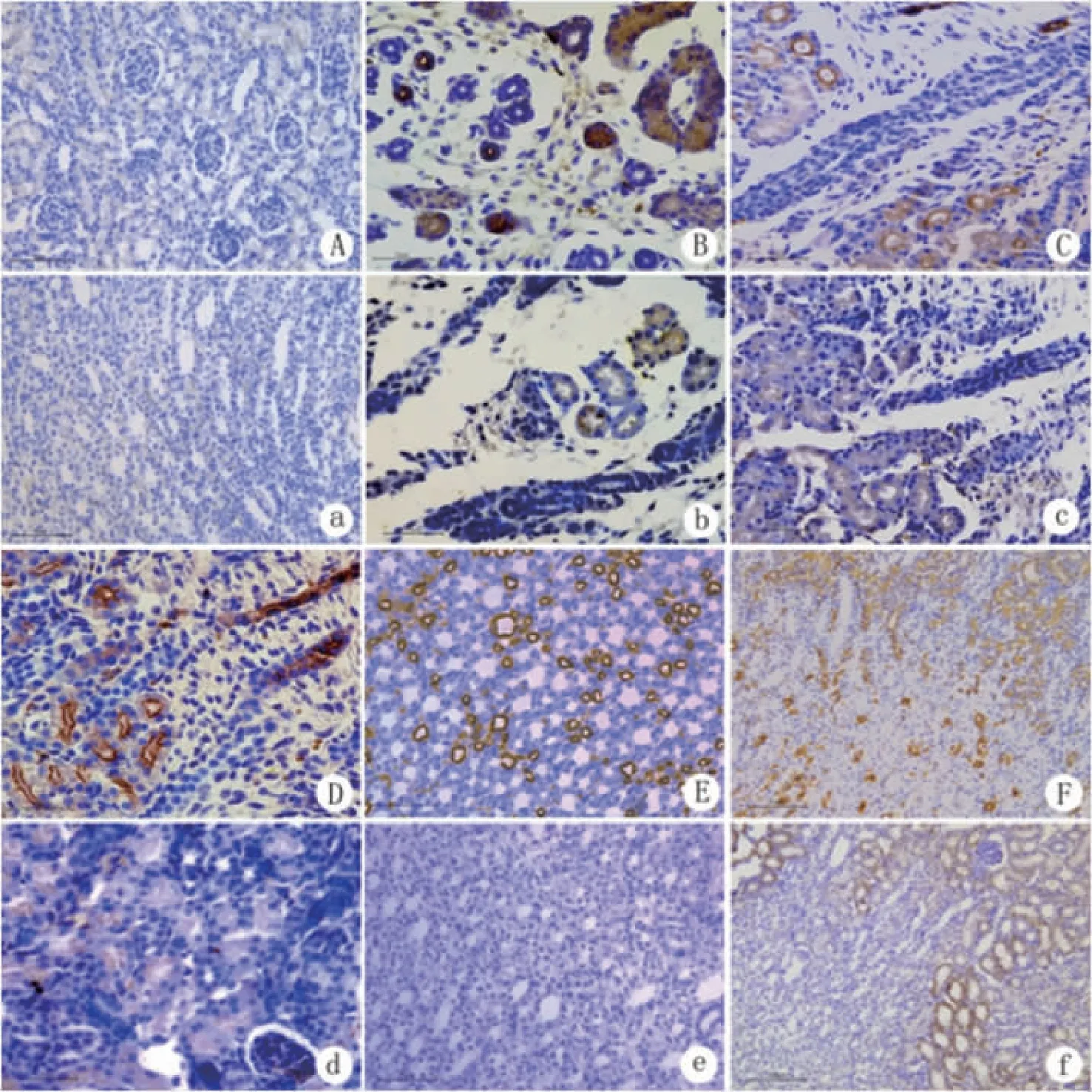
Aa:阴性对照,×400;Bb:E17 d,×400;Cc:P3 d,×400;Dd:P7 d,×400;Ee:P14 d,×400;Ff:P14 d,×200(ABCDEF:AQP1;abcdef:AQP7)。
2.2 体视学测量 随着肾脏的发生发育,从E14 d到P70 d,AQP1和AQP7在肾小管的表达的面密度值开始均为逐渐递增,于P24 d达到顶峰后趋于稳定。其中AQP1的面密度值增加明显,远高于AQP7,AQP7的值在P7 d才显著升高。经统计学分析,*表示与前一组数值比较有显著性差异(P<0.05,见图2)。
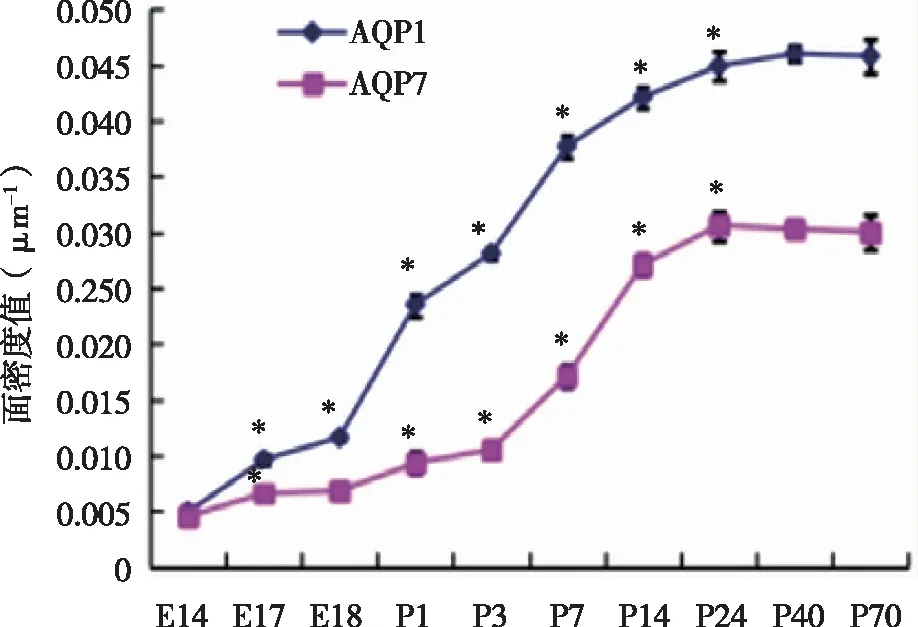
*:与前一组比,P<0.05,n=200。
2.3 蛋白印迹法测定 蛋白印迹条带以β-actin的吸光度值作为内参照,进行半定量分析,结果显示随着小鼠肾脏发育,AQP1和AQP7的光密度值逐渐增加,AQP1增加迅速,P7 d达到峰值后趋于稳定;AQP7仅在P7 d才显著增加,并在P24 d达到峰值后趋于平缓。统计学分析表明,组间差异具有统计学意义(P<0.05,见图3)。
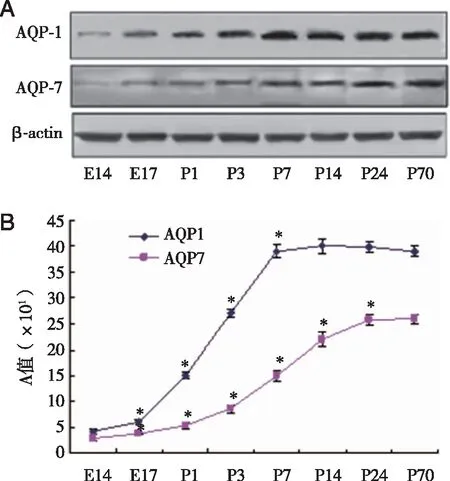
*:与前一组比,P<0.05,n=8。 A:蛋白印迹条带;B:AQP1 、AQP7在小鼠肾组织的A值变化。
3 讨论
在人肾脏中有9种AQPs[10],它们表达在肾脏不同的部位和细胞,以维持正常的尿液浓度、组织发育和物质代谢[1],其中参与维持水平衡的有AQP1、2、3、4和7五种[11]。本课题组先前的研究已证实AQP2、AQP3和AQP4均表达在集合管的主细胞,AQP2、AQP3是调节肾脏集合管水平衡的主要水通道蛋白,而AQP4对集合管水平衡的维持起辅助作用。那么,AQP1和AQP7共同表达于近端小管[12],在近端小管的发育过程中,二者如何分布,行使怎样的功能?国内外未见相关研究。
后肾起源于输尿管芽和生后肾组织,生后肾组织发育为肾小体和肾小管,其中肾小管的发育又经历了分化早期、发育期和成熟期三个阶段。为探讨AQP1、AQP7与肾小管发育之间的关系,在本研究中,利用免疫组织化学技术结合体视学方法,蛋白印迹法检测这两种蛋白在小鼠肾小管发育中的表达和含量变化。研究结果表明,在E12 d未见AQP1和AQP7表达,提示二者并没有参与输尿管芽与生后肾组织的相互诱导和分支过程。E14 d,胎肾能产生极少量的尿液,AQP1和AQP7的阳性表达与之功能相适应,即肾小管在分化早期已具备一定的通透功能。从E17 d开始,AQP1的表达范围和表达量均远超过AQP7,这表明AQP1在肾发育早期,对水的通透起了关键作用,尤其是P7 d之后,大量表达在髓袢降支细段和直小血管袢,参与了逆流倍增机制的形成。近端小管只有发育到成熟期,才形成刷状缘,AQP7定位在近直小管刷状缘,故在发育早期表达微弱。体视学结果显示肾小管AQP1和AQP7表达的面密度值持续增加,于P24 d后均趋于平稳,说明在肾小管生长发育过程中AQP1、AQP7几乎同时达到功能上的成熟。
在肾小管发育过程中,免疫印迹结果显示,AQP1的表达在P7 d时就达到最大,结合体视学结果,我们推断,这是由于从P7 d到P24 d,发育肾小管中的AQP1逐渐从细胞质表达到管腔膜和侧基底膜,进一步说明AQP1存在通过改变细胞膜上的含量来调节跨膜水流动的途径。
AQP1、AQP7共同表达在成熟期近端小管的顶膜,近端小管顶膜对水的重吸收主要是哪种水通道蛋白的作用?Sohara等[7]通过基因敲除小鼠的研究,进一步证实了它们在肾脏中的生理作用,在近端小管重吸收水中,AQP1起主导作用,而AQP7仅占到AQP1的八分之一,且能被代偿。值得注意的是,AQP7不仅允许水通过,而且允许甘油、尿素、氨等小分子溶质通过[13-14],AQP7在近直小管存在新的甘油重吸收途径,如果表达缺陷,则引起肥胖、胰岛素抵抗等代谢紊乱[1]。AQP7的表达有可能是由甘油代谢控制,而非体内的水分条件。由此可见,在近端小管,AQP1的作用主要是对水的重吸收,而AQP7则对甘油的重吸收影响更大。
综上所述,AQP1和AQP7在肾小管发育过程中的分布,均呈现一定的时间和空间性,这与在不同胚(日)龄肾小管的发育情况、重吸收水和甘油的能力、以及机体产生水和甘油的量密切相关。此外,研究表明,AQP1还能影响到肾近端小管细胞的迁移、血管生成等,与肾脏肿瘤性疾病密切相关[15]。AQP7作为一个成孔的跨膜蛋白,转运尿素与肾髓质尿素梯度的形成和(或)维持有一定的关系。最近研究证实[10],AQP1的表达受到核受体转录因子肝X受体β(LXRβ)的调节,其调节和AQP7的表达是否存在关联?在一些病理情况下,AQP1、AQP7表达的改变,能否作为标记物,反映肾脏功能水平?这将有待于我们进一步研究。
