LncRNA H19对结肠癌细胞的影响及其作用机制
2021-06-28黄春艳
于 鑫,丁 晨,林 晓,朱 伟,黄春艳
(牡丹江医学院免疫教研室,黑龙江 牡丹江 157011 )
LncRNA H19、HT-29、Proliferation、Apoptosis结肠癌是常见消化系统的恶性肿瘤,其早期发现治愈率较高,但是由于早期缺乏特异性症状,导致大部分结肠癌患者确诊时已是晚期,死亡率增加[1]。所以,临床上迫切需要找到敏感度和特异度高的早期诊断指标。近年来,LncRNA因固有性质和易于获取等特性,可能成为理想的早期诊断指标。LncRNA H19是不编码蛋白的长链RNA,其在结肠癌患者中发现过表达,并促进肿瘤细胞增殖[2],但是在结肠癌中的作用机制有待进一步研究,因此,本研究利用HT-29细胞作为研究对象,通过外源性降低LncRNA H19表达水平,观察细胞增殖和凋亡情况并对其机制进行探讨。
1 材料与方法
1.1 细胞培养和处理结肠癌细胞株HT-29购于上海细胞培养研究所,培养于含10%胎牛血清RPMI-1640培养基(美国Gibco公司)中,置于37 ℃、5% CO2的恒温培养箱中。取对数期细胞接种6孔板,按照脂质体LipofactamineTM2000试剂盒(美国Invitrogen)规程,将Smart silencer NC、Smart silencer H19、siR-NC、siR-STAT1、siR-NC+ Smart silencer H19、siR-STAT1+Smart silencer H19分别转染至HT-29细胞,6 h后弃去液体,加入正常培养基,培养24 h进行后续检测,不同处理因素重复三次平行实验行。
1.2 RNA提取和Real time PCR取各组细胞1×106,严格按照Trizol试剂盒(美国Omega公司)的操作流程提取HT-29细胞总RNA后,使用逆转录试剂盒(瑞士罗氏公司)将RNA合成cDNA。通过使用SYBR Green mix(瑞士罗氏)试剂盒进行实时定量PCR检测。反应条件为预变性95 ℃ 60 s,一个循环,延伸95 ℃ 15 s,60 ℃ 60 s,共40个循环,以GAPDH为内参,参照2-△△Ct法计算LncRNA H19、STAT1、Bcl-2、Bax表达量,不同处理因素重复三次平行实验。引物序列见表1。

表1 引物序列
1.3 细胞增殖检测将各组细胞浓度调至为4×104mL,取100 μL细胞接种至96孔培养板,加入20 μL的MTT(5 mg/mL)溶液继续培养4 h,每孔加入150 μL二甲基亚砜,低速振荡,使晶体充分溶解。选择波长为490 nm,酶标仪检测每孔吸光度值(Optical density,OD)。细胞增殖能力与OD值成正比。不同处理因素重复三次平行实验。
1.4 统计学处理使用GraphpadPrism 8软件对实验结果进行统计分析,以“均数±标准差”表示,两样本数据采用t检验分析两组之间差异,并对两组以上差异进行方差分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 Smart silencer H19下调 LncRNA H19表达Real time PCR检测转染24 h后,Smart silencer H19组LncRNA H19相对表达量(0.45±0.01)明显低于空白组(1.00±0.00,P<0.01)和Smart silencer NC组(1.02±0.02,P<0.01)。
2.2 LncRNA H19促进HT-29细胞增殖,抑制细胞凋亡Smart silencer H19组细胞在24 h、48 h、72 h三个时间点的OD值均小于空白组、Smart silencer NC组(P空<0.05,Psmart silencer NC<0.05),见表2;与smart silencer NC组和空白组相比,细胞转染24 h后smart silencer H19组Bcl-2表达下调,而Bax表达上调,差异具有统计学意义(P空<0.01,Psmart silencer NC<0.01),见图1。
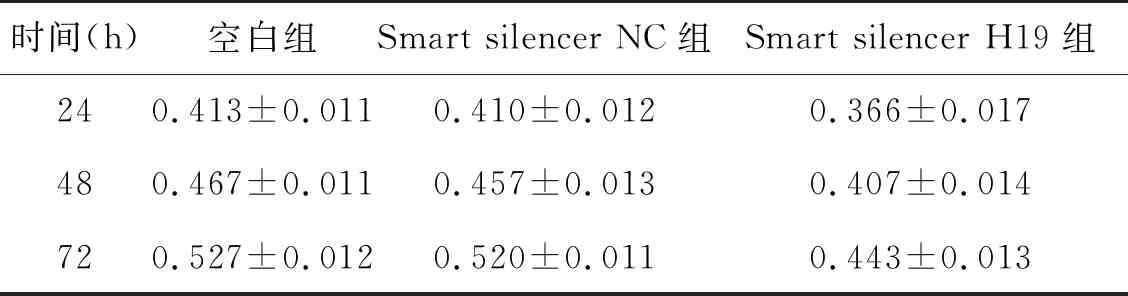
表2 MTT检测细胞增殖结果(OD值)

图1 LncRNA H19影响凋亡相关蛋白表达
2.3 Smart silencer H19下调STAT1表达Smart silencer H19组转染24 h后STAT1相对表达量(0.77±0.03)显著低于smart silencer NC组(1.05±0.06,P<0.01)和空白组(1.00±0.00,P<0.01)。
2.4 STAT1促进HT-29细胞增殖,抑制细胞凋亡转染24 h后siR-STAT1组STAT1相对表达量(0.41±0.04)明显低于空白组(1.00±0.00,P<0.01)、siR-NC组(1.03±0.07,P<0.01);siR-STAT1组在在24 h、48 h、72 h三个时间点的OD值均低于空白组、siR-NC组,差异具有统计学意义(P空<0.05,PsiR-NC<0.05),见表3;与空白组、siR-NC组相比,siR-STAT1组转染24h后明显下调Bcl-2表达,而上调Bax表达,差异具有统计学意义(P空<0.01,PsiR-NC<0.01),见图2。
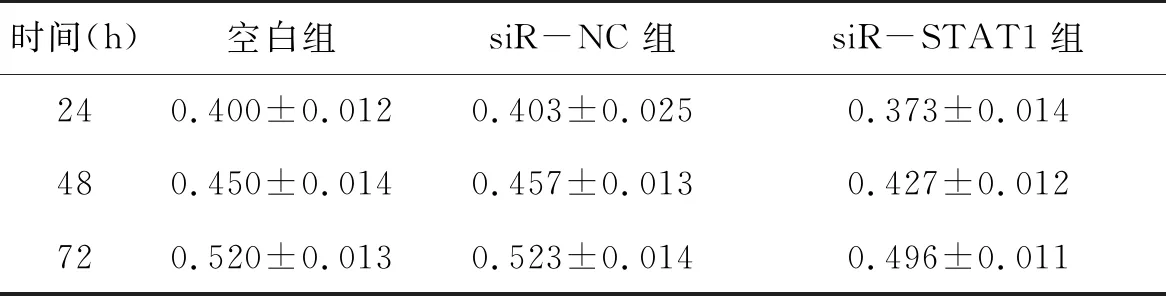
表3 MTT检测细胞增殖结果(OD)

图2 STAT1影响凋亡相关蛋白表达
2.5 STAT1参与LncRNA H19 影响HT-29细胞增殖和凋亡siR-STAT1+smart silencer H19组在24 h、48 h、72 h三个时间点的OD值均小于siR-NC+smart silencer H19组和空白组(P空<0.05,PsiR-NC+smart silencer<0.05),见表4;与空白组、siR-NC+Smart silence H19组相比,siR-STAT1+smart silencer H19组转染24 h后明显下调Bcl-2表达,而上调Bax表达(P空<0.01,PsiR-NC+smart silencer<0.01),见图3。

表4 MTT检测细胞增殖结果

图3 STAT1参与LncRNA H19 影响凋亡相关蛋白表达
3 讨论
结肠癌是死亡率较高的恶性肿瘤,筛查和诊断的主要手段是结肠镜检查,但很多人对结肠镜检查具有排斥心理,因此,临床上需要找到易于获取、重复采样的诊断方式。基于LncRNA的稳定性和组织、细胞特异性,其可能成为癌症的早期诊断的生物学指标,并且越来越多的研究证实LncRNA异常表达在临床上具有应用的价值。LncRNA是长度大于200个核苷酸的非编码RNA,起初被认为是生物“噪音”,但随着研究的深入,发现LncRNA能够以DNA、RNA或者蛋白结合的方式发挥生物学功能,尤其在肿瘤发生、发展中起到重要调控作用,成为近年来肿瘤的研究热点。越来越多研究报道表明LncRNA在恶性肿瘤中异常表达,通过各种机制调节肿瘤细胞增殖、凋亡、侵袭、迁移、上皮间质转化等,从而发挥致癌或抑癌的作用[3]。已有研究发现,LncRNA H19与肿瘤的增殖、凋亡、侵袭、预后等相关,其介导肿瘤进展的方式主要是作为“分子海绵”,调控miRNA从而影响靶基因表达。在不同类型的肿瘤中发挥不同的作用机制,例如:在肺癌细胞中,LncRNA H19过表达且抑制miR-200a表达水平从而促进细胞增殖[4],而在肝细胞癌中,LncRNA H19表达下调,抑制细胞增殖[5]。即使在同一类型肿瘤中LncRNA H19也可以通过靶向不同miRNA发挥不同的调控作用。然而,关于H19在结肠癌中作用机制研究报道较少。在结肠癌患者中LncRNA H19高表达,并利用结肠癌细胞体外探究其作用机制,发现可以靶向miRNA141,激活β-连环蛋白,导致肿瘤细胞活力增加[6],也可以通过miRNA675/RB5[7]或miR-675/EHZ2[8]信号途径调控肿瘤细胞的增殖。因此,本研究利用外源性smart silencer敲低HT-29细胞中LncRNA H19表达,结果显示,smart silencer H19可降低细胞增殖能力和Bcl-2表达,而增加Bax表达。以上结果证实LncRNA H19可以促进结肠癌细胞增殖而抑制细胞凋亡,与已知报道结果一致。
STAT1是信号转导转录激活因子家族之一,不但与增殖、分化、凋亡等生理过程密切相关,而且参与肿瘤形成、发展、转移以及抗药性,其可以通过调控血管生成因子、细胞凋亡和细胞周期相关蛋白,如:Bax、Bcl-2、caspases等,从而抑制肿瘤细胞增殖,促进细胞凋亡,也可以通过增强抗原呈递能力和细胞毒作用的方式参与肿瘤免疫调节,促进肿瘤被免疫系统清除[9]。然而,近年来研究发现STAT1也具有促癌作用。在结肠癌患者中STAT1表达水平明显高于正常结肠组织,而且通过不同路径促进或抑制结肠癌细胞增殖。例如:STAT1下调miR-181a表达,抑制结肠癌细胞增殖[10],而STAT1/CCL5路径促进结肠癌细胞增殖[11]。另外,研究发现,STAT1参与LncRNA调控肿瘤细胞增殖和凋亡[12-13]。基于上述报道,为了进一步探讨LncRNA H19调节结肠癌细胞增殖和凋亡的作用机制,我们进行STAT1敲低实验,结果显示,敲低STAT1导致细胞增殖减少,同时改变Bcl-2、Bax表达,并且STAT1敲低可增强LncRNA H19敲低对结肠癌细胞增殖和凋亡蛋白相关表达的影响。
综上所述,LncRNA H19可能通过影响STAT1表达,调控结肠癌细胞的增殖和凋亡,但是涉及的详细的调控机制还仍不清楚,有待进一步研究。
