GPX3过表达对甲状腺乳头状癌细胞增殖、迁移的影响
2021-06-28于成龙陈培剑于建渤
于成龙,李 冀,陈培剑,冯 莹,于建渤
(1.牡丹江医学院附属红旗医院病理诊断中心;2.黑龙江省肿瘤疾病防治重点实验室,黑龙江 牡丹江 157011)
甲状腺癌是世界上最常见的内分泌癌[1],并且发病率在全球范围内继续上升,主要是由于乳头状癌组织类型(PTC)的增加。约有10%~15%的PTC患者可能复发、转移和死亡[2],因此,有必要充分了解PTC发生、发展过程中的分子机制,能够有效治疗该疾病。大量研究表明,谷胱甘肽过氧化物酶(glutathione peroxidase,GPXs)参与了许多肿瘤的发生和发展。
在GPXs家族中,GPX3是唯一在肾脏合成并主动分泌到血浆中的胞外酶,GPX3可保护细胞免受氧化应激,在清除过氧化氢和其他活性氧方面起着至关重要的作用[3-4]。但是 GPX3在甲状腺癌中的发生和发展的机制仍不十分清楚。本实验通过检测 GPX3在BCPAP细胞株中的表达情况,探讨GPX3对BCPAP细胞的增殖、迁移的影响。
1 材料和方法
1.1 材料细胞株BCPAP购自中国科学院细胞库;DMEM培养液和胎牛血清(美国Gibco生物公司);过表达的慢病毒载体和对照载体(上海和元生物技术股份有限公司);Cell Counting Kit-8(CCK-8)试剂盒(日本同仁);BeyoClick EdU-555细胞增殖检测试剂盒(产品编号C0075S)(上海碧云天生物技术公司);引物及设计与纯化(上海生工生物工程股份有限公司); RNA提取试剂盒(Omega公司);逆转录试剂盒(美国Thermo公司);7500实时荧光定量PCR系统(美国Thermo公司);CO2培养箱(美国Thermo公司);SpectraMax M3多功能酶标仪(美国Molecular Devices公司)。
1.2 方法
1.2.1 细胞培养 BCPAP细胞株在含有10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素的DMEM培养基中培养。细胞置于5% CO2、37 ℃恒温培养箱中培养,每日观察细胞生长情况,定时更换培养液。
1.2.2 慢病毒转染 选择状态良好的BCPAP细胞株接种到6孔板及4个培养皿中,细胞计数后,按1×106/孔细胞及10%胎牛血清DMEM培养基进行铺板,放入培养箱12 h后待细胞完全贴壁并且细胞融合度达到70%左右后,更换血清培养基,分成两组,按MOI值为10比例,第一组(GPX3-BCPAP组)加入过表达GPX3慢病毒到孔内,第二组(NC-BCPAP组)加入空载病毒到孔内,并且加入10 μL的Polybrene增加转染效率,病毒感染8~12 h后,观察细胞状态,在24 h内重新换成10%胎牛血清完全培养基,再次放入培养箱,感染72 h后用共聚焦显微镜观察细胞,用共聚焦显微镜观察细胞的荧光强弱来判断慢病毒转染目的细胞的效率。
1.2.3 BeyoClick EdU-555细胞增殖检测 应用BeyoClick EdU-555细胞增殖检测试剂盒检测细胞增殖情况,最后用共聚焦显微镜观察。并使用Image J软件进行细胞计数。实验重复3次。
1.2.4 CCK-8细胞活性检测 将GPX3过表达及空载慢病毒转染成功的细胞按照3000细胞/孔的密度接种于96孔板中,用含10%胎牛血清的DMEM制成单细胞悬液,在5% CO2、37 ℃恒温培养箱中培养48 h后,向每孔加入10 μL CCK-8溶液,孵育4 h,于酶标仪450 nm处检测OD值。实验重复3次。
1.2.5 划痕实验 GPX3过表达及空载慢病毒成功转染后,将BCPAP细胞分别以1×105细胞/孔接种在6孔板中。当细胞融合达到大约90%时,使用无菌移液器吸头有序的刮擦细胞瓶底部,用PBS清除刮擦后细胞,重新加入2 mL完全培养液。在刮擦后0 h、24 h,使用倒置显微镜(×200)拍摄并使用Image J软件分别计算各组面积X0、X24;按照公式(X0-X24)/X0计算相对愈合面积,实验重复3次。
1.2.6 qRT-PCR检测GPX3和Caspase-3表达情况 根据E.Z.N.A.TM HP Total RNA Kit说明书从培养细胞中分离获得总RNA。并使用1 μg总RNA利用Transcriptor First Strand cDNA试剂盒进行cDNA第一条链合成,再用Fast SYBR green PCR master mix(Roche)进行逆转录成cDNA,再通过引物序列进行扩增,并且使用GAPDH作为内部参照。引物序列见表1,反应体系见表2。反应条件:20 μL反应体系,95 ℃预变性10 min,95 ℃变性15 s,55 ℃退火1 min,72 ℃延伸10 min。进行44个循环。每个样品重复3次,依据 2-△△CT法计算mRNA各样本相对表达量。

表1 qRT-PCR引物序列
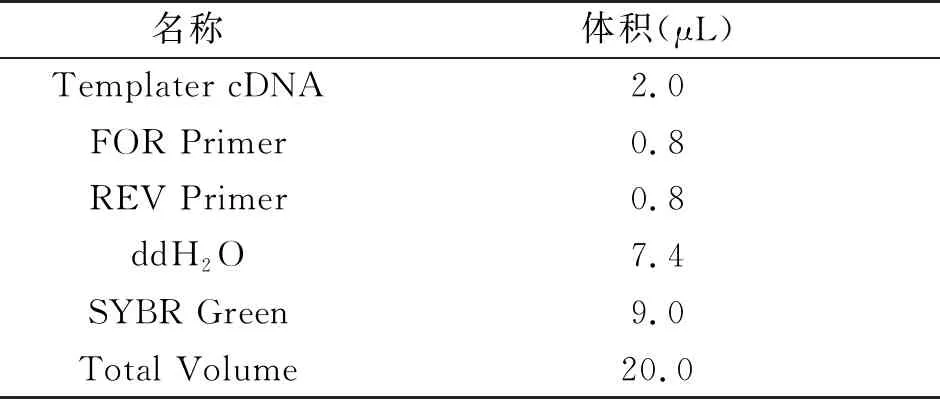
表2 qRT-PCR反应体系
1.3 统计学分析使用SPSS 22.0统计软件,定量数据均是用“均数±标准差”表示,两组间差异性比较采用t检验,三组间比较采用方差分析,并进行多重比较。P<0.05为差异具有统计学意义。
2 结果
2.1 慢病毒转染后的BCPAP细胞株形态观察细胞转染72 h后,在共聚焦显微镜下观察到慢病毒成功转染的细胞显示绿色荧光,表明NC-BCPAP组与GPX3-BCPAP组转染成功,见图1。
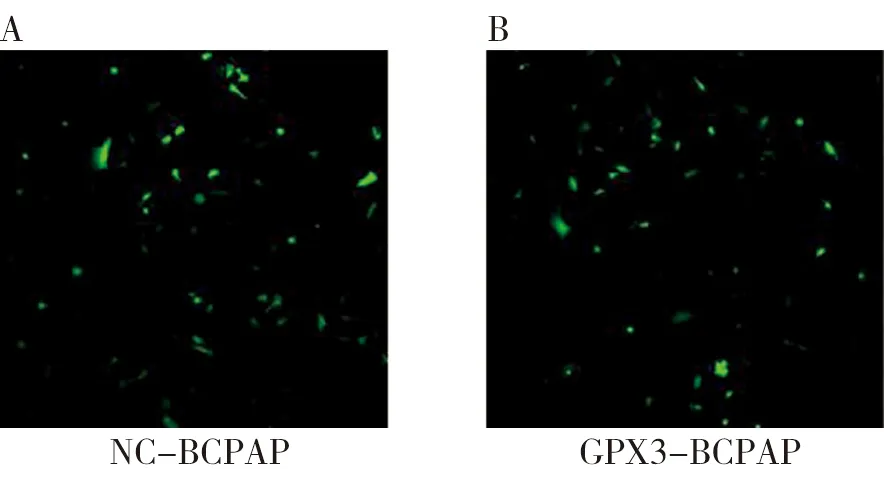
图1 共聚焦显微镜下慢病毒转染后的细胞形态(×200)
2.2 慢病毒转染后检测BCPAP中GPX3 mRNA的表达qRT-PCR检测在NC-BCPAP组和GPX3-BCPAP组中GPX3的表达,GPX3-BCPAP组(10.2173±2.0818)GPX3表达明显高于NC-BCPAP组(0.7819±0.1019)(P<0.001)。
2.3 EDU-555检测过表达GPX3抑制BCPAP细胞的增殖BeyoClick EdU-555结果显示,与NC-BCPAP组(31.3260±19.1772)相比,GPX3-BCPAP组(12.4868±6.7064)EDU阳性染色细胞数量显著降低,表明过表达GPX3是通过抑制细胞中DNA的合成的方式来抑制BCPAP细胞的增殖能力(P<0.05),见图2。
图2 共聚焦显微镜下BCPAP细胞的增殖能力(×200)
2.4 CCK-8检测过表达GPX3抑制BCPAP细胞的增殖能力CCK-8结果显示,GPX3-BCPAP组(0.3316±0.004)细胞的增殖能力低于NC-BCPAP组(0.4141±0.003)细胞增殖能力(P<0.05)。
2.5 过表达GPX3抑制BCPAP细胞的迁移能力划痕实验结果显示:GPX3-BCPAP组BCPAP细胞相对愈合面积(7.31±9.78)%明显低于NC-BCPAP组(24.40±0.83)%,差异有统计学意义(P<0.05),提示过表达GPX3能抑制BCPAP细胞的迁移,见图3。

图3 荧光显微镜下各组细胞不同时间点的迁移能力(×200)
2.6 慢病毒转染后检测BCPAP中Caspase-3的表达qRT-PCR检测结果显示GPX3-BCPAP组(21.644±6.149)Caspase-3表达明显高于NC-BCPAP组(3.577±0.951),表明过表达GPX3可能促进BCPAP细胞的凋亡(P<0.05)。
3 讨论
甲状腺癌是近几十年来所有实体肿瘤中增长最快的癌症。PTC是甲状腺癌的最主要类型[5],仅PTC占所有甲状腺癌的85%左右,尽管手术和其他疗法可以解决大多数情况,但患者的发病率很高,在某些情况下,肿瘤表现出更具侵略性的行为[6],因此,必须全面了解PTC细胞转移过程中的分子机制,并确定新的治疗靶点,以便对这种疾病进行有效的治疗,虽然在过去的几十年里发现了越来越多的生物标记物,但还没有发现PTC的特异性生物标记物,很明显,恶性肿瘤的早期诊断是确保患者更好预后的关键,因此,迫切需要寻找对PTC患者具有治疗和预后价值的有前途的生物标志物。
GPX3是GPXs的一种分泌形式、硒蛋白,在血浆和粘膜表面很容易检测到,是血浆中的主要抗氧化酶,它在活性氧进入细胞之前对其进行解毒[7],并且GPX3是GPXs中唯一的胞外糖基化酶,GPX3在不同的肿瘤类型中起着双重作用,既是肿瘤抑制蛋白,又是促生存蛋白,可催化还原型谷胱甘肽对水和可溶性脂质过氧化氢的解毒作用[8]。来越多的证据表明,GPXs家族基因在人类癌症的发生发展中起着重要作用,特别是GPX3已被证实经常异常表达,并与乳腺癌、肝癌、肾透明细胞癌[9]等多种人类癌症的进展密切相关。Peng等人[10]利用qRT-PCR检测了在9个胃癌细胞系中的8个检测到GPX3的下调或沉默,通过刮擦伤口愈合试验检测,胃癌细胞中GPX3高表达降低了细胞迁移的能力,Zhao[11]等人发现在原发性PTC组织中GPX3的表达经常降低或缺失,同样,在本研究中,我们使用划痕实验检测发现在BCPAP细胞株中高表达的GPX3的迁移能力降低,我们还通过CCK-8,BeyoClick EdU-555检测发现GPX3-BCPAP组细胞的增殖速率及增殖能力低于NC-BCPAP组,此外,利用qRT-PCR证实了与NC-BCPAP细胞组相比,GPX3-BCPAP组PTC的细胞凋亡能力增强,此外,An等人[12]也在肺癌中发现GPX3能有效抑制肺癌细胞的增殖、迁移和侵袭。经过充分的研究,已被证实GPX3在大多数癌症中起着抑癌作用,其可能作为预后生物标志物的使用以及临床干预的潜在靶标[13]。
综上所述,过表达的GPX3在PTC细胞中显着抑制细胞的增殖、迁移,并且可以促进癌细胞的凋亡,可能有希望作为甲状腺癌患者的诊断或预后生物标志物,为开发有效的甲状腺癌治疗靶标和生物标志物提供了重要线索,但具体机制还有待进一步的研究。
