注射用六氟化硫微泡致过敏性休克文献分析
2021-06-25马换青马长兴张二锋李淑芳
马换青,马长兴,孙 博,张二锋,李淑芳*
(1 河南大学附属郑州市肿瘤医院/郑州市第三人民医院药学部,郑州 450000;2 郑州市妇幼保健院药学部,郑州 450000)
六氟化硫(sulfur hexafluoride,SF6)是一种惰性极好的高密度非有机气体,用其制成的微泡作为微血管示踪剂,在超声造影(contrast-enhanced ultrasound,CEUS)诊断应用上占据了极其重要的地位。其中,声诺维(SonoVue®,意大利Bracco公司)作为第二代超声造影剂(ultrasound contrast agent,UCA)于2001年3月推出,2003年得到欧洲药品管理局(EMA)的批准上市[1],2014经美国食品药品监督管理局(FDA)批准上市[2]。SonoVue®冻干粉末辅料由二硬脂酰磷脂酰胆碱(DSPC)、二棕榈磷酯酰甘油钠(DPPG-Na)、棕榈酸、聚乙二醇4000组成[3]。将以上成分经过溶解、冷冻、干燥,生成的空心粉末以SF6气体饱和后密封保存,在使用时加入0.9%氯化钠注射液混合,即可得到可静脉注射的SF6微泡超声造影剂[4]。SonoVue®安全性好、不良反应少,进入机体被降解后,可很快通过呼吸系统排出体外。含有微泡的造影剂最早是通过外周静脉注入抵达冠脉循环来评价心肌微循环,后经过临床造影技术的不断发展。心肌灌注声学造影也逐渐进入临床,由单纯定性诊断进入定量诊断阶段。声学造影对肿瘤的检出和定性诊断有着重要的意义:在手术中评估疗效,如肿瘤消融治疗后可通过超声造影确认肿瘤是否完全灭活;在输卵管造影中通过观察造影剂走向,判断输卵管是否通畅;在介入造影中,胆管置管时可沿引流管注入造影剂观察走向,判断置管是否成功等。可见超声造影在临床诊断中的巨大价值,但临床在关注超声造影带来重大意义的同时也应重视其罕见不良反应给患者带来的危害[5]。目前,国内外暂无SF6微泡致过敏性休克的文献病例总结,本研究通过对国内外SF6微泡上市后引起过敏性休克的病例报道进行收集分析,旨在为临床安全用药提供参考。
1 资料与方法
1.1 资料来源
以“六氟化硫微泡”“超声造影剂”“声诺维”“过敏性休克”“sulfur hexafluoride microbubbles”“ultrasound contrast agent”“SonoVue®”“anaphylactic shock”为检索词,检索2001年1月~2019年12月中国知网(CNKI)、万方数据库(WANFANG Data)、维普数据库(VIP)、PubMed、Springer、Elsevier数据库关于SF6微泡SonoVue®致过敏性休克个案报道文献,下载病例报告原文,认真阅读并分析。
1.2 研究方法
采用回顾性研究方法,提取患者性别、年龄、疾病诊断、过敏史、SonoVue®用药剂量、不良反应发生时间、临床表现、处置和转归情况等有效信息,采用Excel 2010及SPSS 24.0版软件及文献计量学的方法进行统计分析。
文献纳入标准:① 原始资料为国内外公开发表的文献。② 文献描述相关信息完整。③ 明确过敏性休克与SonoVue®相关,符合诺氏(Naranjo’s)药物不良反应评估量表判断标准[6]。
剔除标准:① 综述性文献。② 无法明确过敏性休克与SF6微泡相关性的文献。③ 重复发表文献。④ 病历描述不清的文献。
2 结果
2.1 基本情况
共筛选出个案报道11篇[1,7-16]。其中,纳入病例13例(国内6例、国外7例);男性8例,女性5例;患者年龄≥60岁4例,其中最小年龄34岁,最大年龄80岁。13例病例中,有高血压病史2例[1,16]、糖尿病史1例[7]、心力衰竭史1例[16]、肝硬化病史3例[9,13-14];4例过敏史不详[8,10-11,16],其余无过敏史;1例泵入[7],1例用法不详[10],其余用法均为静脉注射;2例用量不详[10-11],其余用量均符合SonoVue®说明书要求。2例有联合用药[16],4例联合用药情况不详[1,8,13,16],其余无联合用药。见表1。
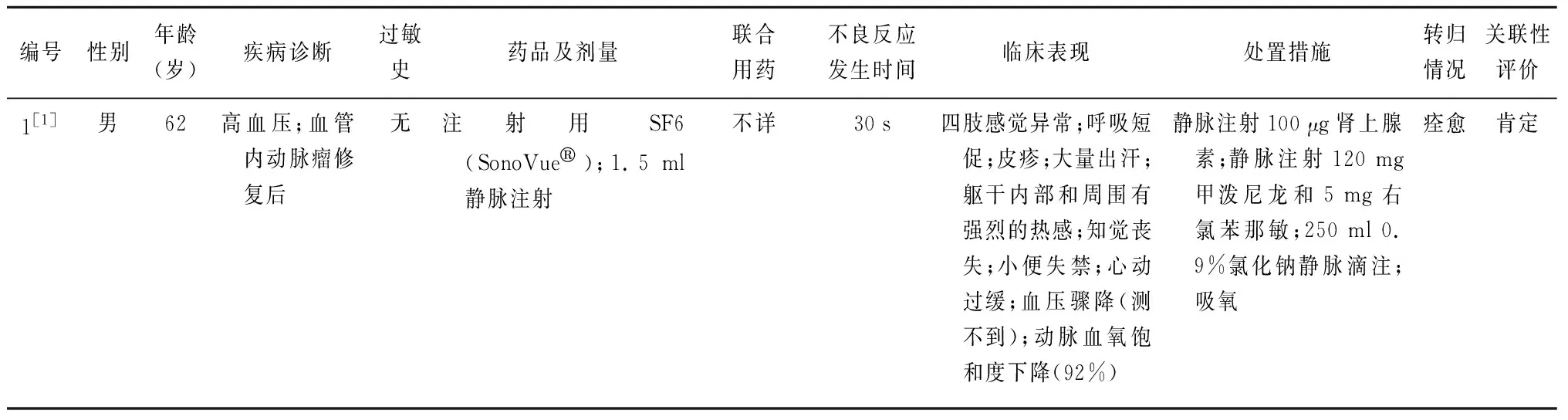
表1 SonoVue®致过敏性休克病例信息

(续表)
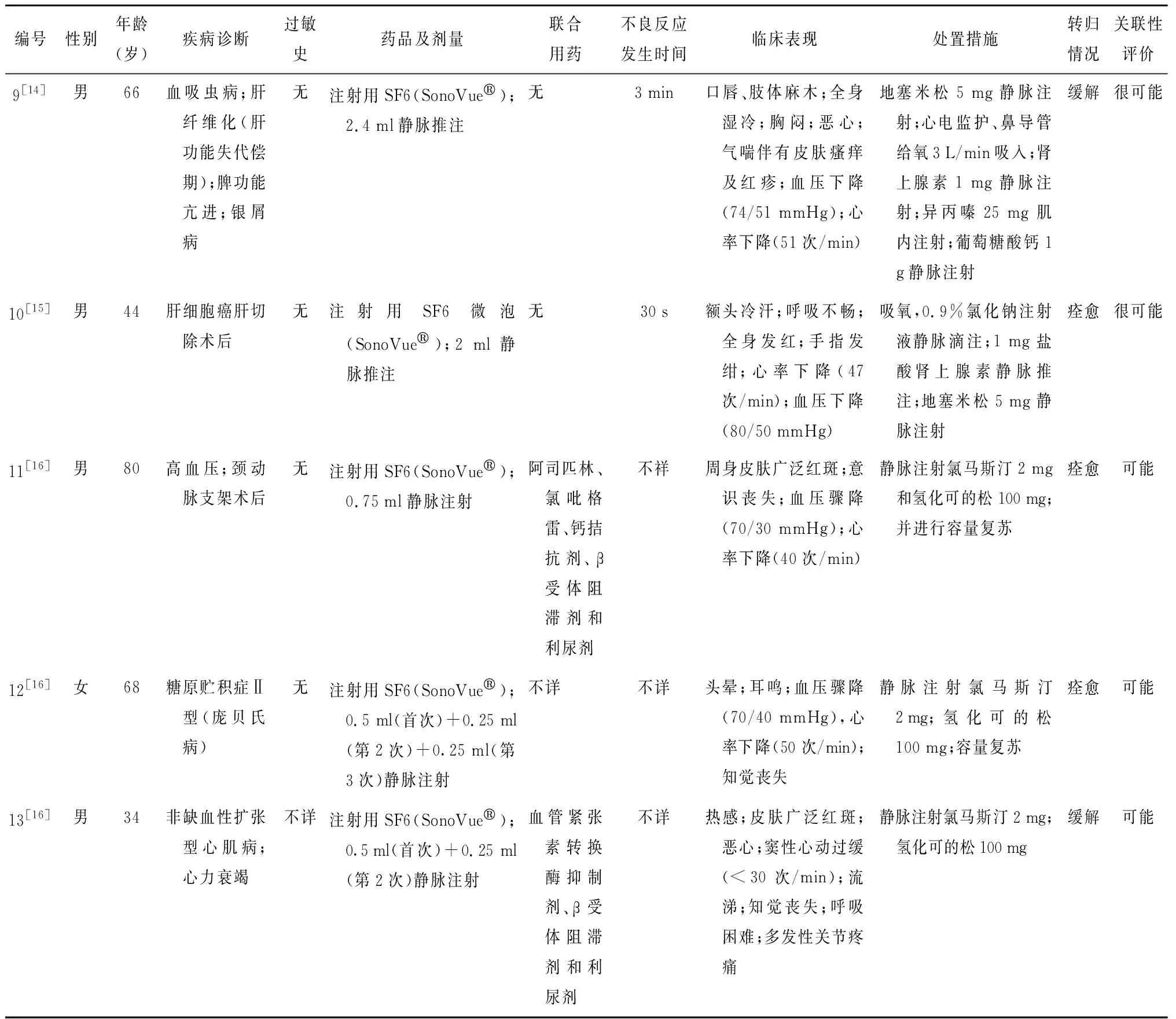
(续表)
2.2 过敏性休克发生时间及临床表现
13例SonoVue®致过敏性休克病例中,11例为首次用药引起[1,7-15],过敏性休克发生均在用药 5 min 内,发生时间短、发展迅速;3例过敏性休克为用药 30 s 后出现[1,8,15];4例具体发生时间不详(描述为用药过程中)[9,16]。临床表现描述均较具体,因同一病例临床表现多样,故统计总例数大于13例,见表2。SF6致过敏性休克主要的临床表现是循环系统、神经系统和呼吸系统损伤,占总例次的75.22%,其中血压骤降最多见(11例),占总例数的84.62%,其中有4例血压降至0 mmHg[1,8,10,13];其次为心动过缓9例、意识丧失9例、皮肤潮红8例、呼吸困难7例等。

表2 累积器官/系统与主要临床表现

(续表)
2.3 过敏性休克处置与转归
13例患者在出现过敏性休克症状后,给予吸氧、扩充血容量治疗,同时通过肾上腺素升血压,注射地塞米松、多巴胺、氯苯那敏等多种抗休克措施处理后,有6例痊愈、7例缓解,无死亡病例出现。
2.4 关联性评价
依据诺氏药物不良反应评估量表判断标准[6],对13例患者过敏性休克与SonoVue®的关系进行评分,判定为“肯定”的有3例[1,8,11],“很可能”的有5例[7,9,13-15],“可能”的有5例[10,12,16]。
3 讨论
近年来,增强CEUS作为一个快速发展的技术,其应用范围已远远超出了多普勒超声技术。这项技术可以明显提高分辨率并抑制来自静止组织的信号,能进行实时扫描,明确造影剂的动态曲线。CEUS在临床应用中的有效性得到越来越多的证实[17],不仅可以评估不同实质性器官中的大血管和微血管病变[18],还可以评估创伤后的腹腔器官和儿童膀胱输尿管反流情况[19];另外,还可以通过回声信号强度来量化器官血流灌注[20-21]。目前,在CEUS技术中SonoVue®是唯一获准用于血管检查的药物[1]。SonoVue®作为第二代超声造影剂,自上市以来应用广泛,在临床前发展阶段只有轻微的不良反应被报道,不良反应较少,在不同的研究中发生率为0.013%~10.8%[11,22-23]。虽然SonoVue®说明书描述其不良反应“轻微的、短暂且可以自行恢复并无遗留效应”,临床试验中最常见的是“头痛,注射部位疼痛或青肿、灼热等反应,罕见有过敏性休克发生”,但查阅相关文献,不乏罕见严重过敏反应事件报道。在上市后的监测中,EMA报告了暴露于SonoVue®的200万例受试者中有719例患者(0.0294%)出现不良反应[24-25];307例(0.0126%)患者出现严重但非致命的不良反应[24,26]。在2006年的一项安全性评估中,通过对23 188例接受腹部检查的成年人进行的研究显示,仅有29例有与SonoVue®相关的不良反应,其中2例为严重病例(危及生命),其余27例无生命危险;无死亡病例报告[27]。但SonoVue®最初在欧洲和其他国家被批准用于超声心动图和其他非心脏部位后,曾报告许多严重的过敏反应,其中包括3份严重冠状动脉疾病患者应用SonoVue®后不久死亡的报告[16,26]。这些患者中,有2例出现冠状动脉血栓(1例在血管造影术中发生了支架闭塞,另1例在尸检时发现冠状动脉主干闭塞),第3例患者没有进行尸检。在上市后的监测中,已经有11例与SonoVue®输注时间相关的死亡报告,所有的死亡报告均发生在具有严重心血管疾病或不稳定冠状动脉疾病的患者[1]。国内有研究分析了2005~2014年30 222例行腹部及浅表超声造影患者的临床资料[28],其中6例(0.020%)使用SonoVue®后出现不同程度的不良反应,包括2例早期过敏性休克的症状(胸闷、心慌、出汗、脉搏快速而微弱、随后是发绀、脉搏消失、血压下降)在积极抢救后有所改善,其余4例患者出现注射部位上方手臂发红、皮疹、背痛、鼻腔出血、嘴唇和四肢麻木、恶心呕吐等;休息一段时间后,4例轻症患者的症状自行缓解。国内暂无死亡病例报告。
本研究中,13例应用SonoVue®出现过敏性休克的病例中,均为不同年龄段的成人患者,男性多于女性。暂无文献报道静脉注射SF6后男性与女性在药物吸收速率上有无根本差异,故考虑可能与男性心血管疾病本身发病率比女性高,而心血管疾病又为SonoVue®高危因素有关。对于SonoVue®致过敏性休克有无明显性别差异,还需进行大量临床对照研究。本研究发现有2例患者具有高血压病史[1,16],其中1例报告中明确描述患者在进行超声造影前24 h曾服用阿司匹林、氯吡格雷、钙拮抗剂、β受体阻滞剂和利尿剂[16],故不能排除联合用药与过敏性休克间的因果关系,对于SonoVue®与联合用药之间的相互作用的研究尚缺乏文献证实,但在临床研究过程中发现,其与多种常用药物联合使用发生的不良事件与SonoVue®无明显关联;另1例患者联合用药情况不详[1]。2例患者对使用SonoVue®前血压控制情况均未做描述,虽然暂无文献报道高血压能增加使用SF6微泡患者的死亡率,但根据SonoVue®说明书,未控制的系统高血压本身为患者禁忌症,不能排除高血压是以上2例患者发生过敏性休克的诱导因素。另1例患有非缺血性扩张型心肌病、心力衰竭[16],在第2次静脉注射SonoVue®后出现心动过缓、意识丧失、呼吸困难等过敏性休克症状,并且在对症治疗缓解后继发多关节疼痛。此例患者心力衰竭同样是SonoVue®禁忌症,因此考虑其严重不良反应的发生与患者原患疾病相关。除此以外,对SF6或其他组分有过敏史、近期急性冠脉综合征、近期不稳定性缺血性心脏病、伴有右向左分流的心脏病、重度肺动脉高压、成人呼吸窘迫综合征及严重心律不齐都是SonoVue®的禁忌症,临床在应用时应严格遵循说明书规定,在SonoVue®输注期间及输注后至少30 min对患者进行密切医疗监护,并监测高危患者的生命体征[24-25],减少不良反应发生。13例过敏性休克患者中,有11例为首次用药后发生,1例为用药2次后发生[16],1例为用药3次后发生[16]。提示SonoVue®致过敏性休克不仅只发生在首次用药时,还需更深入地研究静注次数与发生过敏性休克的关联性。13例患者过敏性休克发生时间均在用药5 min内,3例为用药30 s后[1,8,15]。因SonoVue®平均消除半衰期为12 min,注射2 min后已有80%的SF6气体呼出,稳定成分通过肝和肾代谢[29],注射15 min后几乎所有SF6气体都已排除[30],故罕见有用药30 min后出现过敏性休克。SonoVue®致过敏性休克的临床表现多集中在循环系统、神经系统和呼吸系统损伤,其中血压骤降发生例次最多,有4例血压降至0 mmHg,危及生命[1,8,10,13]。这些不适症状经过及时吸氧、扩充血容量,同时通过肾上腺素升血压、注射地塞米松、多巴胺、氯苯那敏等多种抗休克措施处理后,有6例痊愈,7例缓解,无死亡病例出现。
目前,SonoVue®致过敏性休克发生机制的相关文献较罕见,有研究认为与其他造影剂相同[9,16],其机制可能与直接激活肥大细胞、补体激活、血清素释放增加以及胆碱酯酶等酶的抑制有关。Piskunowicz等[31]在一项小儿超声造影增强中的安全性研究指出,SonoVue®之所以能导致严重过敏反应,可能与含有潜在致敏成分(脂质体、磷脂外壳)和溶剂(聚乙二醇4000、棕榈酸)有关。Coudray等[1]也认为SonoVue®致过敏性休克的发生可能与辅料中聚乙二醇4000有关;曾有1例病例报道[32],为做过结肠镜检查的患者在使用含有聚乙二醇4000的肠道清洁剂时发生过敏性休克。有关使用SonoVue®前是否需要做过敏试验,Coudray等[1]认为IgE介导的反应通常与皮内过敏试验阳性有关,但Levano等[9]报道了1例患者虽然皮内测试为阴性,但在第1次注射SonoVue®后即刻发生了过敏性反应。可见使用造影剂之前依靠皮内试验结果并不能准确地预测患者是否会出现不良反应,且皮内试验本身存在风险。文献中也很少有关于SonoVue®的皮内试验结果与不良反应关联的报道,但因说明书未明确使用SonoVue®前是否必须进行过敏试验,故还需进行大量临床研究。但临床实践证实,肾上腺素是发生速发型过敏反应的一线药物,患者在发生低血压时应尽早静脉给药,对患者的生命安全至关重要[33]。亦可以考虑,高危因素患者在使用超声造影剂前预防性给予糖皮质激素或抗组胺药,可减少或避免变态反应的发生。
综上所述,UCA具有较高的安全性和增值空间。然而,罕见的严重不良反应可能会危及生命。临床在应用此药时一定要提高警惕,严格遵循说明书规定,询问患者有无UCA过敏史,有无SonoVue®禁忌症及近期用药情况,避免高危人群用药,减少不良反应的发生。并且,在用药前做好患者及家属的沟通工作,告知其可能发生的一切不良反应;必须在给药前、给药期间和给药后30 min内监测患者生命体征参数;在应急设施完善和经过专业培训的抢救人员充足的环境下使用SonoVue®。一旦发生不良反应,应及时救治,保障患者的生命安全。因本研究是在个案报道的基础上进行总结分析,结论有一定的局限性,故对于SF6 SonoVue®致过敏性休克的临床特征及机制还需进一步开展标准化、多中心研究,这将有助于确定UCA在静脉内用于诊断成像的安全性和价值。
