芽殖酵母Sik1蛋白在纺锤体定位中的功能
2021-06-25唐仙英庞文颖海力滕雪张楠朱顺
唐仙英,庞文颖,海力,滕雪,张楠,朱顺
(中南民族大学 生命科学学院 & 武陵山区特色资源植物种质保护与利用湖北省重点实验室 &生物技术国家民委重点实验室,武汉 430074)
纺锤体是在有丝分裂过程中驱动染色体分离的细胞器. 在不对称性分裂的细胞中,纺锤体的正确定位还决定两个子细胞的命运[1]. 目前的研究已从细胞皮层、动力蛋白和星体微管网络等方面对纺锤体定位的机理进行了阐释[2]. 在模式生物芽殖酵母(Saccharomycescerevisiae)中,已知的调控纺锤体定位的重要通路有两条:一条由动力蛋白Dynein介导,另一条由Kar9介导[3]. 二者在不同阶段调控纺锤体的定位,其中Kar9通路负责将短纺锤体从母细胞移向母-芽颈,而Dynein通路则负责将纺锤体通过母-芽颈拉入子细胞[4-5].
在Dynein通路中,动力蛋白Dynein先结合于星体微管正端,在随微管摆动过程中被细胞皮层上的Num1蛋白(Nuclear migration 1)捕获并激活,这一过程称为卸载;然后Dynein通过水解ATP向星体微管负端运动并产生拉力,使纺锤体和细胞核穿过母-芽颈而从母细胞转移到子细胞中[6],这一过程称为核迁移.
Num1是Dynein在细胞皮层上的锚定蛋白.NUM1基因缺失将使细胞核向子细胞的转移失败,导致双核细胞的产生[7]. Num1蛋白是一个由多结构域组成的约313 kD的大分子蛋白,它在质膜上成簇分布,其C末端的PH结构域与质膜上的4,5-二磷酸磷脂酰基醇(PI4,5P2)结合,由此将Num1定位在质膜上. 同时,其N末端的CC结构域与线粒体膜上的心磷脂结合,使Num1和线粒体相连[8].
Sik1(suppressors of IκB),别名Nop56[9],是一种进化保守的核仁蛋白,参与rRNA的加工过程[10]. 有研究表明,过表达SIK1基因的细胞比同样条件下培养的野生型细胞体积大5%左右,且G1期进程缩短,但有丝分裂进程延长[11],这是因为过表达SIK1破坏了微管的功能,使纺锤体定位受损. 但是,该纺锤体定位受损是否足以影响核迁移,以及Sik1是否在Kar9或Dynein通路中扮演角色,目前还未知. 本实验室通过Num1的CC结构域的Pull down实验筛选出了一系列Num1的互作蛋白[12],Sik1是其中一员,因此推测二者可能存在功能关系. 本研究将从这一观点出发,检测Sik1在核迁移中的作用及与Num1的功能关系.
1 材料与方法
1.1 材料和仪器
Phanta Max Super-Fidelity DNA Polymerase (Vazyme);鱼精DNA (Invitrogen);凝胶回收试剂盒 (OMEGA);DMSO (Sigma);G418 (上海生工);PVDF膜 (Immobilon©-P Membrane, 0.45 μm);Zymolase (ZYMO research);鼠源HA抗体、GFP抗体(Genescript).
孢子解离显微操作仪(MSM400,英国Singer),珠磨式细胞破碎仪(Mini Bead Beater-16, 美国BioSpec);微量冷冻离心机(FC5515R, 美国OHAUS);显微镜(BX53,日本Olympus).
1.2 质粒与酵母菌株
本实验中所用的菌株见表1. 所用质粒为pFA6a-kanMX6-GAL1p-3HA[13], pBJ1351(pRS305:Tub1-GFP).

表1 本实验所用酵母菌株Tab.1 Yeast strains used in this study
1.3 培养基
YPD培养基,SC(synthetic complete)培养基参照LONGTINE 等[13],YPG培养基用半乳糖取代蔗糖,其他同YPD培养基. 用于诱导二倍体细胞减数分裂的SPM培养基为:酵母提取物 1 g/L, CSM 0.2 g/L, 蔗糖 0.5 g/L, 醋酸钾 10 g/L.
1.4 SIK1基因过表达菌株的构建
PCR扩增待转化片段:利用PCR反应从质粒pFA6a-kanMX6-PGAL1-3HA[13]上扩增KanMX6-GAL1p-3HA片段,上游引物Tang130,下游引物Tang131,引物序列见表2,使用50 μL体系进行扩增:ddH2O 18 μL; 2×SF Buffer 25 μL; 模板50~400 ng; Tang130 (10 μM) 2 μL; Tang131 (10 μM) 2 μL; dNTPs mixture 1 μL; Phanta Max Super-Fidelity DNA Polymerase 1 μL. PCR反应程序为:98 ℃ 3 min;98 ℃ 10 s,45 ℃ 20 s,72 ℃ 2 min,2个循环;98 ℃ 10 s,60 ℃ 20 s,72 ℃ 2 min,33个循环;72 ℃ 8 min;12 ℃保存.

表2 引物序列Tab.2 Sequence of primers
回收目的片段:将PCR反应产物在1%的琼脂糖凝胶中电泳,切下目的条带回收.
制备YWL36的感受态细胞及转化:采用醋酸锂程序制备感受态细胞并转化[13]. 转化细胞涂布于含G418的YPG固体培养基上,30 ℃培养24 h后将细胞复制于新的含G418的YPG固体培养基,30 ℃继续培养至长出克隆.
克隆鉴定:挑取数个单克隆在新的YPG固体培养基上划线两次,将最终得到的单克隆接种至3 mL YPG液体培养基中,在30 ℃摇床中培养至对数期,提取总蛋白,进行Western blot检测.
1.5 TCA(三氯乙酸)法提取总蛋白
TCA法提取总蛋白参照Tang[14]等.
1.6 蛋白免疫印迹分析
蛋白样品用10%变性聚丙烯酰胺凝胶电泳分离[15],转印至PVDF蛋白膜,用抗体孵育后在凝胶成像仪成像.
1.7 低温双核实验及DAPI染色
参照Tang等[16]方法.
2 结果与分析
2.1 SIK1基因过表达菌株的构建
已有研究表明,SIK1是一个必需基因,缺失可导致细胞死亡,因此为了检测Sik1蛋白在有丝分裂过程中的功能,本研究构建了过表达SIK1的菌株. 首先通过PCR从质粒pFA6a-kanMX6-GAL1p-3HA上扩增KanMX6-GAL1p-3HA片段(图1(a)),片段回收后再转化到野生型(YWL36)感受态细胞中,涂布于含G418的YPG平板上,24 h后复制一次至相同的培养基上. 当复制平板上长出单克隆时挑取5个在新YPG平板上划线2次得到纯化的单菌落,在液体培养基中扩大培养并提取总蛋白进行Western分析(图1(b)). 结果显示第1、2、3、5号克隆表达与预测尺寸相符的GAL1p-3HA-Sik1蛋白. 选取其中两个克隆提取基因组DNA, 通过PCR扩增标记位点片段送去测序(图1(c)). 测序结果标明这两个克隆均成功发生基因重组,即GAL1启动子已替换SIK1的内源启动子,SIK1过表达菌株KanMX6-GAL1p-3HA-SIK1构建成功,命名为YT125.
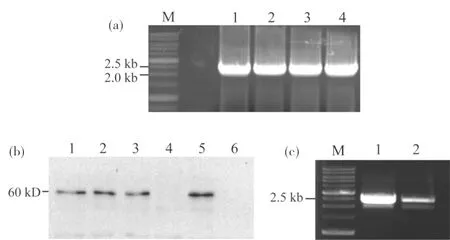
图1 KanMX6-GAL1p-3HA-SIK1菌株的构建Fig.1 The construction of KanMX6-GAL1p-3HA-SIK1 strain(a)PCR扩增片段 KanMX6-GAL1p-3HA,1~4为同一片段,M为Marker;(b) Western blot分析检测GAL1p-3HA-Sik1蛋白的表达,1~5为不同的克隆,6为未标记的阴性对照;(c) PCR扩增KanMX6-GAL1p-3HA标记位点片段用于测序,1~2为不同的克隆
为观察纺锤体,将质粒pRS305:GFP-TUB1转化到YT125细胞中,获得GAL1p-3HA-SIK1GFP-TUB1菌株,命名为YT139.
2.2 SIK1基因过表达菌株的双核比率及纺锤体定位分析
为了比较过表达SIK1的菌株YT139 (GAL1p-3HA-SIK1GFP-TUB1 ),缺失NUM1的菌株YT151 (num1ΔGFP-TUB1),以及野生型菌株YWL1993 (GFP-TUB1 )中的纺锤体定位及核分裂,细胞于12 ℃培养16 h以促进双核细胞的产生. 一部分细胞用于提取总蛋白进行Western blot分析确认蛋白的表达,另一部分细胞用70%酒精固定后用于DAPI染色观察细胞核,或者用荧光显微镜观察纺锤体. 如图2所示,Western blot分析确认了3个菌株中GFP-Tub1以及YT139菌株中GAL1p-3HA-Sik1的表达.
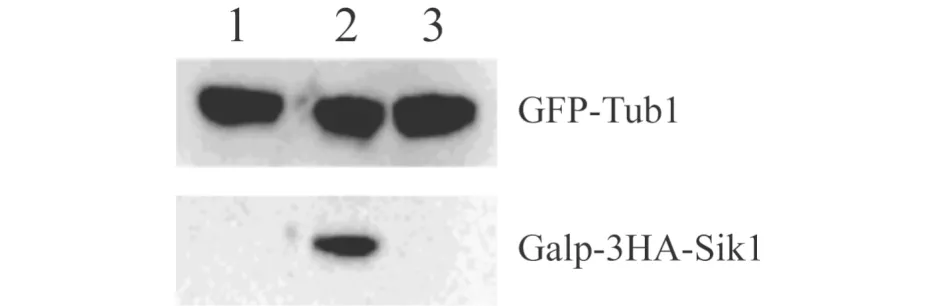
1)num1Δ GFP-TUB1(YT151);2)GAL1p-3HA-SIK1 GFP-TUB1 (YT139);3)GFP-TUB1(YWL1993).图2 Western blot分析确认菌株的蛋白表达Fig.2 Western blot analysis to confirm protein expression in strains indicated
在芽殖酵母的有丝分裂中,纺锤体在从母细胞转移到子细胞之前,先要与母-子细胞极轴平行排列极轴示意图见图3(a). 为了检测过表达SIK1对此阶段纺锤体定位的影响,在荧光显微镜下观察了细胞中的GFP-TUB1信号(图4,中间列),然后用Image J对位于母细胞中的短纺锤体偏离极轴的角度β进行了测量(图3(a)). 3个菌株中β角的测量结果如图3(b)所示,其中野生型细胞中纺锤体偏离角度的平均值为32.4°[(32.4±24.5),图3(b),n=80],num1Δ细胞为41.1°[(41.1±24.5),图3(b),n=40],而GAL1p-3HA-SIK1细胞为48.0°[(48.0±29.7°),图3(b),n=59]. 独立样本t检验结果表明,GAL1p-3HA-SIK1细胞与野生型细胞存在极显著差异(P<0.001),而GAL1p-3HA-SIK1与num1Δ细胞间,以及num1Δ与野生型细胞间的差异不显著(P>0.01). 此结果说明过表达SIK1干扰纺锤体在有丝分裂前期沿母-子细胞轴的排布,与相关报道一致[11].
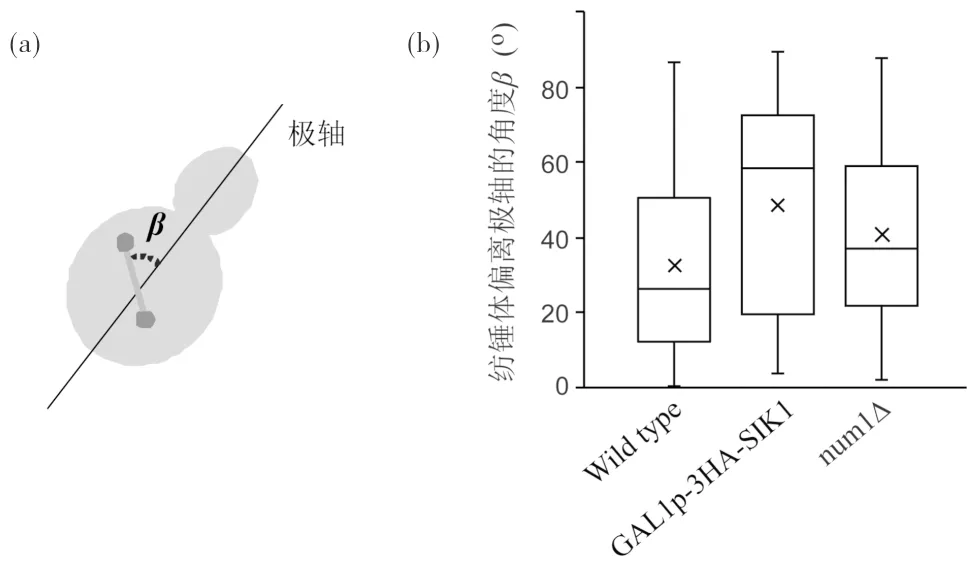
图3 过表达Sik1影响纺锤体沿母-子极轴的排布Fig.3 Overexpressing Sik1 affects the spindle alignmentalong the mother-bud axis of polarization(a)纺锤体偏离极轴示意图;(b) 不同菌株母细胞中的纺锤体偏离极轴的角度, 箱线图中的“x”表示平均值位置
观察各突变体细胞中的核分裂,num1Δ菌株显示了大量的双核细胞,这些细胞的母细胞中含有两个细胞核(图4(c)),其双核细胞的比率为16.4%(n=159). 野生型菌株中没有观察到双核细胞(图4(a),n=133). 在GAL1p-3HA-SIK1菌株中,从193个细胞中仅发现1个双核细胞(未显示),双核细胞比率为0.5%(注:图4b所示非双核细胞,右下角白色箭头所指细胞核为邻近细胞的细胞核). 此外,观察到num1Δ的双核细胞中母细胞体积变大,呈延长的椭圆形,且纺锤体在母细胞内部延长(图4(c)),而GAL1p-3HA-SIK1和野生型菌株中鲜有此形态的细胞,进一步证实这两个菌株没有或极少产生双核细胞. 上述结果表明,过表达SIK1导致纺锤体定位出现一定程度的缺陷,但不足以导致双核细胞的形成.
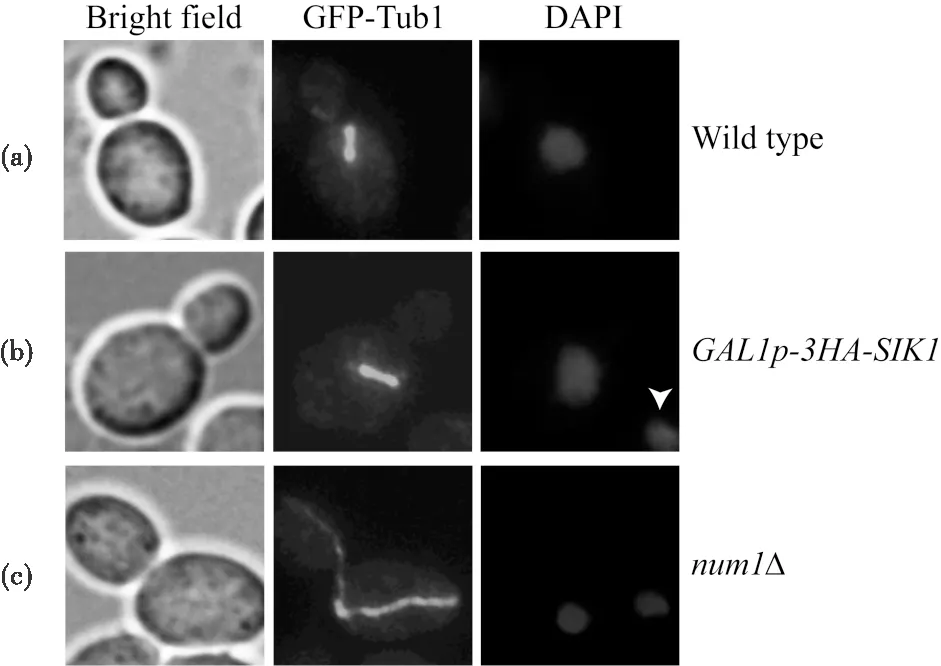
图4 各菌株中的纺锤体定位及核分裂Fig.4 Spindle orientation and nuclear division in the indicated strains(a) GFP-TUB1 (YWL1993 );(b) GAL1p-3HA-SIK1 GFP-TUB1 (YT139 );(c) num1Δ GFP-TUB1 (YT151)
2.3 Sik1蛋白与Kar9和Dynein通路的功能关系探索
在芽殖酵母中,控制纺锤体定位的两条通路(即Kar9和Dynein)如果同时缺失或异常,将导致细胞生长缓慢或不能生长[5,16]. 由于Sik1蛋白过表达对纺锤体定位有一定程度的干扰,为明确Sik1参与了哪一条通路,检测了过表达SIK1对NUM1缺失突变体或KAR9缺失突变体细胞生长的影响.
首先分别将kar9Δ或num1Δ单倍体菌株与GAL1p-3HA-SIK1单倍体菌株杂交,得到同时过表达SIK1和缺失NUM1(或KAR9)的菌株.
接下来将野生型、GAL1p-3HA-SIK1、num1Δ、GAL1p-3HA-SIK1num1Δ、kar9Δ、GAL1p-3HA-SIK1kar9Δ菌株分别培养至对数期,然后按浓度梯度滴种在含有半乳糖的培养基上以诱导GAL1p-3HA-SIK1的表达. 从图5(a)可以看出,培养于30 ℃时,这些菌株的生长状况相似,GAL1p-3HA-SIK1和num1Δ(或kar9Δ)的双突变体与各自的单突变体生长状况也相似,说明在正常生长温度条件(30 ℃)下,SIK1的过表达不影响kar9Δ和num1Δ细胞的生长.
最后,为了研究温度胁迫条件下过表达SIK1对kar9Δ和num1Δ细胞生长的影响,分别比较了各菌株在16 ℃和37 ℃的生长. 如图5(c) 所示,各菌株在37 ℃时的生长状态无明显差别. 但在16 ℃低温条件下,kar9Δ细胞的生长状况优于野生型及其他各组细胞(图5(b), 第5行).kar9ΔGAL1p-SIK1 双突变体的生长不及kar9Δ菌株(图5(b),第6和第5行),而num1ΔGAL1p-SIK1 双突变体的生长则略好于num1Δ单突变体(图5(b),第4和3行). 因此,在低温胁迫下,SIK1的过表达降低了kar9Δ细胞的活力,但却能使num1Δ细胞恢复部分活力. 这些结果表明,Sik1可能在Dynein/Num1通路中扮演角色.

图5 各菌株在不同温度下的生长Fig.5 Growth of indicated strains at different temperatures(a) 梯度稀释的细胞在30 ℃培养;(b) 梯度稀释的细胞在16 ℃培养;(c) 梯度稀释的细胞在37 ℃培养
3 讨论
Sik1蛋白是本实验室前期通过体外蛋白结合实验和质谱分析鉴定出的控制纺锤体定位的关键蛋白Num1的互作蛋白[12]. 已有报道和本研究均发现,过表达Sik1干扰纺锤体定位. 但本研究未能在过表达Sik1的菌株中检测到大量双核细胞. 可能有如下两个可能性:(1)过表达Sik1虽然导致纺锤体异常,但细胞由于某种原因(例如存在其他功能重叠的因子)得以在后期修复该异常,因而避免了双核细胞的产生;(2)Sik1蛋白过表达的水平不够高,不足以导致双核细胞的产生,本实验Western分析的结果支持这一可能性(图2). 后续研究中可能考虑相反的策略,即条件性限期灭活或降解Sik1蛋白检测其对核迁移的影响,以评价Sik1在核迁移中的作用.
过表达Sik1一定程度拯救了num1Δ细胞在16 ℃的生长,但却使kar9Δ细胞的生长变差. 这个结果进一步证明Sik1在纺锤体定位中扮演了一定角色,且有可能与Num1具有协作功能,更详细的作用机制有待进一步研究.
