基于80例晚期胃癌患者的临床资料构建晚期胃癌人群类别预测的判别模型
2021-06-24吴朝旭王玥李潇南梦蝶谢美雯刘常玉尹亚南侯丽
吴朝旭 王玥 李潇 南梦蝶 谢美雯 刘常玉 尹亚南 侯丽


摘要 目的:基于80例接受中西醫结合治疗的晚期胃癌患者的临床资料,初步构建晚期胃癌人群类别预测的判别模型。方法:选取2016年12月1日至2018年12月31日来北京中医药大学东直门医院、北京桓兴肿瘤医院、北京三环肿瘤医院就诊的晚期胃癌患者80例作为研究对象,观察随访患者生存时间、一般资料、临床相关资料等,以确诊Ⅳ期后的生存时间为因变量,其他与生存时间相关的变量作为自变量建立Cox模型,筛选具有统计学意义的预后预测因素,并结合前期制定的中医受益人群、非受益人群、中间人群的划分标准,构建晚期胃癌人群类别预测的判别模型。结果:截至2018年12月31日,共纳入80例晚期胃癌患者,死亡62例,脱落18例。构建的线性判别模型对57位患者的类别预测完全正确,总的预测准确率为71.25%。其中,非受益人群的预测准确率最高,为83.33%,其次为受益人群、中间人群,分别为81.08%、59.46%。结论:拟合的线性判别模型对受益人群和非受益人群的识别率较高,对于临床治疗和患者预后的识别具有一定的参考价值。
关键词 胃癌;远处转移;中西医结合;临床资料;受益人群;预测模型;线性判别;生存时间
Establishment of a Discriminant Model for Predicting the Classification of Advanced Gastric Cancer,Based on the Clinical Data of 80 Patients with Advanced Gastric Cancer
WU Chaoxu,WANG Yue,LI Xiao,NAN Mengdie,XIE Meiwen,LIU Changyu,YIN Yanan,HOU Li
(Department of Hematology and Oncology,Dongzhimen Hosptial,Beijing University of Chinese Medicine,Beijing 100700,China)
Abstract Objective:Based on the clinical data of 80 patients with advanced gastric cancer treated with integrated traditional Chinese and Western medicine,this paper attempts to construct a discriminant model for predicting the population type of advanced gastric cancer.Methods:A total of 80 patients with advanced gastric cancer admitted to Dongzhimen Hospital,Beijing University of Chinese Medicine,Beijing Huanxing Cancer Hospital,Beijing Sanhuan Cancer Hospital were selected as the research objects.The patients′ survival time,general data,and clinical related data were observed and followed up.The survival time after diagnosis of stage Ⅳ was used as the dependent variable,and other variables related to survival time were used as independent variables to establish a Cox model to screen for statistically significant prognostic predictors.Combining with the classification standards of TCM beneficiaries,non-beneficiaries,and intermediate populations formulated in the previous stage,a discriminant model for the prediction of the population of advanced gastric cancer was constructed.Results:As of December 31,2018,a total of 80 patients with advanced gastric cancer were adopted,with 62 deaths,and 18 cases of loss.The linear discriminant model was correct for 57 patients,and the overall prediction accuracy was 71.25%.Among them,the prediction accuracy of non-beneficiary group was the highest (83.33%),followed by beneficiary group (81.08%) and middle group (59.46%).Conclusion:The fitted linear discriminant model has a high recognition rate for the beneficiary and non-beneficiary groups,and has a certain reference value for clinical treatment and patient prognosis.
Keywords Gastric Cancer; Distant metastasis; Integrated Chinese and Western medicine; Clinical data; Beneficiary population; Prediction model; Linear discriminant; Survival time
中图分类号:R242文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.03.007
胃癌是我国最常见的恶性肿瘤之一。根据国家癌症中心2019年公布的数据,胃癌高居我国男性恶性肿瘤发病率的第2位、女性恶性肿瘤的第5位;死亡率分别居第3位、第2位[1]。由于起病隐匿以及大规模普查的缺失,我国早期胃癌的检出率不足10%[2],这预示大多数患者在确诊时已失去了最佳的手术时机。目前,晚期胃癌的内科治疗尚未取得明显突破,中位生存期仍在1年左右。因此,充分发挥现有各种治疗手段的优势,对于提高患者的生命质量,乃至延长患者的生存时间具有重要意义。中医药是我国医疗卫生事业的重要组成部分,现已基本明确其具有延长带瘤生存期、提高生命质量等疗效,在胃癌综合治疗发挥着重要作用。在精准医疗推进的大背景下,积极识别与预测中西医结合治疗的受益人群有助于指导临床治疗,及时调整治疗方案,帮助患者更多的获益。
1 资料与方法
1.1 数据来源
选取2016年12月1日至2018年12月31日来北京中医药大学东直门医院、北京桓兴肿瘤医院、北京三环肿瘤医院就诊的晚期胃癌患者80例作为研究对象。
1.2 诊断标准
参照WHO(2010年)《消化系统肿瘤分类》胃癌定义进行诊断;TNM分期诊断标准参照AJCC 7th edition胃癌TNM分期;证候要素参考《恶性肿瘤中医诊疗指南》[3]。
1.3 纳入标准 1)病理诊断为胃癌;2)TNM分期为Ⅳ期;3)年龄≥18岁;4)入组时卡氏评分≥60分;5)已连续接受至少一个月的中药辨证治疗,并愿继续接受中医药治疗;6)预计生存期大于3个月;7)自愿接受本研究并签署知情同意书,可配合随访。
1.4 排除标准 1)患有2种及以上的原发恶性肿瘤;2)心、肺、肝、肾等主要脏器存在严重的非肿瘤性疾病和功能障碍、活动性脑血管病变、不受控制的感染和代谢性疾病;3)患者不能或拒绝服用汤药,需要静脉营养;4)孕妇、哺乳期妇女、精神疾病患者;5)研究者认为其他不适于参加本项临床研究的情况。
1.5 观察指标 1)生存时间:患者死亡或脱落前最后一次成功随访的日期减去确诊Ⅳ期时的日期。2)资料收集:a.一般资料:包括性别、年龄、BMI等;b.临床资料:包括KPS评分、既往内科疾病病史(糖尿病)、肿瘤相关资料(病理类型、分化程度、肿瘤原发灶、转移灶与肿瘤负荷、治疗方法)、辅助检查(血红蛋白、血清白蛋白)等;c.中医临床信息:包括证候要素、中医治疗时间等。
1.6 人群类别的界定
参照杨宇飞教授晚期结直肠癌中医优势人群的概念[4]初步定义晚期胃癌中西医结合治疗的人群类别。受益人群:接受现代医学规范化治疗与同步中医药治疗后,生存期超过循证医学证据下中位生存期的晚期胃癌患者。非受益人群:接受现代医学规范化治疗与同步中医药治疗后,生存期低于最佳支持治疗中位生存期的晚期胃癌患者。介于受益人群与非受益人群之间者为中间人群。观察组以2010年ToGA研究中单纯化疗组的中位生存期11.1个月作为“循证医学证据下的中位生存期”[5],并根据文献报道将晚期胃癌最佳支持治疗的中位生存期确定为4个月[6]。据此将入组患者分为“受益人群组”(Ⅳ期生存时间≥11.1个月)、“非受益人群组”(Ⅳ期生存时间≤4个月)和“中间人群组”(4个月<Ⅳ期生存时间<11.1个月)。
1.7 统计学方法
研究采用R软件(Version 3.6.1)进行统计分析。检验水准α=0.05。使用R语言的“surv_cutpoint”函数确定连续型变量的最佳截断值,并转换为二分类变量纳入回归模型;使用“survival”包进行单因素Cox回归分析,将具有统计学意义的预后预测因素用以構建晚期胃癌中西医结合治疗人群类别预测的线性判别模型。
2 结果
2.1 一般资料
截至2018年12月31日,80例患者共死亡62例,脱落18例,生存时间为1.7~28.9个月,中位Ⅳ期生存时间11.6个月。80例患者年龄分布为23~94岁,中位年龄59.5岁;其中男54例,女26例。KPS评分以80分及以上患者为主,共计55例。胃内原发灶以近端胃为主,共36例,其次为胃体22例、远端胃13例、全胃7例、残胃2例。病理类型以腺癌为主(含黏液腺癌),共计68例,其次为印戒细胞癌10例,鳞癌、腺鳞癌各1例。远处转移灶以淋巴结转移最为常见,共有38例,其次为肝转移28例、腹膜转移15例、骨转移8例、肺转移7例、其他部位转移14例。证候要素分为内虚证素和邪实证素,前者以气虚证为主,共75例,其次为阴虚证18例、阳虚证11例、血虚证10例;邪实证素中以痰湿证为主,共56例,其次为血瘀证33例、气滞证23例。
2.2 判别模型预测变量的筛选
以生存时间为因变量,以资料收集中的相关因素为自变量进行单因素Cox回归分析,结果显示更高的BMI指数和KPS评分、中-高分化、接受二线及后续治疗、接受中医药治疗3个月及以上是预后相关的保护性因素;患有糖尿病、印戒细胞癌、血红蛋白≤94 g/L、血清白蛋白≤38.2 g/L是预后相关的危险因素。具体结果见表1。中医证素(气虚证、血虚证、阴虚证、阳虚证、气滞证、痰湿证、血瘀证)与预后的分析中,具有某证素的患者与不具有该证素的患者之间均无统计学意义。
2.3 判别模型
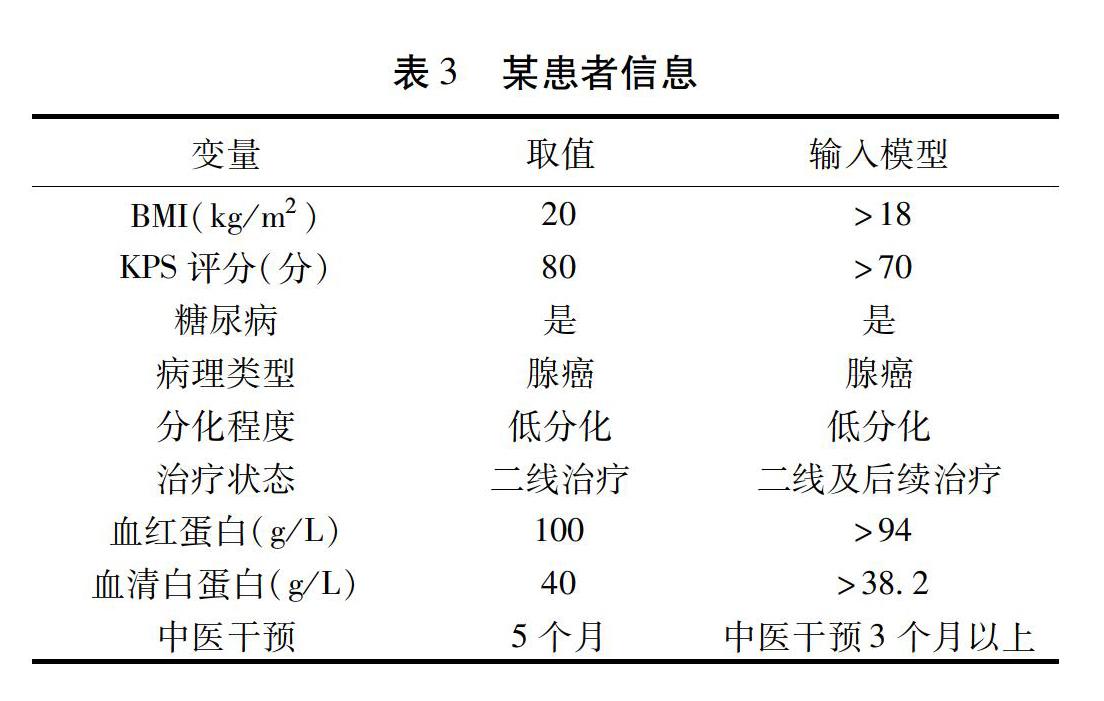
根据人群类别的定义,80例患者中受益人群37例,非受益人群6例,中间人群37例。将单因素Cox回归模型中P<0.05的变量纳入线性判别分析,变量包括BMI、KPS评分、糖尿病史、病理分型、分化程度、治疗状态、血红蛋白、人血白蛋白和中医干预时间。结果显示:构建的线性判别模型对57位患者的类别预测完全正确,总的预测准确率为71.25%。其中,非受益人群的预测准确率最高,为83.33%,其次为受益人群、中间人群,分别为81.08%、59.46%。模型对受益人群和非受益人群的识别率较高。判别模型的混淆矩阵见表2。对于构建好的判别模型,输入某患者的信息如表3,最终将识别该患者是受益人群,相应的概率为82%。
3 讨论
此次研究基于80例晚期胃癌患者的临床资料训练判别分析模型,并用总体准确度评价模型的预测效果。在将来得到新的患者数据时,只需将相应自变量信息按对应编码方式输入,模型便可自动判别该患者是否属于受益人群以及对应的概率。此次拟合的線性判别模型对受益人群和非受益人群的识别率较高,总体准确度略显不足,这可能与以下两方面原因相关:一是纳入判别分析模型的因素与人群类别之间不是简单的线性关系;二是由于样本量的限制,只能拟合简单的线性模型。在研究过程也尝试采用二次判别分析,但由于非受益人群组仅6人,不足以完成模型拟合而告失败。同时,此次研究是基于生存时间划分人群类别,但对于晚期患者而言,生命质量的改善与生存时间的延长同样重要,同时中医药治疗对于改善症状、提高生命质量具有较为明显的优势[7-8]。因此,单纯依据生存时间定义受益人群可能无法充分反映中医药治疗的优势。因此,此次构建的人群类别预测模型仍有待于从多方面进行优化。
此次研究的单因素Cox回归分析结果显示更高的BMI指数、更高的KPS评分、中-高分化、接受二线及后续治疗和接受中医药治疗3个月及以上是预后相关的保护性因素;而罹患糖尿病、印戒细胞癌、更低的血红蛋白和人血白蛋白则是预后相关的危险因素。这一结果与目前对晚期胃癌预后因素的认识基本吻合。
研究显示患有糖尿病的胃癌患者具有更高的死亡风险[9],而肥胖则更多呈现出对胃癌预后的保护效应[10]。两者同属于代谢综合征的范畴[11-12],是多种恶性肿瘤发生发展的危险因素,但在晚期胃癌的预后中却表现出相左。这一差别的产生可能是由于对于晚期胃癌患者而言,营养的重要性进一步凸显,较多的脂肪、肌肉组织起着营养储备的作用,在抗癌治疗期间,具有支持患者完成治疗的优势,间接转换为生存优势。但这并非是对肥胖的鼓励。进一步研究显示,肥胖只有当肌肉减少症不存在时才预示着更高的存活率[13]。
多个研究证实了二线或后续治疗具有延长晚期胃癌生存期的价值[14-17]。预后分析也显示:PS评分、血红蛋白和一线化疗后的中位进展时间与预后明显相关[18-19]。因此,在保障早期治疗疗效的前提下,选择毒性较低的药物用于一线治疗,这对于保持患者的体能状态,争取到接受二线或后线治疗的机会是十分必要的。
中医干预3个月以上同样显示出对预后的保护效应,但在中医证素(气虚证、血虚证、阴虚证、阳虚证、气滞证、痰湿证、血瘀证)与预后的单因素Cox分析中,具有某证素的患者与不具有该证素的患者之间无统计学意义。曲爱洋等[20]研究显示证型是进展期胃癌预后的相关因素,但由于部分证型的例数过少,影响了该结论的可靠性。类似的支持证型与预后相关的结论也见于结直肠癌的研究中[21-22]。基础研究显示化疗药物对气血亏虚型患者的胃癌细胞抑制率最低,表现为不敏感甚至耐药,且与肝胃不和组、痰食瘀阻组患者的胃癌细胞比较差异有统计学意义(P<0.05)[23]。这提示不同证型的患者可能存在化疗疗效的差异,但这一差异是来源于中医证素(型)本身,还是由于证素(型)混杂了其他因素的作用,目前尚缺乏足够的研究报道,中医证素(型)与晚期胃癌预后的相关性仍需要进一步探究。
4 结论
综上所述,此次拟合的线性判别模型对受益人群和非受益人群的识别率较高,对于临床治疗和患者预后的识别具有一定的参考价值,但仍需要从完善受益人群概念、扩大样本量等多方面进行优化,以提高预测模型的准确性和实用价值。
参考文献
[1]郑荣寿,孙可欣,张思维,等.2015年中国恶性肿瘤流行情况分析[J].中华肿瘤杂志,2019,41(1):19-28.
[2]廖专,孙涛,吴浩,等.中国早期胃癌筛查及内镜诊治共识意见(2014年4月·长沙)[J].胃肠病学,2014,19(7):408-427.
[3]林洪生.恶性肿瘤中医诊疗指南[S].北京:人民卫生出版社,2014.
[4]徐钰莹.真实世界68例晚期结直肠癌中医优势人群特征与基因突变动态趋势分析[D].北京:北京中医药大学图书馆,2018.
[5]Bang YJ,Van Cutsem E,Feyereislova A,et al.Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer(ToGA):a phase 3,open-label,randomised controlled trial[J].The Lancet,2010,376(9742):687-697.
[6]Kang JH,Lee SI,Lim DH,et al.Salvage Chemotherapy for Pretreated Gastric Cancer:A Randomized Phase Ⅲ Trial Comparing Chemotherapy Plus Best Supportive Care With Best Supportive Care Alone[J].Journal of Clinical Oncology,2012,30(13):1513-1518.
[7]段连香,郑坚,赵爱光,等.中医药辨证治疗对老年晚期胃癌预后影响的同期对照研究[J].肿瘤学杂志,2018,24(8):800-807.
[8]曹妮达,赵爱光,杨金坤.中西医结合治疗晚期胃癌生存期分析[J].中西医结合学报,2010,8(2):116-120.
[9]Smyth EC,Capanu M,Janjigian YY,et al.Tobacco use is associated with increased recurrence and death from gastric cancer[J].Annals of Surgical Oncology,2012,19(7):2088-2094.
[10]Lee JH,Park B,Joo J,et al.Body mass index and mortality in patients with gastric cancer:a large cohort study[J].Gastric Cancer,2018,21(6):913-924.
[11]Esposito K,Chiodini P,Colao A,et al.Metabolic syndrome and risk of cancer:a systematic review and meta-analysis[J].Diabetes Care,2012,35(11):2402-2411.
[12]Samson SL,Garber AJ.Metabolic syndrome[J].Endocrinology and Metabolism Clinics,2014,43(1):1-23.
[13]Gonzalez MC,Pastore CA,Orlandi SP,et al.Obesity paradox in cancer:new insights provided by body composition[J].The American Journal of Clinical Nutrition,2014,99(5):999-1005.
[14]Thuss-Patience PC,Kretzschmar A,Bichev D,et al.Survival advantage for irinotecan versus best supportive care as second-line chemotherapy in gastric cancer-a randomised phase Ⅲ study of the Arbeitsgemeinschaft Internistische Onkologie(AIO)[J].European Journal of Cancer,2011,47(15):2306-2314.
[15]Ford HE,Marshall A,Bridgewater JA,et al.Docetaxel versus active symptom control for refractory oesophagogastric adenocarcinoma(COUGAR-02):an open-label,phase 3 randomised controlled trial[J].The Lancet Oncology,2014,15(1):78-86.
[16]Fuchs CS,Tomasek J,Schwartz JD,et al.Ramucirumab monotherapy for pre-viously treated advanced gastric or gastro-oesophageal junction adenocar-cinoma(REGARD):an international,randomised,multicentre,placebo-controlled,phase 3 trial[J].Lancet,2014,383(9911):31-39.
[17]Li J,Qin S,Xu J,et al.Randomized,double-blind,placebo-controlled phase Ⅲ trial of apatinib in patients with chemotherapy-refractory advanced or metastatic adenocarcinoma of the stomach or gastroesophageal junction[J].Journal of Clinical Oncology,2016,34(13):1448-1454.
[18]Hasegawa H,Fujitani K,Nakazuru S,et al.Optimal indications for second-line chemotherapy in advanced gastric cancer[J].Anti-Cancer Drugs,2012,23(4):465-470.
[19]Kanagavel D,Pokataev IA,Fedyanin MY,et al.A prognostic model in patients treated for metastatic gastric cancer with second-line chemotherapy[J].Annals of Oncology,2010,21(9):1779-1785.
[20]曲愛洋,殷东风,高宏.中医辨证分型与进展期胃癌患者预后相关性研究[J].亚太传统医药,2018,14(5):101-103.
[21]徐钰莹,张文丽,杨宇飞,等.晚期结直肠癌中医药干预治疗疗效预测模型的建立与应用[J].世界科学技术-中医药现代化,2019,21(7):1518-1524.
[22]孙凌云,张达,郝洁,等.晚期结直肠癌患者中医证型、中医体质与生存结局相关性分析[J].中国中西医结合杂志,2017,37(9):1059-1062.
[23]王冰,杨宇,臧文巧,等.胃癌不同证型与化疗敏感性研究[J].中华中医药学刊,2016,34(7):1565-1568.
(2021-01-05收稿 责任编辑:徐颖)
