银纳米簇抗菌机理、活性及其应用的研究进展
2021-06-23龚晓惠杨敏李舒婷林晟豪许文涛
龚晓惠 杨敏 李舒婷 林晟豪 许文涛,2
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.农业农村部农业转基因生物安全评价(食用)重点实验室,北京 100083)
抗生素耐药性是人类健康的重大威胁之一,研制新型低成本、抗菌效力高且不致耐药性的抗菌替代品是重要的攻克方向,银因其抗菌沿用历史已久,一直是技术革新的重要应用对象。如今纳米技术的发展已经实现了银基抗菌剂从银纳米粒子(AgNPs)到银纳米簇(AgNCs)形式的跨越,这种物质尺度上的缩小不仅使AgNCs表现出更出色的抗菌活性,还使其表现出一些特殊的物化性质,可拓宽其应用领域。
纳米级金属大致分为3个尺寸域:大纳米颗粒、小纳米颗粒和簇。当粒径与第三特征长度(电子的费米波长)相当时,即位于第三尺寸域“簇”时,其光学、电子和化学性质与另外两种尺寸截然不同[1]。AgNCs可理解为核心尺寸小于2 nm的超小型AgNPs,其以“可数”的Ag原子作为核心,并受到一定数量的配体保护,但表现出比AgNPs更高效的抗菌作用[2]。关于AgNPs的抗菌机理研究已经较为完善成熟,但更小尺度的AgNCs抗菌机理仍有待进一步研究。
银纳米簇的抗菌活性受到自身理化性质、作用的微生物类型、参与保护的配体种类、其他协同抗菌物质及细胞毒性限制等因素的影响。目前基本上任何一种新形式的抗菌银纳米簇在研发时都需要综合考虑这些因素,既实现抗菌高效性又保证抗菌安全性。DNA银纳米簇因其序列可调控、银离子缓释、高效持久抗菌及低毒性等特点而表现出十分广阔的应用前景。
本文主要结合所查阅文献对AgNCs的抗菌机理、抗菌活性的影响因素和抗菌材料的应用进行初步的归纳,并对具有广泛应用前景的DNA银纳米簇进行了抗菌方面的总结。希望能为相关研究提供建议和方向,完善抗菌机理的体系,开发出更多抗菌活性可调控、生物相容性高的AgNCs,为多样化的实际应用奠定基础。
1 银纳米簇概述
金属纳米簇是指由几个到几十个金属原子组成、粒径小于2 nm、性质介于单个原子和纳米粒子之间的纳米团簇。其尺寸与电子的费米波长相当,表现出类分子的离散能级分布,可通过能级间电子跃迁实现与光的相互作用,产生强烈的光吸收和尺寸依赖性荧光发射[1,3-5]。近年来金属纳米团簇的研究较多集中于金和银纳米簇,尤其是银。
AgNCs定义明确的分子结构、离散的电子能级、定量电荷和强发光等物化性质及超小尺寸、良好的生物相容性使其在生物成像、生物传感、抗菌剂和癌症治疗等生物医学领域中应用广泛[6]。银纳米团簇粒径微小,粒子间会产生强烈相互作用而不可逆地聚集,一般以保护的配体作为其适当的稳定支架,包括有机配体、小分子物质、含巯基化合物、树形大分子聚合物、其他聚合物分子以及生物大分子等[7]。
2 抗菌机理
目前已有较多关于AgNPs的抗菌能力的研究,抗菌机制的阐明较为清晰。但极小的AgNCs用于抗菌的报道较少,抗菌机制尚未得到充分阐明。
2.1 AgNPs
AgNPs不仅可以黏附在细胞壁和细胞膜表面上导致外膜结构损伤和功能障碍,引发胞壁凹坑、膜穿孔、细胞膜通透性增加、膜骨架无序化、自由基诱导膜损伤、膜成分溶解分散、细胞内容物泄露以及跨膜呼吸衰竭和H+泄漏等一系列过程[8-12]。而且可以渗透进入细胞内部破坏亚细胞结构,扰乱功能代谢[2],如破坏细胞器(线粒体、液泡和核糖体)和生物分子(蛋白质、脂质和DNA),产生活性氧自由基诱导细胞毒性及氧化应激反应,影响信号传导途径[8](图1)。

图1 AgNPs抑菌作用模式图[13]Fig.1 Routes of antibacterial action of AgNPs
2.2 AgNCs
理论上,AgNCs与微生物细胞壁、细胞膜及亚细胞结构的作用机理可能与AgNPs有很大部分的重合。但是,尺度的微小也赋予其特殊的性能,这可能直接影响到AgNCs粒子进入细菌的跨膜运输方式及渗透速度。极高的比表面积一方面可以加快AgNCs表面Ag原子氧化释放Ag+的速率,使大量Ag+快速集中地到达细菌;另一方面可以加大AgNCs与微生物特定结构的相互作用程度、加快产生活性氧及其他生物化学反应进程。
目前关于AgNCs的抗菌研究多以大肠杆菌和金黄色葡萄球菌作为革兰氏阴性和阳性代表菌株,少量涉及到白色念珠菌作为抑菌对象,并且缺乏对抗菌机理的深入研究。Li等[14]合成了核黄素保护的AgNCs(RF-AgNCs),提出其抑菌机理可能是破坏了细胞膜的完整性及诱导细胞内部产生了较多的活性氧。Jin等[15]研究了二氢硫辛酸(dihydrolipoic acid,DHLA)保护的AgNCs对革兰氏阴性细菌的抗菌机制(图2),提出AgNCs主要通过破坏外层细胞膜及渗透进入胞内抑制大肠杆菌DH5α的生长,通过孔蛋白通道扩散抑制大肠杆菌DSM 4230生长。内化的AgNCs及其氧化释放的银离子与DNA作用,抑制遗传物质复制;与蛋白质的-SH相互作用,干扰其正常功能;与细胞膜上呼吸链作用,阻断呼吸。
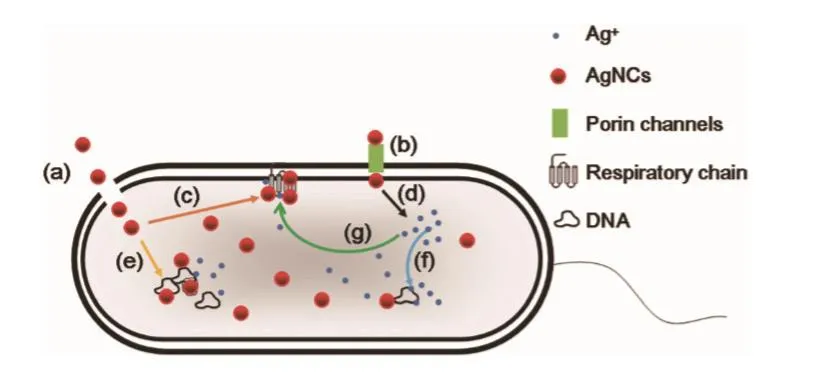
图2 AgNCs对大肠杆菌的抑菌机制示意图[15]Fig.2 Schematic diagram of antibacterial mechanism of AgNCs against Escherichia coli
3 影响抗菌活性的因素
3.1 理化性质
3.1.1 尺寸及表面带电性 AgNPs的尺寸进一步缩小至AgNCs的形式可以提高其杀菌性能。在杀死大肠埃希氏菌方面,AgNCs优于具有相同Ag浓度的AgNPs[16]。与AgNPs相比,超小型AgNCs的比表面积大,可以更快地释放更多数量的Ag+,增强杀菌性能。
Xu等[17]用0.6 kD-25 kD的聚乙烯亚胺(PEI)分子合成了一系列PEI-AgNCs,小分子量PEI形成的小直径PEI-AgNCs复合物,具有更多与细菌碰撞的机会,并将更快地扩散。而且由于PEI带正电荷,PEI-AgNCs容易在带负电的细菌表面上被吸收和富集。
3.1.2 氧化态 相比于低价态的银,高价态银的还原势极高,更易使周围空间产生活性氧,产生更高的抗菌活性[18]。Yuan 等[19]以谷胱甘肽(glutathione,GSH)作为配体合成了GSH-Ag+-RNCs和GSH-Ag0-RNCs,二者具有相同的粒径分布和表面配体,只是Ag的氧化态不同。对于铜绿假单胞菌、大肠杆菌(G-)、枯草芽孢杆菌和金黄色葡萄球菌(G+),GSHAg+-RNCs都具有比对照物GSH-Ag0-RNCs高很多的抗微生物活性。若在严格的厌氧条件下,Ag0将不能被氧化成Ag+,从而使AgNCs失去抗菌能力。
3.2 微生物类型
Farrag等[20]制备了L-GSH还原保护的1 nm大小的 Agn(SG)m,超小尺寸的 Agn(SG)m与光接触的表面积大大增加,产生了更多的自由基和活性氧,造成菌的死亡。实验中测试的革兰氏阳性细菌(金黄色葡萄球菌、蜡状芽孢杆菌、黄球微球菌)对Agn(SG)m的抵抗力更高,革兰氏阴性细菌(铜绿假单胞菌、大肠杆菌和黏液链球菌)抵抗程度更低。DHLA-AgNCs也表现出了对革兰氏阴性细菌更强的抑制作用[15]。
革兰氏阴性细菌和阳性细菌之间的差异可能与细胞壁结构组成有关,革兰氏阴性菌的细胞壁最外层是脂多糖,肽聚糖层(7-8 nm)较薄;革兰氏阳性菌的细胞壁肽聚糖含量更高,厚(20-80 nm)且致密,比革兰氏阴性细菌细胞壁强度和硬度都更高,银纳米簇更难实现锚定和穿透进入胞内。另外,革兰氏阴性细菌在细胞壁中包含脂多糖(lipopolysaccharide,LPS),LPS的负电荷会促进Ag的黏附,表现出更强的敏感性[21]。
Agn(SG)m显著抑制土壤真菌总量的增长,浓度范围为125 μg/mL-1 000 μg/mL的水溶性Agn(SG)m对细菌的抑制作用强于真菌。纳米银的抗真菌作用归因于其影响分生孢子萌发、抑制菌丝体生长[22]及改变细胞膜通透性等。较高浓度的Agn(SG)m(8.0 mg/L)可以抑制大多数霉菌的生长。除尖孢镰刀菌外,被测真菌(白色念珠菌、黄曲霉菌、红曲霉菌)都显示出较弱的抗Agn(SG)m作用。
3.3 配体种类
除了其固有的抗微生物特性外,AgNCs的表面配体还可以调整以进一步增强抗微生物能力。AgNCs的制备经历了无模板、硬模板和软模板3个演化阶段,硬模板包括无机玻璃和沸石,软模板包括脱氧核糖核酸(deoxyribonucleic acid,DNA)、蛋白质、肽、树状聚合物等长链分子和一些有机小分子,大多涉及到碱基、巯基、羧基与Ag的相互作用力[23]。
目前已经开发了许多受不同配体保护的抗 菌 AgNCs, 包 括 DNA[24-26]、 聚 乙 烯 亚 胺(polyethylenimine,PEI)[17,27]、谷胱甘肽(GSH)[28-29]、二氢硫辛酸(dihydrolipoic acid,DHLA)[15]、羧甲基 -β-环糊精(CM-β-CD)[16]、硫普罗宁(tiopronin)[30]、硫醇封端的磷酸胆碱(PC-AgNCs)[31]、核黄素(riboflavin,RF)[14]、壳聚糖(chitosan)[32]和杆菌肽(bacitracin)[33]等配体,其中一些在杀死细菌方面显示出很高的效率。调节AgNCs表面配体为调整它们与细菌的相互作用及控制Ag+的释放速率提供了可行性。
3.4 协同抗菌物质
将AgNCs和达托霉素偶联开发的杂合抗菌剂继承了两种杀菌物质固有的特性,显示出高效的协同杀菌作用。杂合结构内的局部达托霉素可有效破坏细菌膜,局部AgNCs可产生ROS氧化细菌脂质双层,加剧膜损伤,反过来进一步使更多的D-AgNCs进入细菌并在胞内产生局部高ROS浓度,引起严重的DNA损伤,产生高效杀灭作用[34]。
以有机光敏染料玫瑰孟加拉红(rose bangel,RB)与AgNCs合成复合纳米材料,经白色二极管(light emitting diode,LED)照射,由RB释放单线态氧、AgNCs释放Ag+,可显著降低变形链球菌、牙龈卟啉单胞菌和放线共生放线杆菌的细菌浊度,且具有低细胞毒性,促进了口腔治疗领域抗菌光动力疗法的发展[35]。
3.5 细胞毒性
哺乳动物模型体内生物分布和毒性研究表明,AgNPs进入体内可能会对肝、肾、脾、脑和肺等多个靶器官产生毒性[36-39]。哺乳细胞体外研究发现,AgNPs能够干扰细胞功能并引起毒性作用,包括DNA损伤、细胞凋亡以及诱导细胞内产生活性氧等[40-46]。
高抗菌活性必定增加细胞毒性风险,这也是限制其发挥抗菌活性的重要因素。AgNCs毒性控制的优越性有两方面,超小尺寸(<2 nm)在体内具有快速的肾清除率[47],配体调整可以实现Ag+初始快速释放、随后持续平稳低浓度释放。
Ag+的释放是AgNCs杀菌的重要机制,高剂量Ag+会引起严重的细胞毒性。建立缓慢的银离子释放机制,使Ag+浓度维持在发挥抗菌活性同时不引发细胞毒性的安全有效范围内是关键。AgNCs极大的比表面积为外围的配体提供了很好的固定空间,通过配体带电性、分子量大小、化学性质等的调整,可以调控Ag+释放量及释放速率,从而实现细胞低毒无毒。Chandirasekar等[48]合成的胆酸钠保护的AgNCs(200 μL/mL)未对斑马鱼胚胎产生可观察到的毒性。DHLA-AgNCs(0-100 μg/mL)对人胃上皮细胞GES-1细胞没有明显的毒性[15]。Yang等[26]制备的“Y-X”形状的超级AgNC对293T(人类胚胎肾细胞)、SMCs(血管平滑肌细胞)和GLC-82(肺腺癌细胞)3种组织细胞均表现出低毒性。
另外,若配体本身生物相容性高也可以极大地减小AgNCs细胞毒性,如谷胱甘肽、磷酸胆碱、核黄素等物质。PC-AgNCs在100 μg/mL浓度范围内,所有细胞形态均良好,没有明显的细胞毒性[31]。核黄素配体保护的银纳米簇处理人红细胞没有溶血现象,24 h和48 h孵育后对HUVE(人脐静脉内皮细胞)或HK-2(人肾近曲小管上皮细胞)的增殖均无明显影响[14]。
4 AgNCs应用载体
4.1 有机纳米材料
将纳米纤维素膜简单浸入受聚甲基丙烯酸(polymethacrylic acid,PMAA)保护的AgNCs溶液中,PMAA与纳米纤维素或残留的半纤维素以氢键方式结合,在水性介质中释放,可实现阻止细菌在比薄膜面积大5倍的表面积范围内生长,应用于伤口愈合垫[49];在丝纤维上通过紫外线诱导原位合成AgNCs,得到荧光性AgNCs复合丝纤维,适用于大多数天然和人造纤维,在荧光服装、防伪标签和抗菌材料的应用中很有前景[50];通过射频共溅射技术将不同厚度的抗菌银纳米簇/二氧化硅复合层均匀地涂覆在Kevlar®织物上,可大大降低微生物在涂层表面的粘附。高性能纺织品在航空航天领域广泛使用,能避免航天器和轨道站在长时间的太空探索任务中受到微生物污染[51]。
以原位合成方法制备包埋在壳聚糖-聚乙二醇(CS-PEG)膜中的AgNCs(图3),可以阻碍大肠杆菌和金黄色葡萄球菌生物膜形成,AgNCs含量影响膜的孔隙率和机械强度,使抗炎药萘普生在体外可持续释放24 h。AgNCs浸渍的CS-PEG膜将抗菌活性、生物相容性与局部药物递送相结合,是一种具有广泛应用前景的可植入多功能设备[52]。
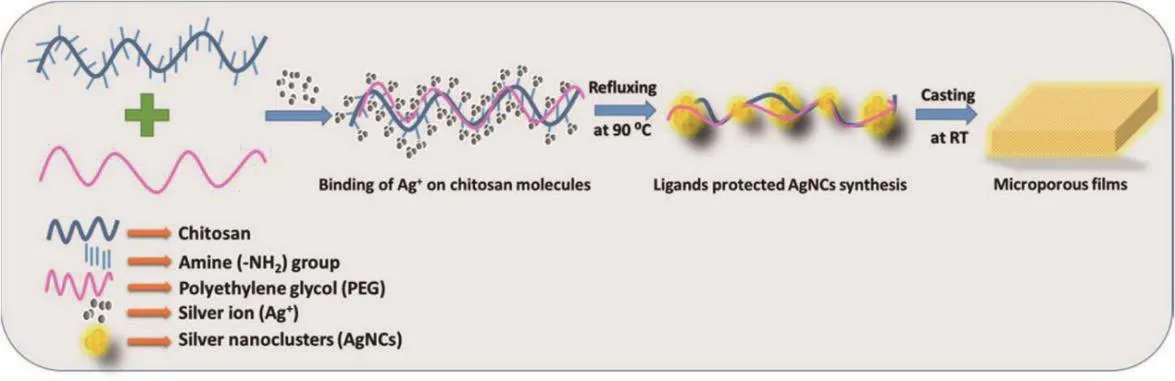
图3 AgNCs在微孔CS-PEG膜中原位浸渍示意图[52]Fig.3 Schematic diagram of in situ impregnation of AgNCs in microporous CS-PEG membranes
将GSH-AgNCs与膜的聚酰胺表面化学结合,可以得到高效的抗菌正向渗透膜,可应用于海水淡化及水资源净化领域[53];将AgNCs掺入玉米醇溶蛋白膜中,形成的新型涂料具有高抗菌活性,应用于食品包装材料具有巨大潜力[54];石璐等和马芸[55-56]以巯基化合物(L-半胱氨酸)为保护剂,通过紫外光还原法将银纳米簇一步合成在由L-半胱氨酸自组装形成的水凝胶中,可有效抑制砧板上的杂菌。呈凝胶状态的银纳米簇水凝胶使用便捷,易被流水冲洗,可应用于餐具消毒剂。银娜等[57]提出AgNCs应用于食品包装涂层不仅可以利用其荧光性检测诸如产毒真菌及毒素、金属离子以及食源性致病菌等污染物,还可以发挥抗菌作用,延长食品保质期。
4.2 无机纳米材料
Lu等[58]通过一锅微乳液法合成包覆银纳米团簇的二氧化硅纳米球(Ag-SiO2),水溶液中银离子不断从二氧化硅球中释放出来,48 h培养期间完全抑制了革兰氏阴性大肠杆菌和革兰氏阳性金黄色葡萄球菌的生长。未来可以期待这种高效的抗菌杂化无机材料找到潜在的临床和环境应用形式。
Patil等[59]在光化学辐射下利用人参果果皮提取物作为还原剂合成了石墨烯银纳米复合材料(rGO@AgNCs),其对牙齿病原体短小芽孢杆菌、铜绿假单胞菌、粪肠球菌、大肠杆菌和金黄色葡萄球菌等都有一定的抑制作用,可以作为牙齿病原体的优异抗菌剂。
5 DNA银纳米簇
具有强大分子可编程性的DNA是调节AgNCs的理想支架,抗菌活性与核苷酸序列、DNA二级结构、荧光体颜色、稳定性等有一定的关联,但相关研究较少,规律性有待进一步探索。Javani等[24]用9种不同序列及长度的寡核苷酸合成DNA-AgNCs发现,其抗菌活性与寡核苷酸的序列有关。以最佳抗菌活性序列合成的三聚体可以在亚微摩尔范围内抑制革兰氏阳性和阴性细菌的生长,蓝色荧光DNAAgNCs抗菌活性弱于黄色和红色荧光体。添加三聚氰胺与DNA模板中T碱基特异性相互作用可以增强DNA-AgNCs的抗菌作用[25]。
Yang等[26]精确设计和构建了可调整形状和臂长的Y、X和(Y-X)型super-AgNC,super-AgNCs具有出色的抗菌性能(图4),并与293T(人类胚胎肾细胞),SMCs(血管平滑肌细胞)和GLC-82(肺腺癌细胞)生物相容。这些性能使super-AgNCs可以适应多种应用,如生物传感、生物成像和抗菌剂。
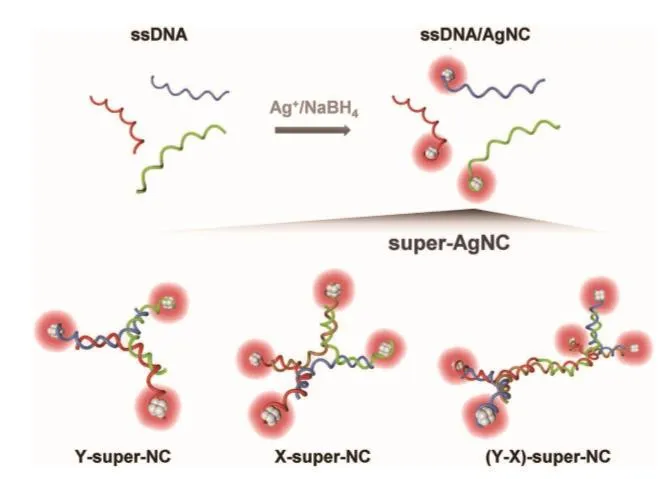
图4 Y-super-NC、X-super-NC和(Y-X)-super-NC合成过程及结构示意图[26]Fig.4 Schematic diagram of synthetic process and structure of Y-super-NC, X-super-NC, and (Y-X)-super-NC
灵活多变、合成简便、强荧光性、高抗菌活性与低毒性等优点赋予了DNA银纳米簇广泛的应用前景。寡聚核苷酸分子尺寸小、结构多样、合成方便,可组装成不同结构(如B-form、G-四链和i-motif等)阻止纳米银团簇的聚集,AgNCs的荧光性、稳定性、缓释性和抗菌活性可以不断优化和探索。DNAAgNCs具有强烈的荧光性,可帮助追踪抗菌过程和研究抗菌机理,而且在已经比较成熟的生物传感技术上叠加抗菌活性,将兼具分析检测与抗菌功能。碱基(尤其是胞嘧啶)与Ag+的亲和力可以实现Ag+低剂量缓慢释放,有效地控制细胞毒性。寡聚核苷酸生物半衰期短、跨膜能力弱,进入体内易被核酸酶和不适宜的环境(如胃酸)破坏和降解[60],被保护的Ag团簇能够及时离散,可能很大程度上降低体内危害。
6 总结与展望
目前AgNCs抗菌研究多集中在合成方法优化、配体类型创新、载体结合多样化及细胞毒性评估等方向上,关于抗菌机理的描述大多沿袭了AgNPs的相关机理,AgNPs抗菌机理的研究方法、技术手段可以借鉴应用于AgNCs上,只是目前能够看到的AgNCs抗菌的报道较为有限,但今后的研究也会不断增长。
尺寸、氧化态、表面性质、形状等理化性质和配体、载体等可以实现AgNCs抗菌活性的可控化调节,细胞毒性的控制则大多通过建立合适的银释放曲线,以安全有效剂量持续释放。
尽管AgNCs应用于抗菌有着诸多不可比拟的优势,但其在抗菌领域的研究仍处于一个新兴的阶段。未来AgNCs在抗菌方向的发展趋势可能包括以下几方面:
(1)配体、实物载体更加多样化:配体是保持其“簇”的状态的关键因素,实物载体直接关系到AgNCs在特定领域的应用,目前已有很多创新性研究立足于配体和实物载体的新探索,未来也将极大丰富和发展。
(2)更充分的抗菌性能研究和毒理学评估:目前AgNCs抗菌活性测试选择的菌种有限,抗菌机理尚不深入,银释放动力学与细胞毒性未建立系统的关联,未来的研究也将逐一深入和扩充。
(3)在生物医学领域发挥重要作用:外用伤口敷料和体内经皮设备等可以通过AgNCs形成局部抗菌环境以促进组织愈合生长,面临的问题主要是体内银迁移和残留。应进行长期的细胞毒性、诱变性和致癌性研究,以验证在治疗过程中可能发生的任何不良反应。
(4)银纳米簇相关产品走进日常生活:如餐具消毒剂、抗菌保鲜膜、口罩等可以保障卫生与安全,这也对企业或研发单位提出了更高的要求,在产品正式进入市场前充分考量其安全性。
(5)以具有成本效益和环境友好的方法合成AgNCs,顺应未来工程化、绿色生产的趋势,比如利用微生物和植物提取物进行绿色合成。
(6)DNA-AgNCs抗菌活性与DNA序列、荧光体颜色等因素关联的规律性更加明晰,实际应用不断拓展:近年来DNA-AgNCs主要是作为强荧光性的新材料而备受关注,针对AgNCs荧光性而进行的大量序列优化和筛选工作为抗菌活性的研究直接提供了优良的荧光序列库。在此基础上合成得到荧光强度和发光波长合适以及高抗菌活性的DNA-AgNCs将兼具生物传感和抗菌双重功能。目前DNA-AgNCs抗菌活性与DNA碱基序列、二级结构及荧光体颜色之间的规律性尚不清楚,作为抗菌材料的实际应用也比较缺乏,后续的研究将填补这些空白。