受体相互作用蛋白的功能及在硬骨鱼类中的研究进展
2021-06-23李凯晴李莹王艺磊邹鹏飞
李凯晴 李莹 王艺磊 邹鹏飞
(1.厦门大学环境与生态学院,厦门 361102;2.河口生态安全与环境健康福建省高校重点实验室 厦门大学嘉庚学院,漳州 363105;3.农业农村部东海海水健康养殖重点实验室 集美大学水产学院,厦门 361021)
鱼类是世界上最古老的脊椎动物,几乎分布于所有的水生环境,而其中硬骨鱼类数目占鱼类总数的90%以上,约为脊椎动物数目的1/2[1]。与哺乳动物类似,硬骨鱼类具有先天免疫系统(innate immunity)和适应性免疫系统(adaptive immunity)[2]。先天免疫是硬骨鱼类抵抗外界病原体入侵的第一道防线,主要通过模式识别受体(pattern recognition receptors,PRRs)识别入侵的病原微生物而启动,而适应性免疫是生物对特定病原体产生的特异性免疫应答[3]。
一般认为,动物发育过程中主要有3种细胞死亡方式:细胞凋亡(apoptosis)、自噬(autophagy)和细胞坏死(necrosis)。细胞凋亡是一种受死亡信号调节并伴随天冬氨酸半胱氨酸蛋白酶(caspase)激活的细胞程序性死亡,不会引发周围组织的炎症反应[4];自噬是细胞在应激或受到损伤的情况下,由溶酶体介导的机体清除降解受损的或衰老的细胞器以及机体不再需要的生物大分子的过程[5];而细胞坏死是指不受基因调控的意外的细胞死亡方式,这一死亡方式会伴随炎症反应[6]。近年来,又发现一种有规律的细胞死亡方式——程序性坏死(necroptosis),它既受多种基因调控又呈现细胞坏死的一些特征,最终引发炎症反应[7]。程序性坏死是细胞在凋亡无法正常启动时执行的死亡方式[8],与细胞凋亡不同,程序性坏死没有caspase的活化,它会使受损细胞释放损伤相关分子模式(damage associated molecular patterns,DAMPs), 如一些先天免疫调节因子:白介素-1(interleukin-1,IL-1)、高迁移率族蛋白B1(high mobility group box 1,HMGB1)、ATP和线粒体DNA等,最终激活吞噬细胞识别清除受损细胞。
受体相互作用蛋白(receptor-interacting protein,RIP)又叫受体相互作用蛋白激酶(receptor-interacting protein kinase,RIPK),作为细胞应对外界刺激的重要接头蛋白,不仅在炎症反应和先天免疫中起着重要作用,在诱导细胞死亡的过程中也起着关键作用[9-10]。RIP家族是一类具有苏氨酸/丝氨酸激酶活性的蛋白,在哺乳动物中发现了包含RIP1-7共7个成员,都具有相对保守的丝氨酸/苏氨酸激酶结构域(kinase domain,KD)。RIP家族成员由于其特定的结构域而参与包括细胞死亡和炎症反应在内的不同生物过程,或可接受细胞表面受体传递的胞外刺激,或可参与模式识别受体的信号转导[11]。本文主要综述了RIP家族成员在细胞死亡、炎症反应、先天免疫等不同生物过程中的作用以及在硬骨鱼类中研究的最新进展,旨为深入解析硬骨鱼类乃至哺乳动物的抗病免疫反应提供一些思路。
1 RIP1和RIP3
1.1 RIP1和RIP3的分子结构和功能
RIP1是RIP激酶家族的第一个成员,于1995年被发现并鉴定为具有C末端死亡结构域(death domain,DD)的新型蛋白激酶,可以与Fas受体的死亡结构域相互作用,因此被称为“受体相互作用蛋白”[12],RIP3则是第三个被鉴定出的RIP家族成员。RIP1和RIP3在结构上相似,N端均为激酶结构域,可催化自身磷酸化;中间域也均包含RIP同源相互作用基序(receptor-interacting-protein homotypic interaction motif,RHIM),可介导与其他含RHIM的蛋白相互作用,如β干扰素TIR结构域接头蛋白(TIR domain-containing adaptor-inducing IFNβ,TRIF)和DNA依赖的干扰素调节因子激活物(DNA-dependent activator of IFN-regulatory factors,DAI)[13-15],以及参与下游核转录因子(nuclear transcription factor-κB,NF-κB)的活化[16];RIP1 的 C 端为死亡结构域(death domain,DD),参与介导同型蛋白之间的相互作用,如Fas、肿瘤坏死因子受体1(TNF-receptor 1,TNFR1)、死亡结构域蛋白(fas-associated death domain,FADD)和肿瘤坏死因子受体相关死亡域蛋白(TNF-receptor-associated death domain,TRADD)[17],而 RIP3不具有 DD 结构域(图1)。RIP1和RIP3广泛表达于胚胎和成体组织中,RIP1敲除严重抑制了成熟T细胞在抗原受体诱导下的增殖反应[18],RIP1缺失会使成纤维细胞对TNF诱导的细胞死亡更加敏感,RIP1基因敲除小鼠出生3 d后无法存活[19],而RIP3基因敲除小鼠可以存活下来[20],这表明RIP1在个体生长发育和生存中必不可少,同时暗示着RIP3在个体生长发育过程中的功能或可被替代。
哺乳动物中有大量研究表明,RIP1是炎症反应、细胞凋亡和程序性坏死的关键调节因子。RIP1通过激酶依赖性和非依赖性方式调节炎症信号,响应TNF和Toll样受体(toll-like receptor,TLR)家族配体的刺激[20-21]。肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)与其受体TNFR1结合后,通过接头蛋白TRADD将RIP1募集到TNFR1上,同时还招募肿瘤坏死因子受体相关因子2(TNF receptor associated factor 2,TRAF2)、凋亡抑制蛋白 1(cellular inhibitor of apoptosis protein 1,cIAP1)和 cIAP2,最终形成初始质膜结合复合物Ⅰ[22](图2)。其中,TRAF2和cIAPs催化RIP1多聚泛素化[23],多聚泛素化的RIP1激活NF-κB和促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路,而RIP1通过激活NF-κB促进炎症因子的表达参与炎症反应[24]。在缺失cIAPs或泛素连接酶的情况下,RIP1依赖其激酶活性与FADD和caspase-8前体结合,形成了复合物Ⅱ,促进caspase-8前体加工剪切成其活性形式,从而引发caspase级联反应,启动经典的caspase依赖性细胞凋亡[25](图2)。有报道显示,泛素连接酶Pellino3能够以RIP1为靶点抑制TNF诱导的复合物Ⅱ的形成[26]。RIP1在TNF诱导的信号通路中具有双重作用——通过泛素化作用激活NF-κB和MAPK信号通路参与炎症反应,和RIP1去泛素化激活caspase-8介导细胞凋亡,同一种蛋白的不同作用形式触发两条完全相反的途径,表明了RIP1在决定细胞命运方面起着关键性作用。
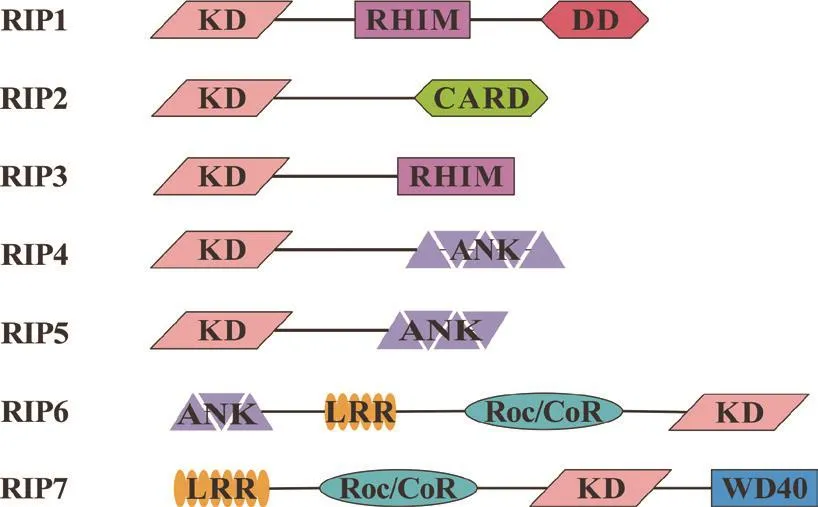
图1 哺乳动物 RIP 家族成员及蛋白结构域示意图Fig.1 Protein domain of mammalian RIP family members
RIP1不仅在调控TNF信号途径中扮演关键角色,在TLR3和TLR4信号转导通路中也发挥重要作用。TLR3和TLR4通过接头蛋白TRIF间接作用RIP1,这种相互作用依赖于TRIF和RIP1中共有的RHIM结构域[27-28]。当TLR3和TLR4分别识别进入宿主细胞内的病毒双链RNA(dsRNA)和革兰氏阴性细菌细胞壁成分脂多糖(lipopolysaccharide,LPS)时,TLR3直接与TRIF结合,而TLR4通过招募β干扰素TIR结构域接头蛋白相关接头分子(TIR domain-containing adaptor-inducing IFNβ-related adaptor molecule,TRAM)与 TRIF结 合,TRIF再通过RHIM结构域介导与RIP1的相互作用(图2),RIP1通过其激酶活性募集和活化FADD和caspase-8介导细胞凋亡发生。此外,TRIF和RIP1以及TRAF6和泛素连接酶Pellino1形成复合物,随后募集和活化转化生长因子激酶(TGFβ-activated kinase,TAK)、转化生长因子激酶靶蛋白(TGFβactivated kinase binding protein,TAB)和 IκB 激 酶(inhibitor of nuclear factor kappa-B kinase,IKK)复合体,最终介导下游NF-κB信号的激活从而触发炎症反应[29]。Fas相关死亡结构域蛋白样白介素-1β转换酶抑制蛋白(fas-associated death-domin-like IL-1βconverting enzyme inhibitory protein,FLIP)会 抑 制TRIF-RIP1复合物激活FADD和caspase-8从而阻断细胞凋亡[30]。模式识别受体维甲酸诱导基因蛋白Ⅰ(retinoic acid-inducible gene Ⅰ,RIG-Ⅰ)识别病毒RNA后,招募下游接头分子线粒体抗病毒信号蛋白(mitochondrial antiviral-signaling protein,MAVS),随后募集和活化RIP1、FADD和TRADD等形成线粒体相关复合物,介导下游干扰素调节因子(interferon regulatory factors,IRFs)和 NF-κB 的 激 活[31]。 而活化的caspase-8能够剪切RIP1,抑制了RIP1对RIG-Ⅰ复合物下游IRF3的激活[32]。目前,有关RIP1在细胞死亡和TLRs所介导的信号转导方面的作用机制得到了较深入的研究,但对于其在RIG样受体(RIG-Ⅰ like receptors,RLRs)所介导的信号通路中的具体作用机制还有待进一步研究。
RIP1通过激酶依赖性和非激酶依赖性两种方式调控炎症反应和细胞死亡[33]。RIP1不依赖其激酶活性形成TNF诱导的死亡复合物Ⅰ来参与炎症反应;同时,也可通过其激酶活性诱导caspase-8介导的细胞凋亡和RIP3-MLKL(mixed lineage kinase domainlike protein)介导的程序性坏死[34]。有大量研究表明,RIP1和RIP3在介导细胞程序性坏死方面起着重要的作用[11,35-36]。当 caspase-8 的蛋白活性受到抑制时,RIP1通过RHIM结构域与RIP3相互作用,同时,RIP1和RIP3依赖各自激酶活性催化自身磷酸化[37],形成一个磷酸化驱动的坏死小体,RIP3再募集和磷酸化MLKL,磷酸化的MLKL转移到细胞膜上破坏膜结构,最终导致细胞程序性坏死,诱导炎症反应[38-39](图2)。有报道显示,RIP1和RIP3基因敲除小鼠与RIP1和MLKL基因敲除小鼠的存活时间比只敲除RIP1基因小鼠长几天[30,40-41],表明RIP1和RIP3或RIP1和MLKL的同时缺失可能造成坏死小体无法组装,从而阻断细胞程序性坏死,为生物体提供了一定的保护作用。敲除小鼠成纤维细胞中的TRAF2基因可促进RIP1-RIP3-MLKL坏死小体结合,触发程序性坏死[42]。cIAPs和TAK1通过抑制RIP1-RIP3-MLKL坏死小体介导的活性氧(ROS)产生从而阻断细胞程序性坏死[43-44]。RIP3可以调控包括TLRs、TNF和DAI在内的多种信号途径,最终导致细胞程序性坏死[40,45-46]。在小鼠胚胎成纤维细胞中,TRIF可以不经过RIP1直接招募RIP3启动程序性坏死[47]。当细胞内受体DAI在识别病毒双链DNA后,可以通过RHIM结构域的相互作用直接招募RIP3,催化RIP3磷酸化并形成寡聚体,导致细胞程序性坏死[48]。目前的研究表明,程序性坏死主要发生在凋亡通路受到抑制的情况下[49-50],RIP1-RIP3-MLKL形成坏死小体,磷酸化的MLKL转移到细胞膜上,但尚不清楚MLKL是通过直接还是间接作用诱导细胞膜破裂。

图2 哺乳动物 RIP1 和 RIP3 介导的信号通路Fig.2 RIP1 and RIP3-mediated signaling pathways in mammals
RIP3不仅是程序性坏死的关键调节因子,还可以调节细胞凋亡和细胞焦亡(pyroptosis)。细胞焦亡是指炎症依赖性的细胞死亡,其特征是组装一个称为炎症小体的多聚蛋白复合物,诱导caspase-1的加工和激活,最终导致促炎细胞因子IL-1β和IL-18的成熟和释放[51]。RIP3可以激活caspase-8,致使caspase-8对IL-1β前体进行剪切,同时促进NLRP3炎症小体介导的IL-1β的成熟和分泌[50](图2)。有研究显示,当细胞中缺失凋亡抑制蛋白cIAPs时,RIP3可以激活caspase-8介导的促炎细胞因子的加工,在不依赖MLKL的情况下激活NLRP3炎症小体从而介导细胞焦亡;相反地,在细胞中缺失cIAPs和caspase-8的情况下,RIP3和MLKL对于TLRs诱导的NLRP3炎症小体的激活则变得至关重要[49]。A20可以与泛素化的RIP3形成复合物,阻碍NLRP3炎症小体中caspase-1和caspase-8的组装,从而抑制IL-1β的加工[52]。有研究表明,缺乏caspase-8和RIP3的细胞大大影响了caspase-1的加工,并减少了感染诱导的IL-1β和IL-18的产生,与此同时,转录因子NF-κB的活性也受到损伤[53]。早期研究表明,RIP3的过表达会抑制HEK293T细胞中TRIF依赖的NF-κB 激活[54],但近来有研究发现,RIP3可通过介导巨噬细胞中的TLR4信号通路,激活NF-κB信号,起到重要的促炎作用[55]。因此,RIP3可能会影响NF-κB激活,但其对NF-κB活性的调控作用及具体机制仍然需要进一步的研究。
1.2 RIP1和RIP3在硬骨鱼类中的研究进展
近年来,在硬骨鱼类的相关研究中也发现了哺乳动物RIP1和RIP3的同源基因,在斑马鱼(Danio rerio)、鲤鱼(Cyprinus carpio)、斜带石斑鱼(Epinephelus coioides)和青鱼(Mylopharyngodon piceus)中均发现RIP1,RIP3的同源基因在斑马鱼、鲤鱼和半滑舌鳎(Cynoglossus semilaevis)中也有报道。
硬骨鱼类RIP1和RIP3在细胞死亡方面的作用与哺乳动物类似:斑马鱼cIAP蛋白可以通过泛素连接酶促进RIP1的多聚泛素化,进而调节TNFR1死亡复合物的组装[56];传染性胰腺坏死病毒(infectious pancreatic necrosis virus,IPNV)感染斑马鱼后,通过TNF-α触发的死亡信号来诱导caspase介导的细胞凋亡和RIP1-RIP3-MLKL介导的程序性坏死[57];在cIAP拮抗剂和caspase抑制剂存在时,TNF-α刺激后半滑舌鳎RIP3蛋白可与MLKL相结合,且RIP3的过表达能诱导细胞死亡[58]。有研究通过ROS定量分析发现,RIP1、RIP3和PGAM5敲降使TNF过表达的斑马鱼ROS降低到正常水平;白三烯A4水解酶(leukotriene A4 hydrolase,LTA4H)的过表达使早期巨噬细胞的杀菌效力增强,而RIP1和RIP3的基因敲降逆转了这一结果[59]。通过构建色盲斑马鱼模型,发现突变体胚胎中RIP3敲降可以通过抑制ROS的形成防止视锥细胞死亡,表明RIP3介导的程序性坏死是视锥细胞死亡的潜在原因[60]。此外,有机磷杀虫剂“毒死蜱”(chlorpyrifos,CPF)暴露可下调鲤caspase-8的表达水平并抑制其介导的细胞凋亡,上调RIP1、RIP3和MLKL的表达水平,诱导细胞程序性坏死[61];在除草剂“莠去津”(atrazine,ATR)的作用下,鲤鱼RIP1、RIP3、MLKL和FADD的转录水平以及RIP3和MLKL的蛋白水平显著增加,从而导致细胞程序性坏死[62]。目前,对于硬骨鱼类RIP1和RIP3研究的热点聚焦在其介导的细胞程序性坏死上,而有关RIP3调控炎症小体组装和激活的研究还存在空白。因此,对硬骨鱼类RIP3的功能及其介导的信号通路调控机制尚需深入研究。
对硬骨鱼类的先天免疫和炎症反应方面的研究发现,斜带石斑鱼RIP1可与TRIF相互作用参与TLRs介导的信号通路,也可与TRAFs结合介导下游NF-κB和干扰素(interferon,IFN)通路的信号转导(图4),且RIP1过表达抑制新加坡石斑鱼虹彩病毒(singapore grouper iridovirus,SGIV)和赤点石斑鱼神经坏死病毒(red-spotted grouper nervous necrosis virus,RGNNV)复制,并上调IFN、IRFs和促炎细胞因子的表达水平[63],这表明RIP1可能在宿主的抗病毒免疫反应中发挥作用。但同时有研究显示,青鱼RIP1可与MAVS相互作用抑制MAVS对IFN的激活作用,同时负调控MAVS介导的RLRs抗病毒信号通路[64](图4),而哺乳动物中的研究显示RIP1可以激活MAVS介导的抗病毒信号通路[31],这表明RIP1在硬骨鱼类和哺乳动物中的抗病毒免疫功能可能有所不同。目前研究显示硬骨鱼类RIP1在TLRs和RLRs介导的信号通路中发挥着不同的调控作用,其具体的作用机制有待进一步研究。
2 RIP2
2.1 RIP2的分子结构和功能
RIP2又叫RIP样凋亡调控蛋白激酶(RIP-like-interacting CLARP kinase,RICK)或 含 caspase激活募集域白介素-1β转化酶相关激酶(CARD-containing IL-1β converting enzyme-associated kinase,CARDIAK),可以激活 NF-κB 和介导细胞凋亡[65-67]。RIP2在N端有激酶结构域,C端有一个caspase激活募集域(caspase activation and recruitment domain,CARD),可以介导与其他含CARD结构域的蛋白相互作用,如模式识别受体核苷酸结合寡聚化结构域蛋 白 1(nucleotide-binding oligomerization domains,NOD1)、NOD2 和 caspase-1 等[68-69]( 图1)。 除 去CARD-CARD间的相互作用,RIP2还可以和其他蛋 白 特 异 性 结 合, 包 括 TLR2[70]、cIAP1/2[71]、TRAF3[72]和 CD40[73]。RIP2 广泛表达在生物体各组织中,RIP2缺失严重抑制TLR4和NOD1介导的NF-κB激活,IL-1诱导产生的细胞因子减少,并削弱抗原受体诱导下的T细胞增殖和分化[70,74],表明RIP2在炎症反应、先天免疫和适应性免疫中发挥了重要作用。
RIP2在哺乳动物NOD1和NOD2介导的先天免疫反应中起着重要作用。NOD1和NOD2可分别识别进入宿主细胞的病原菌肽聚糖(peptidoglycan,PGN)中的 iE-DAP(γ-D-glutamyl-meso-diaminopimelic acid)和 胞 壁 酰 二 肽(muramyl dipeptide,MDP)并激活,通过CARD-CARD结构域相互作用招募RIP2,活化TAB-TAK和IKK复合体并诱导NF-κB和MAPK信号通路激活,诱导促炎细胞因子和抗菌分子的产生[68](图3)。许多与RIP2相互作用或调节RIP2泛素化的分子能参与调控NOD1和NOD2介导的信号通路:Caspase-12通过与RIP2结合,致使NOD1/2信号受到抑制和抗菌反应减弱[75];RIP2同家族的RIP7可以通过促进RIP2磷酸化来正调控NOD1/2-RIP2信号通路[76];甲状腺激素受体相互作用蛋白6(thyroid hormone receptor interactor 6,TRIP6)通过TNF或IL-1的介导,与RIP2相互作用以正调控NOD1介导的信号通路[77]。RIP2的多聚泛素化是NOD1和NOD2介导的信号转导的关键步骤[78-79]。X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)通过与RIP2结合被招募到NOD1/2-RIP2复合物中,促进RIP2的多聚泛素化从而介导NF-κB和MAPK 的激活[80-81]。Pellino3和cIAP1/2与XIAP作用基本相同,通过促进RIP2多聚泛素化从而激活TAB-TAK和IKK复合体[71,82]。而TNF-α诱导蛋白A20、去泛素化酶OTULIN(OTU deubiquitinase with linear linkage specificity)和去泛素化酶头帕肿瘤综合征蛋白(cylindromatosis,CYLD)都可以通过对RIP2去泛素化进而对NOD1/2-RIP2信号进行负调控并抑制细胞因子的产生[83-85]。目前已证实有多种泛素化修饰酶可参与调控NOD1/2-RIP2介导的NF-κB和MAPK的信号通路,是否还有其他泛素化酶可参与调控,它们之间是否存在协同作用,这些问题尚有待进一步解答。
RIP2除参与NOD1和NOD2介导的信号通路,还可参与包括TNF、IL-1和TLRs在内的多种NF-κB激活途径。RIP2与caspase-1可通过CARD-CARD相互作用,介导NF-κB的激活[69]。而凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)可通过其CARD结构域干扰RIP2与caspase-1的结合,抑制RIP2和caspase-1互作诱导的NF-κB信号,促进caspase-1的激活和促炎细胞因子IL-1β的加工[86](图3)。同时还有报道显示,RIP2可以与TRAF1、TRAF2、TRAF5和 TRAF6多个TRAF成员相互作用,诱导NF-κB的激活[87]。在某些情况下RIP2也能诱导细胞死亡,如RIP2可以直接激活死亡受体家族中的Fas受体,从而参与Fas受体诱导的细胞凋亡[65]。目前尚不清楚RIP2如何促进Fas受体介导的凋亡及在细胞死亡中扮演怎样的角色,这些科学问题值得在未来深入了解。
2.2 RIP2在硬骨鱼类中的研究进展
近来,在斑马鱼、南亚野鲮(Labeo rohita)、斜带石斑鱼、麦瑞加拉鲮(Cirrhinus mrigala)、虹鳟(Oncorhynchus mykiss)、 牙 鲆(Paralichthys olivaceus)、金鱼(Carassius auratus L.)、鮸鱼(Miichthysmiiuy)和卡特拉鱼(Catla catla)研究中相继报道了RIP2的同源序列。在南亚野鲮[88-89]、麦瑞加拉鲮[90]、斜带石斑鱼[91]和卡特拉鱼[92]中,用 iEDAP、MDP、LPS和聚肌胞苷酸(poly I:C)刺激以及病原体嗜水气单胞菌(Aeromonas hydrophila)、迟缓爱德华氏菌(Edwardsiella tarda)和福氏志贺氏菌(Shigella flexneri)感染后,RIP2的表达上调;在金鱼中,RIP2作为NLR信号通路中的关键接头蛋白可与NOD1/2相互作用,并且可以激活NF-κB通路,同时RIP2参与调控金鱼巨噬细胞中TNF-α和IL-1β的表达[93];鮸鱼NOD1通过LRR结构域识别iEDAP并通过招募RIP2激活NF-κB信号通路,诱导炎症反应[94]。在斑马鱼中,RIP2的过表达诱导I型IFN和NF-κB启动子激活,且RIP2过表达的细胞表现出抗病毒和抗细菌感染的能力[95];斑马鱼组蛋白H2A可以与RIP2作用协同诱导抗菌基因和主要组织相容性复合体(major histocompatibility complex,MHC)相关基因的表达[96];RIP2可参与调节NLRs信号、MHC抗原呈递和自噬,对幼体发育至关重要,但由NOD1介导的MAPK信号和下游CD44a-Lck-PI3K-Akt信号与RIP2无关[97]。鱼类中存在多种与哺乳动物RIP2相似的下游级联反应:如在虹鳟鱼中,使用RIP2抑制剂显著降低iE-DAP诱导的促炎细胞因子 IL-1β、IL-6、IL-8 和 TNF-α 的表达[98];在牙鲆中,RIP2定位于细胞质,RIP2的过表达会上调PGN刺激的促炎细胞因子IL-1β、IL-6和IL-8的表达[99]。此外,金鱼ASC可以与RIP2和caspase-1相互作用,ASC的过表达可抑制RIP2对NF-κB的激活作用[100](图4)。硬骨鱼类RIP2通过NOD1/2信号转导参与调节NLRs信号和MHC抗原呈递,还可通过与NOD1/2或caspase-1相互作用诱导NF-κB的激活和促炎细胞因子的表达,参与宿主抗菌和抗病毒免疫反应,但不参与NOD1介导的MAPK信号通路,这表明了硬骨鱼类RIP2介导的信号通路与哺乳动物有所不同。
3 RIP4和RIP5

图3 哺乳动物 RIP2 介导的信号通路Fig.3 RIP2-mediated signaling pathways in mammals
RIP4又叫蛋白激酶C-δ相互作用激酶(protein kinase C-δ interacting protein kinase,DIK)[101]或蛋白激酶C相关激酶(protein kinase C-associated kinase,PKK)[102],RIP4的 N 端包含激酶结构域,C端具有锚蛋白重复序列(ankyrinrepeat,ANK)(图1)。RIP4敲除小鼠在出生几小时后就不能存活,其骨骼形态发生变化,同时角质形成细胞分化受损,而缺失RIP4的小鼠淋巴细胞会使外周B淋巴细胞数量减少,RIP4在B淋巴细胞发育和维持成熟B淋巴细胞再循环中占据重要地位[103-105],这暗示着RIP4可能在适应性免疫中发挥着作用。
RIP4的过表达依赖其激酶活性可诱导NF-κB和氨基末端激酶(c-Jun N-terminal kinase,JNK)信号的激活[106-107]。在哺乳动物中,RIP4介导的NF-κB激活需要IKK复合体中的调节亚基IKK-α和IKK-β,RIP4通过使IKK-α和IKK-β上丝氨酸位点磷酸化,活化IKK复合体从而激活NF-κB[108]。促分裂原活化蛋白激酶激酶的激酶2(mitogen-activated protein kinase kinase kinase 2,MEKK2)和 MEKK3通 过与RIP4相互作用使其磷酸化,而磷酸化的RIP4增强了这两种蛋白激酶对NF-κB的激活[109]。同时有研究表明,B细胞活化因子(B cell-activating factor,BAF)介导的 NF-κB 活化需要 RIP4的参与[110],RIP4的Lys51和Lys145是cIAP1介导的泛素化和NF-κB活化的两个关键氨基酸残基[111]。此外,TRAF家族的几个成员包括TRAF1、TRAF3和TRAF6通过与RIP4结合,抑制RIP4诱导的NF-κB活化[106]。在凋亡过程中,caspase通过作用于RIP4中间结构域的Asp340和Asp378氨基酸位点使RIP4发生剪切,从而抑制NF-κB信号通路[106]。RIP4通过和信号转导子与转录激活子3(signal transducer and activator of transcription 3,STAT3)相互作用增强STAT3的磷酸化,进而促进巨噬细胞炎性因子-3α(macrophage inflammatory protein-3α,MIP-3α)的 表达[112]。哺乳动物中有关RIP4的研究主要集中在其对NF-κB信号的激活,而它是否还参与了其他信号转导过程目前尚不清楚。
哺乳动物RIP5在其结构上与RIP4相似,N端为激酶结构域,C端具有ANK序列,这暗示它可能具有类似于RIP4的功能(图1)。RIP5的过表达可诱导具有DNA断裂等凋亡形态特征的细胞死亡[113]。RIP5可能通过成纤维细胞生长因子(fibroblast growth factor,FGF)信号通路在后肾发育和成熟中发挥作用[114],也可能参与控制细胞衰老和细胞死亡[115],但它的具体功能尚不清晰。
目前,尚未在硬骨鱼类中报道RIP4的同源基因,仅在斑马鱼中报道敲除RIP5会导致发育缺陷,FGF信号丢失[116]。
4 RIP6和RIP7
RIP6又叫富亮氨酸重复激酶1(leucine-rich repeat kinase 1,LRRK1),它的结构域十分独特又与RIP激酶密切相关。RIP6在N端含有ANK结构域,除了含有激酶结构域外还包含富亮氨酸重复序列(leucine-rich repeat,LRR)和Roc/COR结构域(ras complex protein/C-terminal of Roc)(图1)。
RIP6可参与和调节特定的内体运输,如RIP6可以使Ras相关蛋白7(ras-related protein 7,Rab7)在S72位点上磷酸化,促进Rab7与其效应分子Rab7相互作用溶酶体蛋白(Rab7-interating lysosomal protein,RILP)的相互作用,促进含有表皮生长因子受体(epidermal growth factor receptor,EGFR)的内体向核周区域运输[117]。有研究发现,RIP6基因敲除小鼠出现了骨骼发育不良并伴有硬化,这与骨硬化性干骺端发育不良的表型相似[118]。哺乳动物RIP6主要与内体运输和骨骼发育相关,但其对骨骼发育的具体调控机制尚不清楚,仍需深入研究。
RIP7又叫做LRRK2,在N端含有LRR序列,C端有WD40重复序列,中间包括Roc/COR结构域和激酶结构域(图1)。RIP7基因突变是家族性和偶发性帕金森病的常见遗传原因,在帕金森患者中RIP7表达量增加[119]。在RIP7基因敲除小鼠的肝脏中,低氧诱导因子-2α(hypoxia inducible factor-2α,HIF-2α)蛋白的表达增加且其靶基因促红细胞生成素(erythropoietin,EPO)的表达也显著增加[120]。此外,RIP7可调节细胞内囊泡运输和维持细胞器形态,RIP7基因敲除和药物抑制其激酶活性分别会引起啮齿动物和灵长类动物细胞溶酶体异常[121-122],RIP7基因发生突变的帕金森患者细胞中溶酶体形态发生改变[123]。同时,RIP7是RIP2的一种正调控因子,通过正调控NOD1/2-RIP2途径诱导促炎细胞因子的表达[76],这也暗示RIP7可通过RIP2参与调控宿主的先天免疫反应。
目前,尚未在硬骨鱼类中报道RIP6同源基因,而RIP7仅在斑马鱼中有相关报道。研究显示,斑马鱼RIP7突变使与抗感染和免疫疾病相关的基因表达明显受到影响,其抗病原菌感染的能力显著减弱[124]。早期研究认为RIP7的敲降不会导致斑马鱼多巴胺能神经细胞的损失[125],但近来的研究发现RIP7敲降不仅会导致多巴胺能神经细胞的损失,还会导致肾前导管中钠钾泵蛋白的错误定位引起发育紊乱[126]。因此,关于RIP7对神经细胞的功能与作用机制仍然需要进一步研究。
5 结语与展望
过去的十几年中,关于不同RIP家族成员的结构、功能和参与调控的信号通路解析方面取得了很大进展,越来越多的研究表明它们在宿主抗感染免疫、炎症反应、细胞分化和细胞死亡中发挥着重要作用。RIP1是细胞死亡的重要节点性蛋白,是细胞选择凋亡还是程序性坏死的开关,RIP3是程序性坏死和炎症反应的重要调节因子,RIP1与RIP3组成坏死小体在程序性坏死中发挥重要作用。目前硬骨鱼类中有关RIP1和RIP3的研究大都集中在参与细胞死亡的过程,而对其参与调控宿主先天免疫和炎症反应的研究较为匮乏。RIP2与宿主的先天免疫应答密切相关,可介导多种促炎因子的表达,并可通过模式识别受体参与宿主的抗菌和抗病毒免疫反应。目前研究表明硬骨鱼类RIP2所介导的信号通路与哺乳动物有所不同,但多数研究停留在配体或病原体刺激下对其表达水平的影响,后续研究需要对其功能和作用机制进行深入解析。而不管在哺乳动物还是硬骨鱼类中,有关RIP4、RIP5、RIP6和RIP7的研究都较少,它们具体的功能和作用机制尚不清楚。尽管目前对硬骨鱼类RIP家族成员的功能研究有限,但随着第三代测序技术的发展和CRISPR/Cas9等基因敲除技术的进步,相信在不远的未来将不断揭示RIP家族成员在鱼类抗病免疫和细胞程序性死亡中的重要性,丰富和发展硬骨鱼类乃至哺乳动物的免疫学知识。
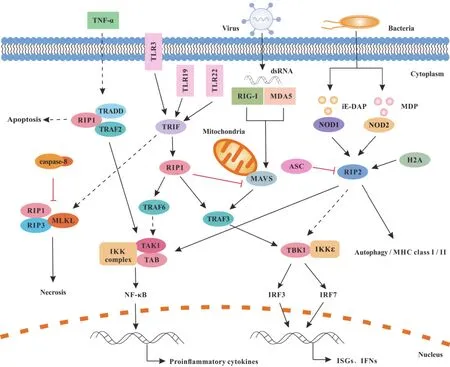
图4 硬骨鱼类 RIP1、RIP2 和 RIP3 介导的信号通路Fig.4 RIP1, RIP2, and RIP3-mediated signaling pathways in teleosts