活性氧诱发的植物亚细胞间通讯
2021-06-23李陆萍梁大成
李陆萍 梁大成
(1.湖北省主要粮食作物产业化协同创新中心,荆州 434025;2.长江大学湿地生态与农业利用教育部工程研究中心/湖北省涝渍灾害与湿地农业重点实验室,荆州 434025)
活性氧(reactive oxygen species,ROS)在植物正常代谢条件下起着重要作用,可以参与多种信号转导途径[1]。植物在生长发育过程中也会遇到干旱、寒冷、盐碱和重金属等恶劣环境,为了抵御这些不良环境,植物体内已经形成了一套复杂的应对机制。其中,植物不同亚细胞器中ROS的产生就是对这些刺激和正常发育的响应。当植物体内活性氧积累超出一定量时,就会打破细胞的氧化还原平衡状态,造成核酸损伤、蛋白质的氨基酸残基生成羰基衍生物、蛋白分子内部以及分子间发生交联形成二硫键、蛋白质分子的断裂及金属酶类的失活以及磷脂的过氧化等。此外,过量的ROS对植物质膜系统造成损伤并最终引起细胞死亡[2-3]。然而植物会通过不同的抗氧化机制改善ROS的损伤,使活性氧始终保持在一个基本无毒的水平,维持细胞的氧化还原平衡状态[4]。抗氧化机制包括大分子抗氧化物酶类如超氧化物歧化酶(SOD)、谷胱甘肽还原酶(GR)、过氧化氢酶(CAT)、过氧化物酶(POD)、抗坏血酸盐过氧化物酶(APX)、谷胱甘肽过氧化物酶(GPX)等;小分子抗氧化剂如谷胱甘肽、抗坏血酸、维生素C和维生素V/E等;以及硫氧还蛋白系统和谷氧还蛋白系统等机制[5]。越来越多的研究表明,低浓度的活性氧可以作为植物中的信号分子,调节生长发育途径,控制氧化还原平衡状态并对病原体和环境胁迫做出防御[6-7]。本文着重介绍不同种类ROS在信号传导中的作用以及ROS信号在胞内及细胞器间的传导过程。
1 植物细胞内ROS的种类
植物体内的叶绿体,线粒体,过氧化物酶体以及质膜和质外体中都会存在ROS(图1)。ROS主要是由单线态氧(1O2)、超氧阴离子(O2·-)、过氧化氢(H2O2)、羟自由基(·OH)组成。单线态氧(1O2)通过能量的转移在叶绿体中产生[8],主要产生部位是叶绿体中的光捕获天线复合体(light harvesting antenna complexes,LHC)和 光 系 统 Ⅱ(photosystem Ⅱ,PS Ⅱ)[9]。不同功能的 PS Ⅱ复合物在内囊体中的位置不同,1O2可以在内囊体基粒中心和边缘部位产生,由于空间上分布差异导致诱发不同的信号传导途径[10-11]。1O2半衰期只有 1-4 μs,但它可以在细胞中存活很长时间,可以穿过细胞膜进入细胞外,扩散到可感知的位置[12]。超氧阴离子(O2·-)、过氧化氢(H2O2)、羟自由基(·OH)则是在O2被还原成H2O 这一过程中接受电子产生的。和1O2具有一样的半衰期,寿命相对较短,不易扩散,只能在产生部位起作用。在线粒体、叶绿体、过氧化物酶体以及质外体中都有产生,都是由于O2经过电子传递被还原生成的中间产物,随后被SOD催化生成H2O2[13]。H2O2的半衰期相对较长(1 ms),可以通过膜的扩散在细胞中进行远距离运输并触发特定信号的转导。H2O2在种子萌发、细胞程序性死亡(programmed cell death,PCD)、衰老、开花、根系发育、气孔孔径调节、细胞壁整合、生殖识别、顶端生长等植物发育和生理过程中发挥重要作用[14-17]。·OH 是由 H2O2和 O2·-生成的[18]。它的半衰期只有1 ns,能够破坏周围环境中的任何物质并产生更多的自由基,通过催化多糖的断裂从而引起细胞壁的松弛促进细胞伸长,在繁殖、发芽和生长中起着积极地作用[19-21]。·OH和H2O2在种子发芽和花粉萌发中起着相反的作用,推测不同种类ROS在控制植物生理方面可能存在不同的作用[20,22]。基于·OH的化学性质,在调控生长发育时涉及到的基因调控途径还不太明确。目前研究最多的是关于H2O2信号的调控。
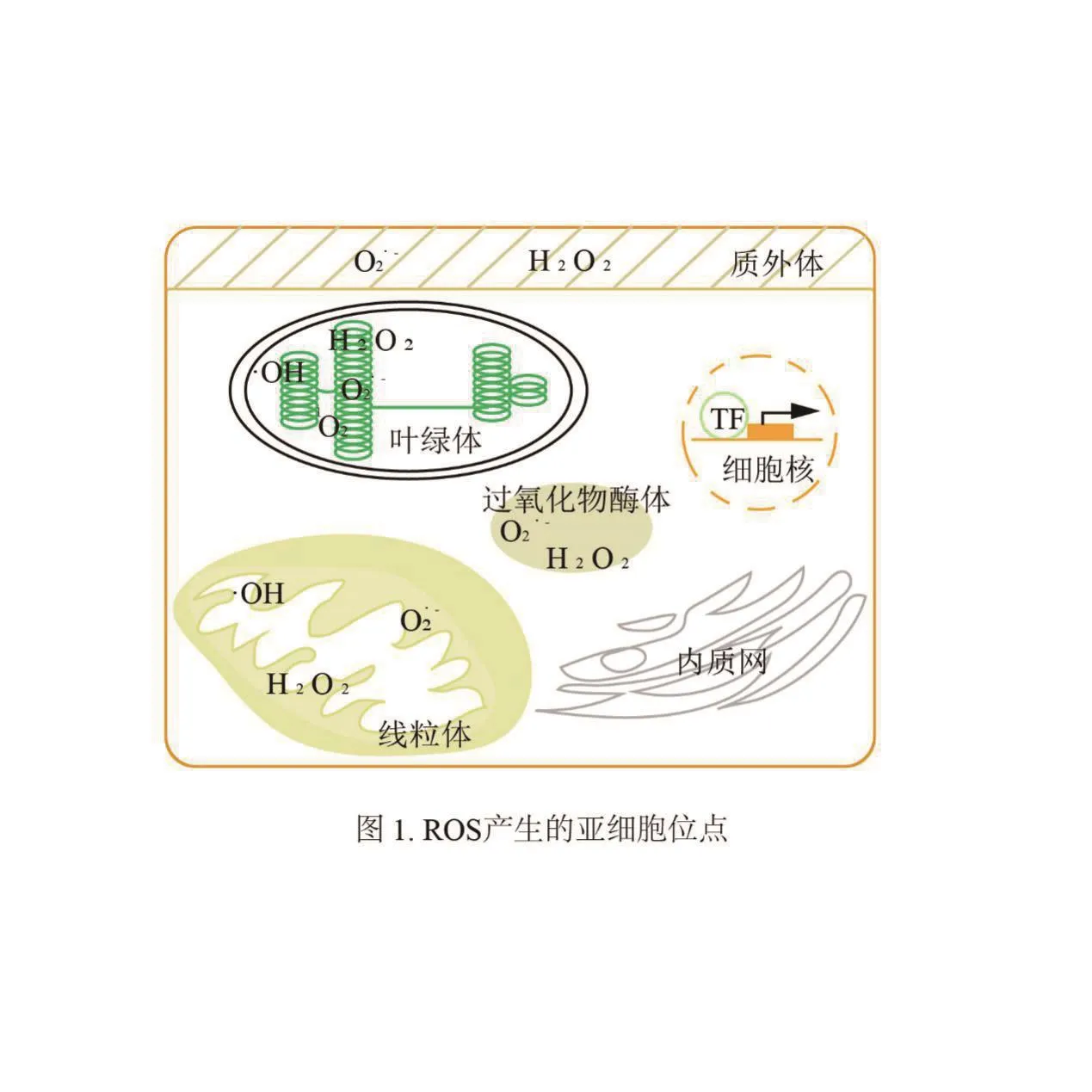
图1 ROS产生的亚细胞位点Fig.1 Subcellular sites from ROS
2 植物细胞如何感知并响应ROS
植物局部受到生物胁迫或非生物胁迫时,大量的活性氧会通过细胞壁过氧化物酶体和质膜NADPH氧化酶的作用在质外体中积累[23-25]。而当相邻的细胞感知到活性氧时,Ca2+通道被激活,进而刺激呼吸爆发氧化酶(respiratory burst oxidase homologs,RBOHs)产生活性氧,再通过相邻细胞引发长距离信号传播,从而使整个植株做出响应[26]。植物细胞内部与质外体环境之间的通讯主要依靠类受体蛋白和类受体激酶来调控的。其中,类受体激酶是一类镶嵌在细胞膜上的跨膜蛋白,延伸到质外体的部分会感知这种刺激,然后通过存在于细胞质内部的区域将信号传递到细胞内环境中[27]。最近的研究发现一种含有特定半胱氨酸残基的蛋白激酶HPCA1(hydrogen-peroxide-induced Ca2+increases), 由 于 质外体中H2O2的激活形成共价修饰导致自身磷酸化。HPCA1外质体部分具有两对特殊的半胱氨酸残基,H2O2通过氧化这种残基基团引发蛋白构象变化和激酶活性,导致钙离子通道开放和Ca2+内流,触发内在的系统信号通路(图2)[28]。
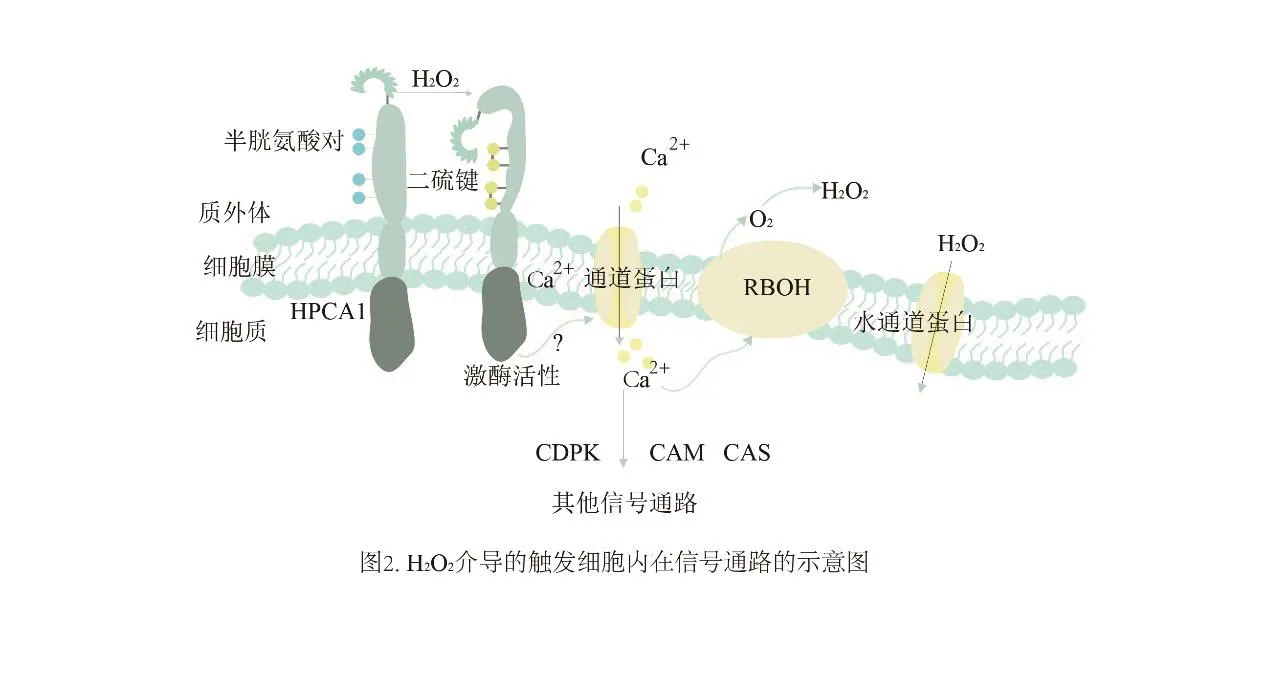
图2 H2O2介导的触发细胞内在信号通路的示意图Fig.2 A schematic representation of H2O2-mediated triggering intrinsic signaling pathways in cell
3 ROS信号参与细胞器间的交流
细胞器与细胞核存在通讯,大部分细胞器蛋白是由细胞核编码、翻译后进入细胞器发挥作用的。相反,一些细胞器的信号可以“逆行”进入细胞核引起核基因表达的变化,从而编码具有结构和代谢功能的细胞器蛋白,这种调控信号被称为“逆行信号”。研究表明细胞器中的氧化还原感应和信号转导都与活性氧有关[29]。ROS的产生可能是调节细胞机制以适应外界环境改变的必要信号,它可以调节多种信号转导的途径,最终影响转录因子基因的活性[30]。而植物体内的ROS主要是在叶绿体、过氧化物酶体和线粒体中产生的。
3.1 ROS参与叶绿体和细胞核之间的交流
细胞核对叶绿体的功能起着相当大的作用,大部分叶绿体蛋白由细胞核编码进入叶绿体。相反,一些叶绿体产物作为逆行信号也可以调节核编码基因的表达,编码具有结构和代谢功能的叶绿体蛋白[31]。SAL1是一种定位于叶绿体和线粒体的蛋白(图3),能够将磷脂酸磷酸酶(phosphoadenosine phosphate,PAP)磷酸化。强光和干旱条件下SAL1的活性受到抑制,导致PAP的积累,从而抑制特定的核酸酶XRNs(exoribonucleases)来激活核基因APX2(Ascorbate peroxidase 2)和 ELIP2(Early light inducible protein 2)的表达[32]。此外,类胡萝卜素是叶绿体LHC的组成成分,能够清除PSII反应中心产生的1O2[33]。类胡萝卜素衍生物最近被提出作为叶绿体产生的信号分子,影响叶绿体活性和核基因表达[34-36]。这两种逆行信号都会受到叶绿体中ROS介导。叶绿体至细胞核逆行信号的传导途径可通过四吡咯生物合成中间体的积累,质体基因的表达,叶绿体氧化还原条件的变化和各种活性氧的积累来激活[37-38]。这些激活的信号通路受到GUN1(Genomeuncoupled 1)和ABI4(ABA insensitive 4)的共同调控[39]。抑制剂林可霉素处理植物时,在光下叶片会在叶绿体中产生1O2,受到GUN1/ABI4途径的影响,核基因表达降低,表明ROS在GUN1/ABI4依赖性途径中起作用[40]。叶绿体是植物产生ROS的主要部位,其中PSⅡ和LHC产生的1O2是参与调节PCD的主要物质,它的扩散距离短,能够与脂质、蛋白质和色素反应,并被水迅速淬灭,推测一些脂质和类胡萝卜素氧化产物是1O2诱导的逆行信号[41,34]。另外发现两个核编码的叶绿体蛋白EX1(Executer1)、EX2(Executer2)以及细胞核拓扑异构酶Ⅵ也参与了该逆行信号[42-45]。叶绿体中ROS还产生于PSI,SOD将电子传递产生的O2·-氧化成 H2O2,相对于1O2,H2O2更稳定,可以作为叶绿体中的信号,从细胞器中扩散出来,以转导细胞质中的信号,以便随后与其他细胞成分进行信号整合[46]。叶绿体管状突起的发现,对叶绿体信号通路有了新的认识[47]。这些管状突起的形成取决于很多因素。植物与病原菌相互作用时,会产生管状突起使叶绿体和细胞核相连[48]。叶绿体产生的ROS也会导致管状突起的形成[49]。由此可见叶绿体延伸可以将氧化还原信息直接馈送到细胞核,以进行后续反应。
3.2 ROS参与线粒体和细胞核之间的交流
线粒体中呼吸代谢电子传递链中产生ROS。在植物中,线粒体至细胞核的逆行信号导致一组特定的核基因表达升高[50]。其中,ROS诱导的转录因子ABI4通过与启动子区抑制因子B顺式作用元件结合来调控核编码的替代性氧化酶AOX1(alternative oxidase 1)的表达[51],该酶被认为是线粒体到核逆行信号的标志性应答者[47]。此外通过对线粒体应激响应基因的功能分析,在其启动子中发现了一个典型的基序MDM(mitochondrial dys-function motif),该基序可被NAC转录因子感知[52]。当ROS存在时该转录因子编码的蛋白被水解释放,并转运到细胞核中,介导线粒体与细胞核的通信[53]。自由基诱发细胞死亡蛋白RCD1(radical-induce cell death1)与来自线粒体复合体III中的ROS相关逆行信号转录因子ANAC013和ANAC017相互作用,由于PSI电子受体的缺失,导致叶绿体ROS的改变,而这种改变通过逆行信号传导影响RCD1的稳定性,当RCD1失活时会导致转录因子激活的线粒体功能障碍刺激基 因(mitochondrial dysfunction stimulon,MDS)表达量增加,其蛋白产物选择性氧化酶AOXs(alternative oxidases)积累,导致叶绿体中ROS减少,影响叶绿体的氧化还原状态,增加了对光合器的保护(图3)[54]。RCD1介导线粒体和叶绿体之间的ROS信号通路,进而维持了线粒体和叶绿体的氧化还原平衡。植物正常生长发育,细胞器和细胞核之间的协调是必不可少的,需要组织之间持续不断的交流,ROS信号通过诱导氧化应激信号激活转录因子使核基因的表达编码蛋白质作用于相邻的各细胞器。
3.3 ROS参与线粒体和叶绿体之间的信息传递
叶绿体向线粒体传导信号可能是通过调节核基因的表达完成的。线粒体通过MDS基因表达相关蛋白来响应ROS对叶绿体的干扰[50]。相关研究表明拟南芥ABI4同时调控Lhcb(Light-harvesting chlorophyll a/b-binding protein)和AOX1A(Alternative oxidase1a)基因,连接细胞核协调叶绿体和线粒体的通信[39,51]。在拟南芥中,有许多蛋白同时定位于线粒体和叶绿体中[55]。正是由于蛋白的双重靶向使得线粒体和叶绿体进行交流。失活的线粒体复合物Ⅰ诱导双半胱氨酸蛋白定位于细胞质、叶绿体、线粒体,可以将线粒体功能障碍信号传递到细胞质,随后传递到叶绿体等其他细胞器[56]。线粒体复合物Ⅰ的失活导致ROS产生,推测ROS在线粒体和叶绿体信号交流之间起着非常重要的作用。此外,水杨酸(salicylic acid,SA)信号在叶绿体和线粒体信号传递中也起着重要的作用。SA是在叶绿体中合成的[57],主要作用于病原体胁迫以及非生物胁迫响应[58]。病原菌诱导的SA主要是通过ICS1(isochorismate synthase1)和 ICS2(isochorismate synthase2)两种酶合成的[59]。叶绿体中产生的1O2可以诱导EX1和EX2来调节SA水平。外源施加SA可以通过抑制线粒体复合物Ⅲ的活性来诱导线粒体ROS的产生[60-61]。在拟南芥 eds5(enhanced disease susceptibility5)突变体中,由于应激反应诱导的SA不能运输到叶绿体外[62]。从而推测EDS5在SA从叶绿体运输到叶绿体外这一过程中起着重要作用(图3)。植物的线粒体电子传递链组分中电子载体过度还原产生的ROS作为信号分子会增加线粒体膜的通透性,诱导细胞发生程序性死亡[63-64]。在拟南芥mod1(mosaic death 1)突变体中发现ROS的积累和异常的形态表型,然而通过降低线粒体电子传递复合体的活性可以部分恢复叶绿体中由于脂肪酸生物合成缺陷而引起的mod1异常表型,这一研究表明叶绿体中产生的信号可能导致线粒体电子传递链产生ROS[65]。进一步研究表明,mod1突变体中NADH在叶绿体大量积累,NADH与草酰乙酸在plNADMDH(plastidial nad-dependent malate dehydrogenase)的催化作用下生成苹果酸,通过DiT1(dicarboxylate transporter 1)运输至细胞质,再通过苹果酸-草酰乙酸穿梭系统进入线粒体,在mMDH1(mitochondrial malate dehydrogenase 1)的催化作用下进而导致线粒体中NADH水平升高,诱导线粒体电子传递链并引发ROS的产生[66]。叶绿体中ROS产生的信号通过苹果酸穿梭递到线粒体中激发ROS产生(图3)。
3.4 ROS参与其他信息传递途经
目前所了解的细胞器到核的信号转导途径在空间、时间、生理和代谢上是相互联系的。与叶绿体和线粒体相似,过氧化物酶体中的O2·-是在过氧化物酶体膜中产生的,随后通过SOD催化生成H2O2。此外,在过氧化物酶体的光呼吸途径中,乙醇酸氧化酶也会产生H2O2,随后H2O2通过扩散传输到细胞质中发挥作用[67]。在过氧化物酶体中为了保证ROS的动态平衡,CAT也会将过多的H2O2分解。另外,在质膜上产生的ROS在质外体中积累,在植物生长和防御中起着关键的作用。研究表明,转录因 子 HBI1(homolog of BEE2 interacting with IBH 1)通过差异控制NADPH氧化酶(NOXs)和过氧化物酶(POXs)的表达进而调节质外体中ROS的稳态达到免疫生长平衡[68]。

图3 ROS介导的细胞器信号转导Fig.3 ROS-mediated in organelles signaling
总之,H2O2是最稳定的ROS,可以从细胞器转移到胞质和细胞核,从而导致胞质和细胞核氧化还原状态的改变,触发信号网络,进行信息传递。
4 ROS信号在细胞间的作用
植物的正常生长发育是通过细胞和组织之间的通讯交流来协调实现的。胞间连丝是连接植物相邻细胞的通道,其孔径的大小是由胼胝质的厚度决定的[69]。研究表明,拟南芥gat1(gfp arrested trafficking1)突 变 体 中,GFP(green fluorescent protein)只在根中的韧皮部中被发现,未能移动到整个根尖,其体内过氧化氢的含量高于野生型,胼胝质也有所增加,推测过氧化氢可能作为信号分子调节胼胝质的生成,从而影响胞间运输[70]。与之相反的,在拟南芥ise1(increased size exclusion limit 1)突变体中过氧化氢的含量也发生了明显的升高,但是并没有降低胞间连丝的运输能力,GFP在表皮细胞的扩散效率明显提高,胞间连丝的运输能力得到增强[71]。由此可见,一定浓度的过氧化氢可以提高胞间连丝的通透性,促进细胞通道连接,但是这个具体浓度还有待明确。目前提出了H2O2通过使细胞壁松弛,使镶嵌于细胞壁的胞间连丝重建,从而改变了它们的转运能力[72]。胞间连丝是许多信号传导的必经之路,包括小分子物质的自由扩散和大分子物质的运输,如植物病毒运动蛋白、转录因子、mRNA等。许多胞内转录因子能够通过胞间连丝进入相邻的细胞发挥作用,调节植物发育。基因沉默信号在植物内的传播也是通过胞间连丝来转运的,H2O2在控制沉默信号移动起着关键的作用[73-74]。
5 展望
植物在逐渐适应环境的同时形成了很好的适应机制,这些机制既能发生在植物体受到环境胁迫的组织也能发生在未受环境胁迫的组织,这种系统性获得性适应(systemic acquired acclimation,SAA)在避免植物受到不利环境危害的过程中发挥着重要作用[75]。ROS作为重要的信号分子参与植物的生长、发育、分化。研究发现,对植物进行一定的体外ROS处理,可显著改善植物的生长特性,这对植物调节许多生理生化过程有益。植物受到非生物胁迫时产生的氧化还原信号会与植物激素、Ca2+、RNA、MAPK(mitogen-activated protein kinase)等其他信号分子相互作用引起一系列次级信号,从而导致基因表达差异[76-78],通过不同的信号途径来维持自身氧化还原平衡。目前对活性氧是如何与其他信号分子相互作用而实现细胞内部信息交流,如何影响细胞通道连接的机制尚不明确,有待进一步深入的研究。