植物VIGS技术及其在林业科学中的研究进展
2021-06-23高鹏飞席飞虎张泽宇胡凯强陈凯魏文桃丁家治顾连峰
高鹏飞 席飞虎, 张泽宇 胡凯强 陈凯 魏文桃 丁家治 顾连峰
(1.福建农林大学林学院 基础林学与蛋白质组学中心,福州 350002;2.福建农林大学生命科学学院,福州 350002)
最新一代的Nanopore纳米孔测序技术和PacBio的异构体测序(Iso-Seq)技术可便捷鉴定出长片段的基因信息[1],现在已经广泛运用在植物学研究之中[2]。由于测序技术的飞速发展,测序仪器更加便携,检测时长大大缩短,所以不同植物物种的基因组序列信息也随之激增[3],包括银白杨(Populus alba)[4]、挪威云杉(Picea abies)[5]、木麻黄(Casuarina equisetifolia)[6]等林木基因组被测序。虽然大规模高通量的基因序列已知,但相对应的基因功能分析却相对滞后,特别是确定林木物种基因功能仍然是一项艰巨的任务,因此开发对应物种实用高通量的基因功能研究工具极为重要。
目前林木存在树体高大、世代周期长、外源基因表达困难等问题[7]。利用植物稳定过表达可以定向改造植物的遗传特性在林木研究中虽已有应用报道[8],然而会受植物组织再生率、调控元件、转化频率等条件的限制,并且多数林木物种的稳定遗传转化体系较为困难,特别是在裸子植物针叶树种中。化学诱变、辐射诱变、T-DNA插入、基因枪微弹轰击等手段[9]都也可以引发植物基因功能的丧失或者整合外源基因,但这些技术难以做到高效特异性的靶向目的基因。针对以上两种问题使用VIGS可作为研究林木基因功能的一种快速有效的替代方案[10],该技术与 RNA 干扰(RNA interference,RNAi)都属于转录后基因沉默(post-transcriptional gene silencing,PTGS)[11]。VIGS 利用了病毒侵染植物后引发RNA沉默,病毒被设计修饰后成为携带植物自身基因转录物的片段则会靶向降解该特定内源基因的转录本序列从而引发靶基因序列的特异性沉默达到研究该基因功能的目的[12-13]。简而言之,这是一种植物运用自身特异性降解病毒基因组的先天防御途径[14]所形成的反向遗传学工具。早在1995年 Kumagai等[15]就将本氏烟(Nicotiana benthamiana)中八氢番茄红素脱氢酶基因(phytoene desaturase,PDS)的cDNA片段置于烟草花叶病毒(tobacco mosaic virus,TMV)中,对本氏烟进行侵染后叶片出现出了白化的表型并成功抑制了内源PDS基因的表达。这种技术有望成为在林木物种中探究基因功能的利器。本文将系统综述VIGS技术的机制和相关技术细节,同时着重讨论VIGS在林木基因功能研究中的应用。
1 VIGS机制
植物具有多层防御策略来防御病原体的传播,可以在植物体单细胞和整个生物体水平上对抗病毒感染。病毒在传播复制期间会形成的双链RNA(double-stranded,dsRNA)从而触发宿主的第一级防御反应[16]。植物细胞内的抗性蛋白核苷酸结合亮氨酸重复受体(nucleotide-binding leucine-rich repeat,NB-LRR)可以检测细胞内活性[17]触发第二级免疫策 略 ETI(effects Sub-triggered immunity)的启动,从而控制感染部位细胞的程序性死亡从而限制病原体在植株体内的传播。来自于病毒的感染性克隆被称为病毒载体,靶基因与病毒载体相连接后将重组病毒载体侵染入植物细胞开始转录翻译,植物开启自身第一级防御系统开始VIGS进程(图1)。来自于病毒的RNA通过RNA依赖性RNA合成酶(RNA-dependent RNA polymerase,RDRP)形成了包含发夹结构的dsRNA[18]。dsRNA被宿主编码的核酸内切酶(dicer-like,DCL)蛋白识别,其中DCL4和DCL2蛋白直接参与RNA病毒防御系统[19],DCL4是植物细胞中对病毒的主要防御者,抑制病毒在细胞间传播对VIGS进程起到了负调控作用,也是细胞内VIGS开始触发的主要因素。DCL2可以促进细胞间进行基因沉默的信号因子扩散,还能够靶向降解植物细胞中的病毒RNA是VIGS体系中必不可少的一部分。DCL蛋白将dsRNA切割成21-24个核苷酸的小干扰 RNA(small interfering RNAs,siRNA)。由DCL蛋白产生的双链siRNA被分离为单链siRNA加载到AGO(argonaute)蛋白上,将这些siRNA进一步加载到RNA诱导的沉默复合体(RNA induced silencing complex,RISC)上组成了效应子复合物[20],引导siRNA与植物内源的的RNA靶向互补结合后通过核酸内切酶对转录物的裂解来沉默RNA造成基因功能的丧失[21]。
2 VIGS研究方法
2.1 VIGS载体构建流程
VIGS涉及3个主要过程:设计靶向沉默宿主基因片段与病毒基因载体进行连接;以适当的方法感染植物宿主;植物进行防御病毒机制沉默靶基因[22]。为了对较大的文库进行筛选,Liu等[23]建立了含有Gateway克隆位点的烟草脆裂病毒(tobacco rattle virus,TRV)载体,去除了冗长的亚克隆步骤。VIGS载体构建克隆的植物靶基因的片段通常为300-500 个碱基对(base pairs,bp)[24],该长度片段能够有效的产生siRNA,短片段会降低沉默效率,而过长的片段会增加沉默脱靶的可能性。插入序列的大小上限取决于病毒在细胞中的移动快慢、病毒载体的大小、以及病毒在不同植物物种中的感染效率。在对烟草的研究结果显示,即使是来自相同靶基因的不同区域的相似大小片段都可导致不同的沉默效率,本氏烟中200-1 300 bp的插入片段范围内都可以导致有效的基因沉默[25]。因此针对不同基因的VIGS实验都需考虑沉默目标的靶基因区域。另外 应 通 过 BLAST(basic local alignment search tool)进行比对来确定构建的基因片段是否具有特异性。靶基因目标片段一般选择在3′UTR区域的序列[25],因为基因中这部分序列具有高度保守性,特异性的基因片段能够导致特异性的沉默。构建载体时可以在病毒载体中插入多个基因片段以扩大靶向范围沉默不同的基因,Peele研究出使用番茄金色花叶病毒(tomato golden mosaic virus,TGMV)构建的VIGS载体在拟南芥(Arabidopsis thaliana)中共同沉默了镁螯合酶亚基基因(magnesium chelatase subunit,SU)和增殖细胞核抗原基因(proliferating cell nuclear antigen,PCNA)[26]。Turnage 等[27]构建的白菜卷叶病毒(cabbage leaf curl virus,CbLCV)VIGS载体也可在拟南芥中同时沉默CH42和PDS两个基因。

图1 VIGS分子机理Fig.1 Molecular mechanism of VIGS
2.2 VIGS接种侵染技术
TRV介导的VIGS是在双子叶植物中使用最广泛的VIGS体系之一,在较多的植物物种中都已经成功侵染,并表现出较高的沉默效率。TRV载体研究本氏烟和番茄(Solanum lycopersicum)的VIGS技术相对较成熟[28],将构建好的病毒载体导入幼苗中,随着植株的生长,病毒从接种部位扩散到植物的发育区域并开始进行PTGS过程。基因沉默后表型产生与病毒传播的速度一致,轻微的病毒症状通常在接种7-10 d后开始产生,在2-3周内向植株新生的幼嫩叶片扩散,通常在3周之后即可产生最易观察的表型。针对不同植物种类和实验类型的研究目的,已经开发了多种农杆菌对植物接种侵染的不同方法。例如通过用牙签挑选农杆菌并将牙签刺入幼苗叶片中就可以充分感染,对叶片、叶腋分生组织进行注射渗透,真空渗透,或者用农杆菌喷洒幼苗也都可以获得良好的沉默效果[23,29]。使用农杆菌进行侵染的方法还应针对不同物种进行开发改进,以及对病毒载体进行改造,优化接种技术。TRV这样的二元病毒,其中PTRV1含有编码RNA依赖性RNA聚合酶,运动蛋白和16K富含半胱氨酸蛋白的基因,PTRV2含有编码外壳蛋白的基因和用于克隆目的基因的限制位点。基于TRV的VIGS载体需要PTRV1和PTRV2两组分的混合共表达才可以发挥侵染作用。如以最广泛使用的TRV载体为例展示了侵染技术路线(图2)。
2.3 接种后植株的环境影响
植物生长的外界坏境对病毒载体侵染植株的活性有直接影响[30],在环境因素中温度是影响病毒有效传播的最重要因素之一。粮食作物多为单子叶植物,具有较高的经济价值。针对小麦(Triticum aestivum)感染病毒的最适温度研究发现,其生长的最佳环境温度为15-20℃。中国小麦花叶病毒(Chinese wheat mosaic virus,CWMV)在低温17℃下对小麦PDS基因的沉默效率达到了70%-84%从而产生了明显的光漂白现象,而同样温度下大麦条纹花叶病毒(barley stripe mosaic virus,BSMV)和狐尾花叶病毒(Foxtail mosaic virus,FoMV)并未造成任何的沉默表型[31]。高粱(Sorghum bicolor)感染雀麦草花叶病毒(Brome mosaic virus,BMV)后在温度22℃下仅有10%的植株产生病毒感染症状[32-33],对实验体系进行了环境温度的改进发现高粱接种BMV沉默载体后转移至环境温度为18℃温室中生长4周,植株出现基因沉默的表型为100%,显著提高了VIGS实验的沉默效率[24]。因此在实验中检测病毒适宜感染的温度和观测病毒感染起作用的时间都应该进行预先的实验探究[34]。
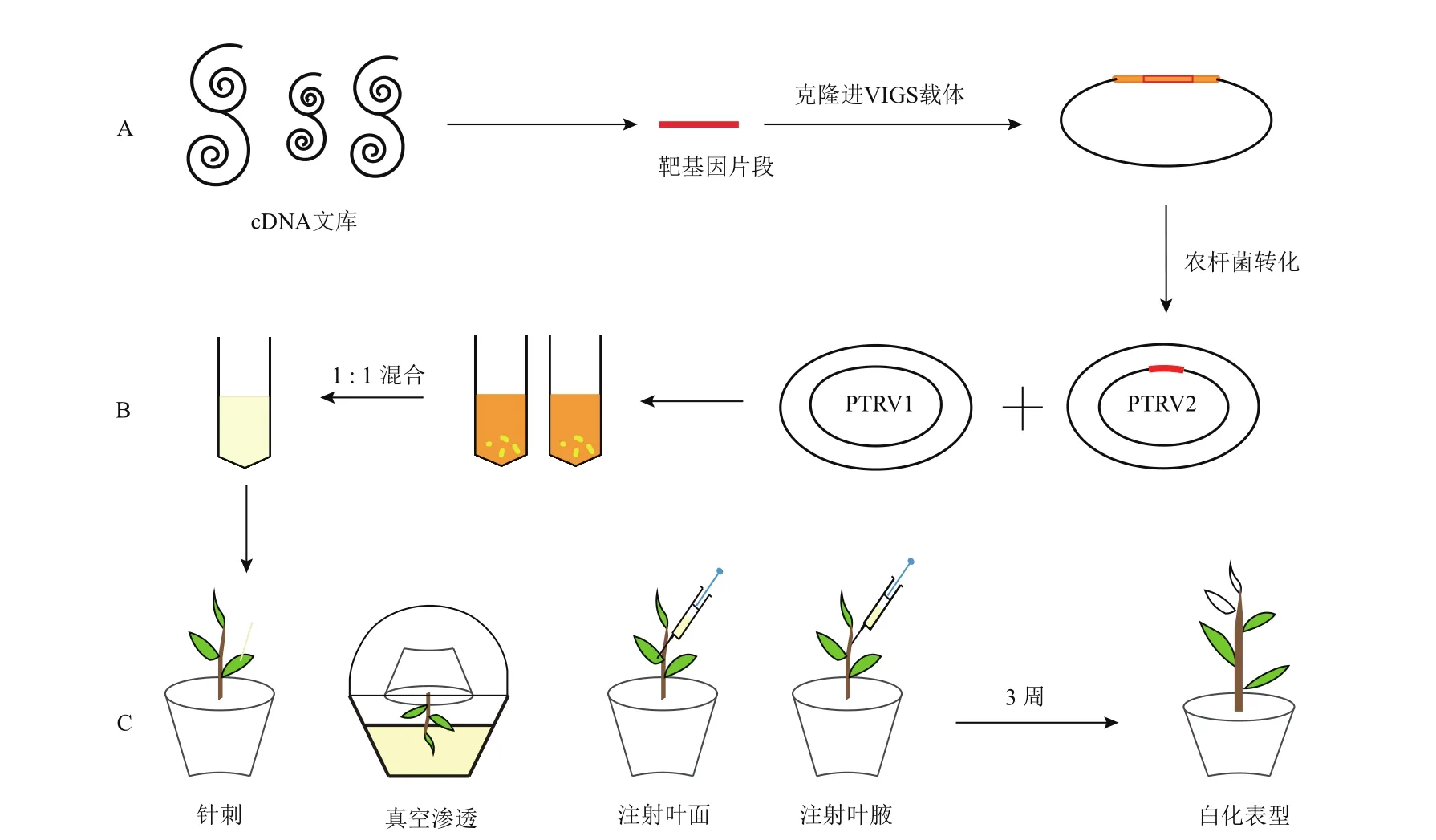
图2 VIGS侵染技术示意图Fig.2 Schematic diagram of VIGS infection technology
针对双子叶模式植物本氏烟和番茄进行基因沉默实验通常使用TRV体系,植株在20-22℃的温室中生长3周就可以产生明显的白化表型[35],然而在对番茄基因沉默体系进行改进时发现在低温15℃环境时番茄叶片、花朵、果实中的PDS基因的转录本水平发生了更显著的降低,叶绿素含量降低了90%以上[36]。双子叶植物通常使用根癌农杆菌转化法,转化效率高低取决于环境温度条件与农杆菌病原体之间的相互作用能否促成细胞外菌毛(etracellular pilus,T-pilus)的形成。Vir(virulence)基因的大量表达可促进T-pilus形成,它由VirA和VirG两部分控制,高于28℃的温度会抑制T-pilus的形成,并降低Vir蛋白的稳定性温度,超过32℃会导致VirA磷酸活化功能的丧失从而降低Vir基因的表达[37],因此不耐高温的农杆菌株系无法在高于28℃情况下进行转化[34]。实验探索过程中必须在确定接种病毒的最佳方式以及维持植物良好的生长条件方面投入巨大的时间和人力成本。对于特定植物和病毒载体均有最佳温度范围来使病毒侵染并在植物体内传播,因此在环境温度可控的人工气候室中进行VIGS实验有助于获得良好且可重复的的稳定侵染效率。
2.4 VIGS的实验对照和沉默效果的评估
每个VIGS实验中都要进行沉默有效性的检测。常见的阳性对照是针对PDS基因和ChlH(chelatase subunit)基因进行的沉默[38-39],会产生明显的叶片变白表型。使用马铃薯X病毒(potato virus x,PVX)载体针对在光合作用第二阶段中参与叶绿体类囊体发育的Ftsh(filamentation temperaturesensitive H)基因沉默后同样也使本氏烟产生了白化表型[40]。在本氏烟和茄子(Solanum melongena)中也有针对SU基因沉默作为阳性对照[41-42],植株叶片变黄产生了黄色斑点。这些基因都参与植物的光合作用,特异性沉默后可以使植株沉默区域产生最容易看见的光漂白表型。但是根据不同物种的特性也需要进行适时的改进,如果病毒感染所产生的表型与沉默PDS或ChlH所产生的白化表型比较相似的话,针对白化基因的沉默就不是衡量VIGS实验是否成功的视觉标签,所以为了解释可能由于病毒本身引起的表型变化,在植物中接种不含目的基因的空载作为阴性对照是极为必要的。在对高粱基因沉默时针对植物发育的关键蛋白泛素基因(Ubiquitin,Ubiq)构建了载体作为阳性对照,沉默后使植株叶片产生了褐变的可变表型,因此沉默Ubiq就是高粱的最佳视觉标记基因[24]。
VIGS技术沉默基因的效率和特异性需要通过逆转录然后进行聚合酶链式反应(RT-PCR)来进行确认各种组织中基因的表达量和不同样品实验处理间基因表达的差异。实时定量RT-PCR在实验进程中应该注意以下因素:提取高质量的RNA,有效去除DNA的污染,设计的引物无引物二聚体[43]。RTPCR引物设计的区域应该确保位于靶基因转录本的区域,但是要处于VIGS载体中克隆的序列之外区段,并且要确保特异性而非来自其他相似同源的基因[22]。
3 VIGS相关的软件工具
植物在PTGS期间存在有基因沉默脱靶的高风险,VIGS实验的成功需要确保靶基因的高度特异性,以及较高的沉默效率。现在已开发出许多软件来辅助进行预测VIGS沉默效率以及构建VIGS载体(表1)。
4 VIGS在林木基因功能研究中的应用
在生命周期较长的多年生木本植物中,较长的世代限制了遗传转化体系的建立,所以建立快速可靠的转化系统对于木本植物尤为重要。随着林木中第一个多年生木本植物毛果杨(Populus trichocarpa)的全基因组序列的完成[54],针对林木特有的性状例如木材形成,多年生生长特性,季节性变化等这些在拟南芥和水稻这两个模式植物无法解决的问题上开启了新的研究领域[55]。由于病毒诱导的基因沉默具有实验步骤易于操作且产生表型所需的时间比较短等优势,VIGS已经从以下不同的方面运用在林木功能基因组学研究之中。VIGS系统在木本模式植物杨属胡杨中及果树、观赏树种中进行的基因沉默研究结果总结参见表2。
4.1 林木物种中病毒载体的开发建立
TRV载体在对林木物种中基因功能的探究中发挥了重要作用。与其他病毒相比TRV具有在植株中的传播感染强,产生的病毒症状轻,可以更强烈降低基因的表达量等优点[69],因此TRV在林木物种中得到了广泛的运用。麻风树作为矿物资源和生物染料的替代来源,其种子中含油量高达30%,利用TRV载体对麻风树基因的高通量筛选后确定了其中脂肪酸合成、发育调控和自然毒素分泌3个功能相关的基因[57]。TRV载体还在经济价值较高的果树中成功运用,例如对桃子沉默ChlH基因,载体侵染桃树幼苗叶子15 d后接种的区域就开始褪色最后产生了白化叶片[61],以及在对樱桃树调节花色苷合成途径的MYBA基因沉默后生长出缺少红色素的樱桃果实[62]。除此之外,TRV载体在抗逆性较强的林木物种中也被成功运用,例如运用VIGS技术在胡杨中沉默了PDS基因,在实验中设置了温度梯度对胡杨树的侵染最适环境进行探究发现在28℃时沉默效率最高[56],使其叶片产生了光漂白的表型。因此使用TRV载体在较难稳定转化的林木中的应用具有较大前景。

表1 基因沉默相关设计软件Table 1 Gene silence related design software
针对不同的林木物种应该开发建立特有的新病毒载体,以扩大VIGS研究体系范围,进行最有效的基因功能研究。目前开发林木物种中的VIGS载体工具已经展开并获得了初步的成功。感染相对广泛的苹果潜伏球形病毒(apple latent spherical virus,ALSV)最初就是从苹果树中分离出来,它是一种直径为25 nm的球形小病毒[70],由两组分单链RNA基因组(RNA1和RNA2)和3种不同的衣壳蛋白组成[71]。尽管苹果树是ALSV唯一的自然宿主,但是它可以通过人工接种去感染拟南芥、本氏烟、重要的经济农作物(番茄、黄瓜(Cucumis sativus)、大豆(Glycine max)、苹果、葡萄(Vitis vinifera)、柑橘(Citrus reticulata))等[72-74],在这些物种中ALSV都可以导致有效的基因沉默。木薯是全球最重要的块根作物之一,全球八亿多人以它生长产生的块状淀粉根为主食,尽管现在已有遗传转化方案,但是耗时较长且方法困难,并且受到生命周期长,杂合度高和近亲衰退的限制[75]。基于木薯自身的非洲木薯花叶病毒(African cassava mosaic virus,ACMV)的VIGS载体可以快速高效地侵染木薯,针对PDS和标记基因UidA(β-glucuronidase enzyme)沉默后在木薯叶子、纤维根、块状根等这些不同器官中可视化的观察到基因沉默结果[29],证明了VIGS可以高通量的分析木薯基因功能。
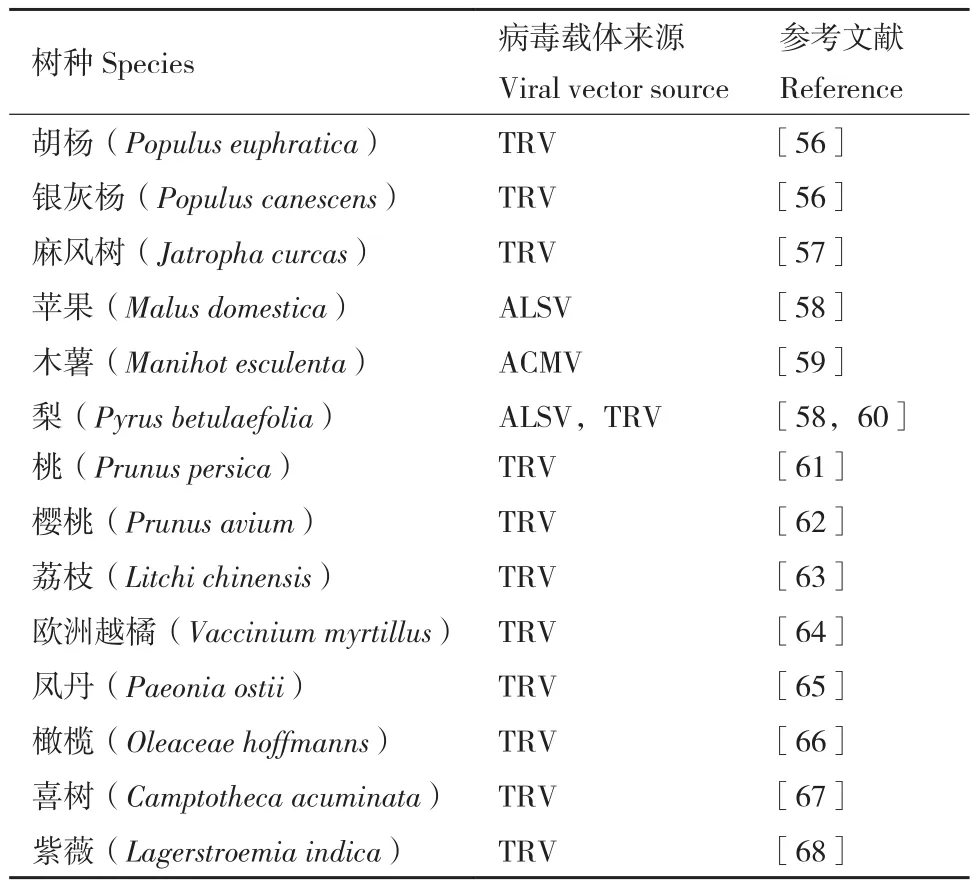
表2 VIGS系统在杨树属等林木物种中的研究应用Table 2 Research and application of VIGS system in poplar and other forest tree species
4.2 林木物种中生长结构和激素相关基因解析
VIGS在林木中生长结构以及抗逆机制中的研究中具有重要意义。木质部次生细胞壁的形成为生产生物乙醇提供了必要的原料,工业生产中广泛运用的木材和纤维也主要由次生细胞壁组成。与拟南芥相比木本植物的次生细胞壁调控网络更加复杂,因此了解木本植物中次生细胞壁形成的特异性转录调控非常重要[76]。VIGS体系针对DUF579(domain unknown function 579)和 KNAT7(knotted-like homeobox of Arabidopsis thaliana 7)的基因沉默后,发现植株的细胞壁松弛,糖脂提取后显示多糖提取率增加[77],研究结果有助于深入了解木质部纤维素的产生机制。VIGS在研究树木韧皮部中运输mRNA等大分子快速响应干旱胁迫机制也发挥了重要作用。梨树嫁接到砧木上后,RNA测序分析显示PbDRM(pyrus betulaefolia drought responsive mobile gene)转录本丰度显著增加,RT-PCR检测到PbDRM从砧木转移到接穗上从而使接穗的抗旱性显著增加。并且通过VIGS下调PbDRM发现增加了梨树的干旱敏感性,证明了PbDRM作为干旱胁迫下梨树韧皮部的移动信号[60]。
木本植物的生长与生长素、赤霉素(GA)、细胞分裂素等激素有着显著的相关性。GA的合成过程中植物特有的发育和信号传导关键因子GRAS(GAI-RGA-and-SCR)蛋白质家族发挥了关键作用,并且GRAS在植物结构中具有重要的调节效应可促进枝条的下垂[78],针对不同生长结构表型植物利用VIGS工具对GRAS基因功能的探究有助于深入了解结构控制机制。紫薇有枝干直立和枝条矮化下垂的两个品种,使用TRV载体针对枝条下垂品种紫薇的GRAS1基因进行基因沉默,侵染15 d后发现下垂枝条出现了向上生长的表型,其中一些树枝的分枝角度甚至接近于直立品种分枝的角度,30 d后产生了更多的腋芽和更多畸形的分枝[68]。该研究解析了林木中枝干下垂的调控机制,为林木的根枝生长和分层定位提供了重要基础,在林木结构水平上阐明了分子功能[79]。
5 VIGS在林木基因功能研究中的局限性以及解决方法
VIGS可导致对非靶基因的表达抑制,产生脱靶沉默现象,造成基因的沉默效率降低,这在缺乏基因组测序数据的林木物种中更容易发生。脱靶沉默取决于多方面的因素[80],如靶基因的位置,dsRNA的长度,转化侵染植物的方法是否合适,VIGS载体感染的效率等方面[25]。针对上述问题在构建VIGS载体时可以使用SGN,siRNA-Scan等软件来选择基因沉默区域并且评估PTGS过程中所产生的21nt siRNA 是否能够发挥的功效[44,46]。Zhou 等[81]提出一种构建载体的改进方法,使用70 bp的基因片段其中包含来自3个不同基因相互不匹配的21 bp碱基的片段,使用这种改进的方法可以减少VIGS的脱靶沉默现象并且特异性的敲除基因家族中的高度相似的成员。改进载体的同时也应该探索新的病毒诱导机制,Ossowski等[52]证明了卷心菜卷叶病毒(cabbage leaf curling virus,CaLCuV)和TRV在本氏烟中使用新开发的微小RNA介导的病毒诱导基因沉 默(microRNA-based virus induced gene silencing,MR-VIGS)方法,也可以降低脱靶现象的产生[82]。
VIGS难以完全抑制靶基因表达,因此即使降低了靶基因的转录水平但仍然可以产生足够的功能性蛋白,所以在沉默的植物中可能未观察到表型,或者表型不明显。并且如果仅病毒接种植物就可以改变植物表型[83],那么由于基因沉默而导致的细微表型有可能被病毒症状掩盖,因此对沉默表型的解释会变的更加复杂化。许多病毒在增殖和传播过程中会删除插入的基因[84-85],因此在实验过程中应当加入空载处理,有助于区分沉默基因所产生的表型和病毒载体诱导的症状[10]。
6 利用VIGS研究基因功能的优势以及未来前景
研究基因功能的最简单最有效的方法是减弱基因的表达或产生不编码功能性蛋白质的突变体。随着植物全基因组序列的获得,需要大规模分析来确定数千个基因的功能。VIGS是新兴的植物功能基因组学工具之一,虽然有一定的不足但也避免了许多传统功能分析方法的局限性[86],在基因鉴定和功能分析方面具有巨大的潜力。VIGS具有的优点以及在未来的前景方向主要包括以下几个方面:
第一,VIGS不需要完善的参考基因组序列,只需要部分转录组序列的信息就可以对待研究的的目的基因造成基因沉默[87]。虽然现在高通量测序非常普及,但是很多林木类非模式物种依然没有参考基因组序列,对于这种非模式物种的基因功能研究,VIGS明显具有十分明显的优势。
第二,VIGS不需要稳定的植物遗传转化,实验操作步骤简单。可以在植物生命周期内的侵染短暂几周后快速产生表型,因此在难以转化的林木物种中基因功能的表征变得容易[22]。最近的研究表明,在植物在适当的条件下,VIGS在整个生命周期中可以进行持续长时间高效的VIGS[88],甚至可以持续数年直到植物死亡。大豆中ALSV介导的VIGS针对PDS基因进行沉默后叶片出现了高度均匀的光漂白表型,并且在整个生命周期中稳定的维持了VIGS。基因沉默传播到20%-30%的种子中,所有基因沉默的种子生长后的幼苗都表现出均匀的病毒感染症状和高沉默效率产生了白化表型[89]。到目前为止,VIGS 在植物激素代谢合成[90]、出苗活力[91]、花果实发育[92]、外界应激非生物和生物胁迫[93]及衰老凋亡[94]等生命过程中的基因功能验证方面具有巨大潜力。特别是在那些难以进行转化且没有广泛收集突变体的林木物种中,VIGS是一种较为有效的研究基因功能的技术。
第三,针对具有高度同源性的基因家族进行有效的特异性敲除。基因家族中的基因具有相似保守的基因结构和功能结构域,通过将具有相同保守序列的两个或多个基因家族成员沉默,可以破解大多数基因家族参与的调节植物激素信号传导和逆境调控相关机制,以及植物中碳水化合物的合成、衰老、发育和次级代谢产物的合成途径[95]。真菌病原体(Setosphaeria turcica,ST)可以在玉米高粱叶片上引发叶枯病,是世界范围内的流行性病害,ST抗性基因家族中都具有CC-NB-LRR(coiled-coil nucleotidebinding site leucine-rich repeats)蛋白结构域参与识别病原体启动植物的防御反应。Martin针对ST基因家族中6个基因的共同区域设计了VIGS载体,沉默高粱后发现其中5个基因的表达量均发生了下调,病菌侵染后沉默组的抗病性显著下降,染病症状加剧,产生大量的真菌孢子[33]。因此VIGS在对基因家族中共同的特异性基因结构域的沉默,可以破解胁迫相关的复杂信号传导组分[96-97],促进了植物在多种胁迫下的基因功能研究。
第四,将病毒载体和最新的功能基因组学工具结合是着眼于当前以及未来的可能发展方向[98]。植 物 中 CRISPR/Cas(clustered regularly interspaced palindromic repeats)已经成为另一种强大有力的编辑技术[98]。在编辑系统中高效的传递载体尤为重要,Ali研究报道称TRV可以将引导RNA(guid RNA gRNA)传递到Cas9稳定表达的转基因本氏烟中,指导核酸内切酶至目标位点进行精确切割,虽然效率较低但也检测到了PCNA基因的靶向修饰[99]。Liu开发了一种更强大的基于DNA病毒CaLCuV用于CRISPR/Cas9介导的植物基因组编辑技术(virusbased genome editing,VIGE),精确地靶定 PDS和IspH基因引发突变,其编辑效率高达85%和75%并产生了白化表型。与TRV在细胞质中转录不同,CaLCuV可以在基因编辑的细胞核中复制并表达gRNA,所以显示出了较高的基因编辑效率[100]。这扩大了VIGS和CRISPER/Cas在植物基因组学和农业生物技术中的应用。
植物稳定的遗传转化体系中通常都需要植物组织培养和生成愈伤组织,并且林木物种中难以进行遗传转化。寻找一种不需要组织培养的转化方法使后代依然保持着高突变是植物转基因和基因编辑的主要方向。如果sgRNA可以进入到生殖细胞中,则使用RNA病毒载体就能导致产生更高频率的可遗传基因编辑。在2020年6月Ellison等[101]开发了一种植物体内基因编辑的方法,使用TRV病毒携带着单向导RNA(single guide RNA,sgRNA)感染进Cas9的转基因植物中,其中sgRNA与植物体内的FT(flowering locus T)基因融合,FT基因可以在植物体内叶维管束中转录后并转移到茎尖分生组织诱导开花,因此FT可以促进sgRNA进入茎尖分生组织并以较高的效率产生可遗传的基因编辑[102]。实验证明65%的后代幼苗基因组中都出现了PDS基因等位突变,并且该系统同时靶向了3个基因座的效率与靶向一个基因座的编辑效率相同,都获得了在编辑位点发生突变的后代植株。基于TRV载体的VIGS广泛运用在作物和模式植物的基因功能研究中[28],其引导基因编辑携带可移动的sgRNA在植物中创建可遗传的基因编辑有助于揭示基因功能,打开通往植物基因功能研究新世界的大门。
从分子生物学和反向遗传学建立开始,最初生物学家只是开发克隆新的病毒载体,随着高通量测序的飞速发展科研工作者利用VIGS技术更广泛的沉默了感兴趣的基因,但是没人在十年前预测出病毒载体可以辅助进行基因编辑,而现在VIGS作为辅助基因编辑工具在功能基因组学和病毒传递遗传中大放光彩。事实上这些转变证明了人们才刚开始摸索发掘VIGS的无限可能性,新技术推动了极具创新的新颖应用的发展,甚至VIGS还可以运用到非转基因递送技术中是运送脂质体纳米材料的理想途径[103]。VIGS作为重要的功能基因研究手段已经迎来了令人振奋的新时代。