急性出血坏死性小肠炎合并肝门静脉积气1例报告
2021-06-23佟印妮郑吉敏苏少慧
佟印妮,郑吉敏,苏少慧,张 建
1 华北理工大学 研究生学院,河北 唐山 063210; 2 河北省人民医院 消化科,石家庄 050051
肝门静脉积气(hepatic portal venous gas, HPVG)是临床上较为罕见的影像学征象。HPVG起病突然,病情进展迅速,预后较差,病死率极高,常被称为“死神之症”。急性出血坏死性小肠炎(acute hemorrhagic necrotic enteritis, AHNE)是一种罕见的小肠急性炎症性病变,以小肠的出血、坏死为主要特征。目前国内关于HPVG合并AHNE的相关报道极少,临床医生常因对两种疾病的认识欠佳而造成漏诊、误诊。现将河北省人民医院近期收治的1例急性出血坏死性小肠炎合并肝门静脉积气患者的临床资料及诊治过程报道如下。
1 病例资料
患者女性,73岁,因“持续性腹痛1 d”于2020年5月2日入院。患者1 d前进食草莓后出现腹痛,开始为上腹痛,为持续性钝痛,后转为脐周痛,性质同前,疼痛评分6分,伴呕吐,呕吐物为胃内容物,排洗肉水样大便共2次。当地医院予胃肠减压后症状未缓解,为进一步诊治就诊于本院。患者既往有2型糖尿病、高血压、右侧颈动脉斑块等病史,否认药物、食物过敏史。入院查体:体温38 ℃,脉搏96次/min,呼吸20次/min,血压115/64 mm Hg。急性病容,心肺查体未见明显异常。腹平坦,腹肌紧张,全腹有压痛、反跳痛,脐周为著。肝脾触诊不满意,移动性浊音阴性,肠鸣音减弱,双下肢无水肿。入院后查血常规:白细胞16.53×109/L,中性粒细胞百分比89.10%,血红蛋白115 g/L,血小板204×109/L;尿液分析:葡萄糖(++),酮体(-);便常规:潜血阳性;肝肾功能、电解质无明显异常;C反应蛋白138.68 mg/L;降钙素原0.669 ng/ml;腹部超声示:腹腔气体多,腹腔可见游离性液性暗区,右下腹较深处约37 mm。腹盆部CT示:肝门静脉少量积气(图1a),部分肠管壁增厚,周围脂肪间隙模糊(图1b),相应节段肠系膜密度增高并发小淋巴结,部分小肠积粪,考虑炎性病变可能性大。腹盆腔少量积液。结合病史、体征及辅助检查,诊断:(1)腹痛待查,怀疑急性胃肠炎、缺血性肠病、急性腹膜炎;(2)门静脉积气; (3)2型糖尿病等。给予患者禁食水、胃肠减压、头孢三代联合甲硝唑抗感染、改善微循环、营养支持等治疗,患者2 d后体温降至正常,心率、血压正常,但腹痛缓解不明显,腹部体征无好转,大便仍为洗肉水样。血白细胞有所下降,白蛋白、血红蛋白稍下降,复查腹盆部增强CT示:门静脉积气较前减少,小肠周围渗出较前增多,增强门静脉期及延迟期显示左腹部分小肠肠壁增厚、强化程度明显减低,相应区域肠系膜上动脉末端分支较稀疏,周围脂肪间隙模糊(图1c),相应部分肠壁可见积气(图1d),不除外缺血性肠病的可能。下腹部及盆腔内部分小肠肠管扩张积液,不全肠梗阻不除外,腹盆腔积液(图1e)。肠系膜CT血管造影示:肠系膜上、下动脉CT血管造影未见明显异常。行诊断性腹腔穿刺术,抽出桔红色浑浊液体,腹水常规示比重1.028,白细胞30 361×106/L,多核细胞28 958×106/L,红细胞17×109/L,血D-二聚体3.58 mg/L,腹水培养及血培养均未见致病菌生长。多次请胃肠外科、血管外科会诊,不考虑胃肠道穿孔、急慢性肠系膜血栓形成,修正诊断:(1)急性出血坏死性小肠炎;(2)急性腹膜炎;(3)门静脉积气;(4)2型糖尿病等。在原治疗基础上加用低分子肝素抗凝及罂粟碱扩血管、间断补充白蛋白治疗。外科建议继续保守治疗,病情无好转需急诊手术剖腹探查。经以上治疗,患者腹痛症状及腹肌紧张、压痛、反跳痛逐渐减轻,1周后开始进流食,各项炎性指标及影像学检查均明显好转,腹腔积液消失,共治疗12 d病情好转出院。
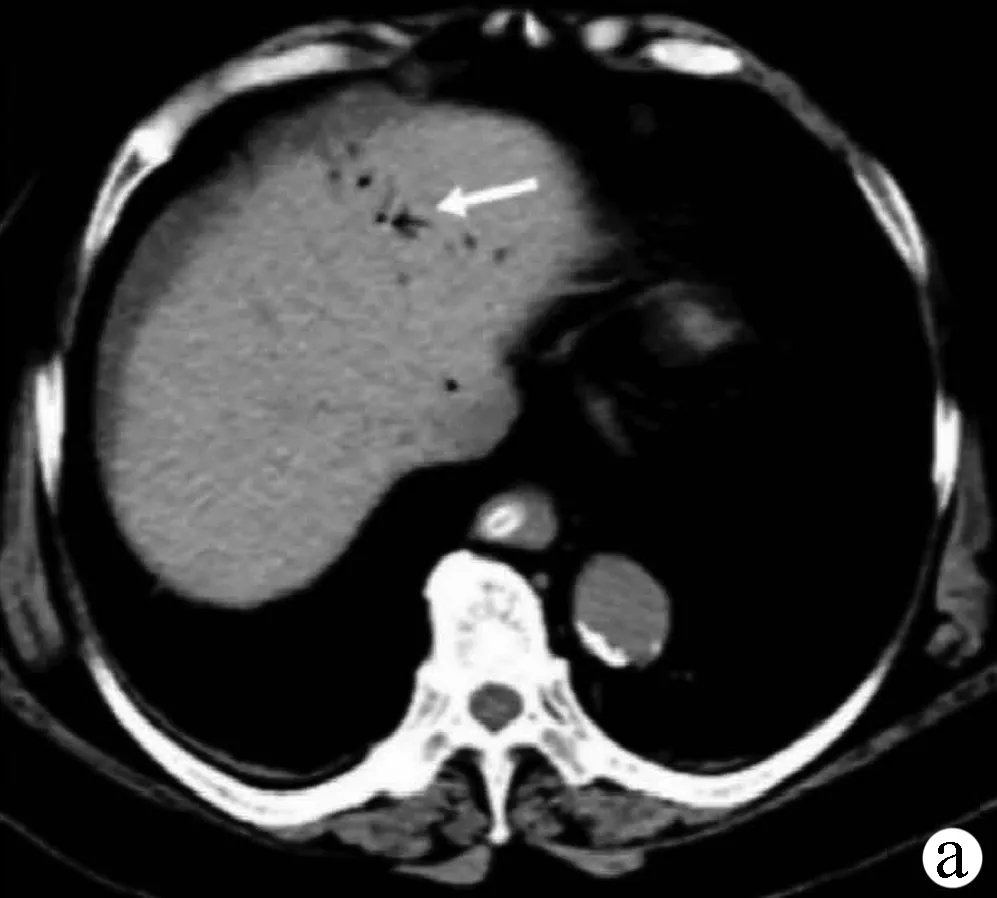


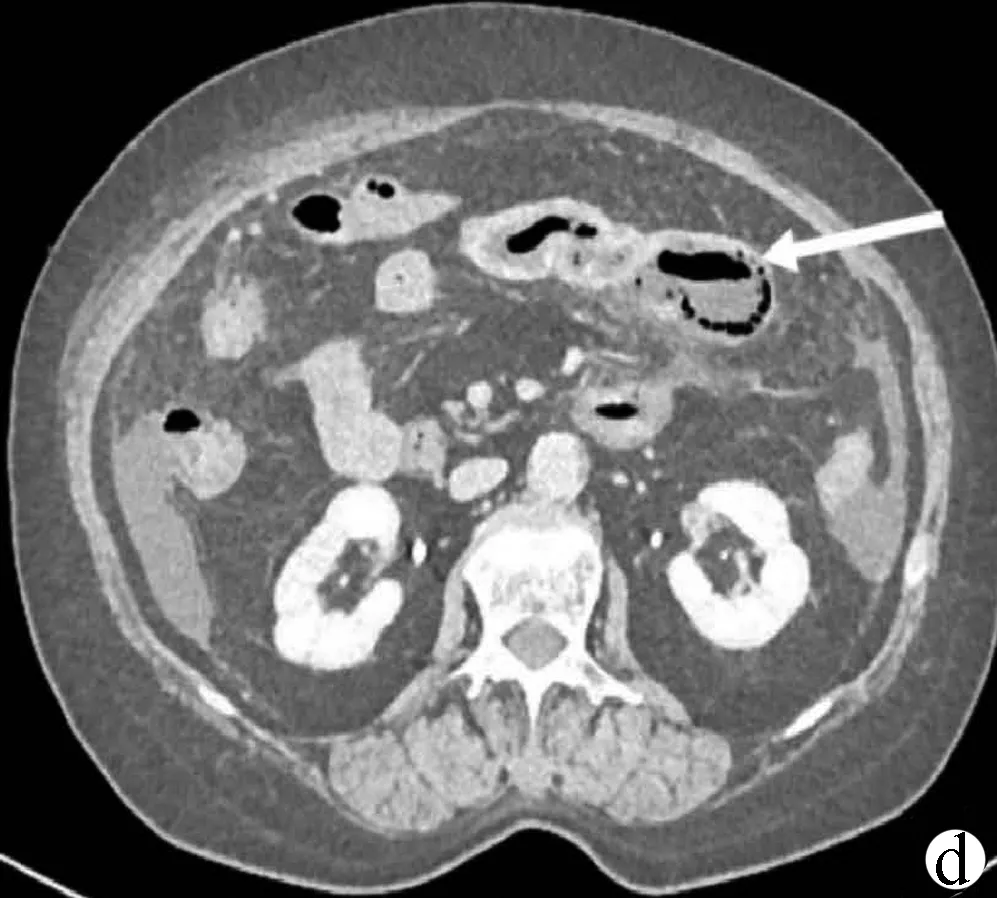
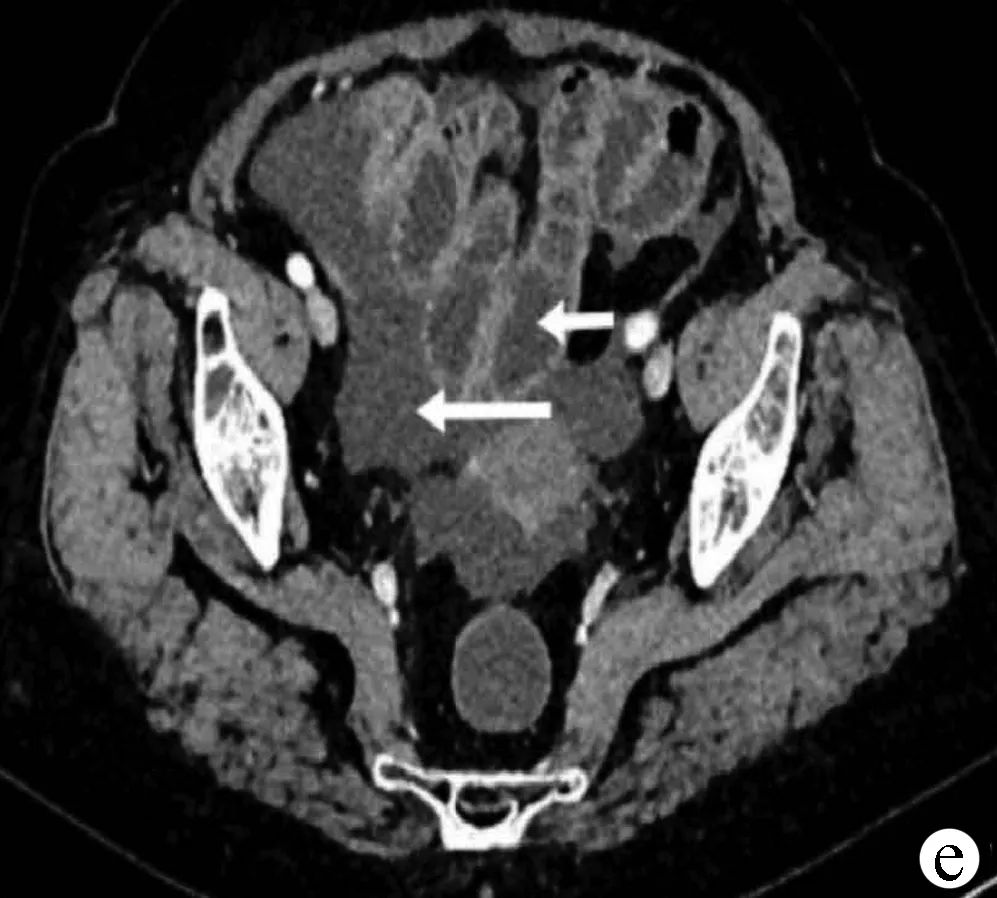
注:a,门静脉积气;b,小肠壁增厚;c,小肠肠壁增厚、强化程度明显减低,肠系膜上动脉末端分支较稀疏;d,肠壁积气;e,盆腔内部分小肠扩张积液,腹盆腔积液。
2 讨论
AHNE病因尚不清楚,多数学者认为AHNE的发病与感染产生B毒素的Welchii杆菌(C 型产气荚膜杆菌)有关[1]。患者多存在不洁饮食史,可出现腹痛、呕吐、血便、发热等症状,肠梗阻、腹膜炎体征,甚至休克等临床表现,起病急骤、病情凶险,易被误诊为急性阑尾炎、肠梗阻、腹膜炎、坏死性胰腺炎、菌痢等疾病[2]。AHNE的诊断主要依据以下几点: (1)无手术史的肠梗阻症状,早期稀水样便,后为血水样或果酱样便;(2)无里急后重的稀水便,伴全身中毒症状,其症状和体征不符,无法用血便、腹泻解释的休克;(3)虽有腹膜炎,但其发展较急腹症迟缓,腹穿或灌洗有红细胞及脓细胞;(4)影像学检查提示有腹水和(或)肠管壁增厚[1]。临床上常把AHNE分为以下4种类型:血便型、腹膜炎型、中毒性休克型、肠梗阻型,4种类型可同时存在,也可相互转化[3]。本例患者在进食草莓后出现剧烈腹痛,伴恶心、呕吐,排洗肉水样便,同时伴随发热、炎性指标升高等全身症状,查体有明显的腹膜炎体征。腹穿抽出血性腹水,腹水中存在大量脓细胞及红细胞。影像学提示小肠肠壁增厚、积气,肠腔积液,周围脂肪间隙模糊,腹腔积液。故可明确诊断为AHNE;该患者病程中先后出现血便型、腹膜炎型及肠梗阻型的特点,未出现低血压休克。因肠壁透壁炎症、水肿增厚压迫血管以及可能存在血管痉挛,病程中出现肠系膜上动脉末端分支较稀疏等肠缺血的表现,病情复杂。因此,在一般支持治疗和强效抗感染基础上,加用扩血管、抗凝药物,改善了肠管血供,对感染的控制和黏膜的修复起了非常有益的作用。
该患者严重的肠道感染还导致了HPVG的发生。HPVG是指由各种原因引起的门静脉及肝内门静脉分支中气体异常积聚的影像学征象。1955年Wolfe和Evans[4]首次对此病进行了描述。HPVG的发病机制尚不明确,目前认为主要与以下两种机制有关[5]:(1)肠腔内压力增加、肠黏膜屏障受损,使得肠腔内的气体进入门静脉;(2)肠腔及腹腔内产气细菌异常增殖,从而产生大量的气体进入门静脉系统。HPVG的临床表现无特异性,主要表现为腹痛、腹胀、恶心、呕吐、发热、便血等。HPVG不是一个独立的疾病,常合并肠缺血、肠坏死、肠梗阻等致死性疾病,或与腹腔脓肿、炎症性肠病、憩室炎等疾病相关[6]。早期研究[7]发现,HPVG病死率高达75%。随着影像学技术的发展,HPVG的检出率较前明显提高,临床医生对该病进行了早期干预,降低了其病死率。Koizumi等[8]通过对日本1590例HPVG患者的研究发现,HPVG患者的住院总病死率为27.3%。HPVG的诊断主要依据腹部X线、超声和CT等影像学检查。其中CT扫描不仅对HPVG的诊断具有更高的敏感性,还可以发现潜在疾病并进行鉴别诊断,因此CT被认为是诊断HPVG的首选影像学检查[6,9]。HPVG与胆道积气的CT表现极为相似,容易误诊,主要鉴别点如下[10]:(1)HPVG的特征性表现是肝包膜下2 cm内出现枯枝状低密度气体影,主要发生在左支,其气体分布特点与肝内门静脉向心方向的血液流动有关;(2)胆道积气多位于肝脏中心部位,呈分散不连续的气体影,通常距离肝脏包膜>2 cm,是由于胆管中所含的气体随胆汁离心方向流动形成,且患者多有胆道手术史。HPVG的治疗方式主要取决于患者的潜在疾病和临床症状及体征。若患者生命体征平稳、门静脉积气量较少时,可先行保守治疗。若保守治疗效果欠佳或存在明显的肠缺血、坏死等危重病症时,应立即行手术治疗。本例患者肠道严重感染引起肠壁通透性增加,肠腔内气体及产气菌进入门静脉,导致HPVG的发生。该患者尚未发生肠管坏死,经禁食水、抗感染、抗凝、改善微循环、营养支持等治疗,AHNE得到有效控制,肝门静脉气体很快消失。早期积极有效的治疗最终使患者避免了外科手术。所以治疗引起HPVG的原发疾病尤为重要。
综上所述,AHNE合并HPVG起病急,病情发展迅速,病死率高。因此,临床医生应加强对这两种疾病的认识,以免造成误诊、漏诊。临床医师还要加强对HPVG影像的识别,找到引起HPVG的原发疾病,早期做出诊断,并采取个性化的治疗方案,以降低患者的病死率。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:佟印妮、郑吉敏负责课题设计,资料分析,撰写论文;苏少慧、张建参与修改论文;郑吉敏负责拟定写作思路,指导撰写文章并最后定稿。
