水凝胶应用在关节损伤中的意义和进展
2021-06-23郭明宇徐林
郭明宇,徐林
水凝胶是具有网状交联结构的高分子亲水性材料,吸水后体积会显著膨胀。水凝胶具有较好的生物力学作用,通过改性[1]可以制备更多具有优良特性的生物材料,例如合成具有“8”字形结构[2]的滑动轮水凝胶,这类水凝胶的抗应力的特性适合用作关节隔离支撑材料。水凝胶的多孔结构可以贮存药物并缓慢释放,例如在关节腔内给药治疗关节软骨的局部病变。本文主要介绍水凝胶的发展、性能、应用以及在关节慢性运动损伤中的研究现状和应用前景。
1 水凝胶的研究进展
1.1 发展演变
从Wichterle和Lim首次研究甲基丙烯酸β-羟乙酯(2-Hydroxyethyl methacrylate,HEMA)优良的性能开始,到Nagarsekar等[3]通过生物合成法合成出类弹性蛋白聚合物(elastin-like polypeptides,ELPS)水凝胶时期,再到Cappello等[4]研究了类丝蛋白聚合(silk-elastin-like-protein,SELP)与组织的生物相容性。这些研究都发现了水凝胶具备优良的特性,近年来,有关水凝胶的制备工艺和理化性质的研究十分活跃,Bahcecioglu等[5]人发现使用含有聚乙酸丙酯水凝胶的细胞支架有利于促进体外半月板再生。
1.2 水凝胶分类
水凝胶按照材料来源[6]、交联方式[7]、对外界刺激的响应情况[8]等可以进行不同的分类(见表1)。
根据材料来源的不同可以分为天然水凝胶及合成水凝胶;根据水凝胶交联网络键合机理不同可分为物理水凝胶和化学水凝胶;根据对外界环境刺激的响应程度,可分为传统水凝胶和智能水凝胶,如偶氮苯分子[9]可以在光刺激下结构发生变化,丙烯酰胺基偶氮苯单体与丙烯酸共聚形成的水凝胶可以同时对环境中的pH值与光刺激产生响应,发生体积的变化。
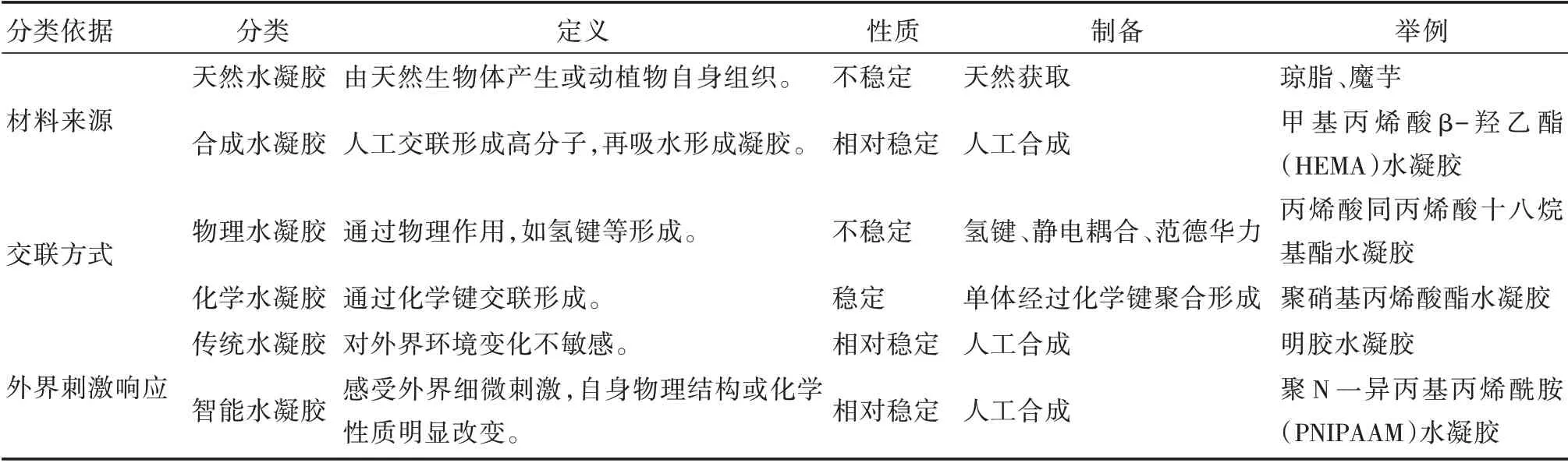
表1 水凝胶的分类
1.3 水凝胶的制备
水凝胶的制备关键在于交联高分子的形成。物理制备方法是通过外力或环境条件改变,如氢键配位键、静电耦合等方式形成的交联结构,物理水凝胶具有独特的性质,但自身稳定性较差,例如江明等[10]人发现通过控制温度可以合成分聚乙二醇-聚酯嵌段共聚物水凝胶;化学水凝胶的制备是通过产生化学键的方式形成三维网络聚合物,制备过程决定了其稳定性比物理水凝胶高,因此也被称为永久性水凝胶。例如Kou等[11]使用具有较好电化学稳定性和离子传导性的材料单体合成聚硝基丙基酸酯水凝胶。随着材料学的快速发展,新型水凝胶的制备不再是单纯的物理、化学制备,而是在微观层面上对材料分子进行交联、修饰,制备过程包括物理、化学甚至生物酶联等方法,制备出的水凝胶不仅结构稳定、生物相容性好,还能够与外界刺激产生响应。Ossipova等[12]以透明质酸为原料,通过巯基修饰与多种耦联方式合成的邻硝基苄基的连接体水凝胶可用作多种药物的前体,控制光照条件可以改变其药物释放效率。
2 水凝胶的性能
2.1 生物相容性
生物相容性通常指生物材料与植入环境之间的相互作用,分为生物安全性与生物功能性。要求植入类材料不能对机体产生严重的排斥反应,对机体自身功能有帮助。细胞间粘附分子(cell adhesion molecules,CAM)[13]是细胞表面控制和促进与其他细胞相互作用的分子,天然水凝胶对CAM影响较小,合成水凝胶生物相容性相对较差,但通过改变本身材料种类及交联方式可提高生物相容性。例如,利用静电纺丝技术制备壳聚糖-明胶仿生支架[14]可以显著提高生物相容性。
2.2 物理特性
2.2.1 结构强度 天然水凝胶交联链段分布不均,网络结构力学性能较差,一般水凝胶的断裂能在10-1-100 J/m2左右[15]。通过人工合成制造高强度水凝胶,如使用纳米蒙脱土等材料制造纳米水凝胶,Okumura等[16]将利用α-环糊精(CD)制造滑动轮水凝胶等。滑动轮水凝胶由数个环糊精分子[17]构成的可滑动“8”字形交联结构,受力时各链段相互滑动维持平衡起到滑轮效应[18]具有强大的抗应力效果,将其浸泡水中10 h以上形状不变而质量可溶胀45倍以上,最大可拉伸为原长度的24倍,因此适合用作关节隔离支撑材料。
2.2.2 温敏性 温敏性材料能够感知环境温度变化而改变自身性质。温度变化时,水凝胶链段上的亲水、疏水集团与水分子之间氢键作用会发生变化,两者相互竞争导致分子链在无规线团与卷球状之间转变,例如线性聚(N-异丙基丙烯酰胺)(PNIPAm)[19],在温度较低时,聚合物的亲水作用使溶质在水中均匀分布形成溶液,当温度升高至32℃时,疏水作用大于亲水作用,形成凝胶状。
3 水凝胶在关节软骨损伤中的应用
关节软骨指覆盖于关节连接处表面,由软骨细胞、胶原、基质等物质组成,起到缓冲及润滑作用的透明软骨[20]。关节软骨在关节运动中主要起到缓冲及分散压力的作用[21],与关节囊分泌的滑液对润滑关节,减轻磨损起到重要的作用。
3.1 水凝胶细胞支架在组织工程中的应用
关节软骨相对孤立,缺乏血运,受损后难以自愈,组织工程的发展为关节软骨修复提供了较好的契机。通过组织工程修复关节软骨的关键在于选取合适的种子细胞、细胞因子及细胞支架,细胞支架材料需要为种子细胞提供接近关节软骨细胞外基质(extracellular matrix,ECM)[22]的生长环境,这类材料要有较高孔隙率的物理形态[23]能够为种子细胞提供分化增殖微环境。水凝胶类材料不仅具备上述条件,而且整合能力[24]良好。水凝胶植入物的生物相容性越好,与宿主组织结合完整性就越好,新生软骨与宿主软骨相似程度就越高。水凝胶高分子生物支架除了具备营养,便于细胞-支架黏附[25],生物相容性等基本属性外,特殊的加工方式能使水凝胶具备足够的强度,在一定应力下依然能维持自身结构的完整性,在关节这类受力较大的部位应用前景较好。
组织工程支架通常分为预塑形多孔支架材料与可注射性材料。前者强度较大,但设计与手术相对困难;后者易于操作,手术损伤小但本身强度较低,无法用作受力较大部位的修复。水凝胶的生物降解是指水凝胶在生物体内伴随组织细胞的生长通过水解,酶解等途径不断排出,直到自身组织修复完成的过程。水凝胶降解受到交联程度,交联方式及包埋细胞的种类等因素的影响,降解速度需要与细胞合成分泌细胞外基质的速度相适应。
水凝胶细胞支架修复关节软骨损伤的思路是针对软骨缺损的面积大小,选取合适的种子细胞,在体外扩增后与支架结合,移植到软骨缺损的部位。解光越等[26]选择人脐带Wharton胶来源间充质干细胞(MSCs)作为种子细胞,复合藻酸钠水凝胶(Alg)作为细胞支架尝试修复兔关节软骨,实验证明Alg+MSCs组明显优于其他对照组。Stark等[27]尝试将软骨细胞种植在胶原基水凝胶上面,发现能够提高软骨细胞的活性。Silverman等[28]通过实验还发现纤维蛋白凝胶可以促进软骨生长。
3.2 水凝胶药物载体在关节软骨病变中的应用
传统的给药途径受药物半衰期的影响波动性较大。一般的药物的释放体系是载体与药物制成一定剂型,在药物起效的浓度下缓慢地释放,从而维持有效的药物浓度。目前在药物缓释方面研究较多的是DDS系统(经植入性药物传送系统)[29],该系统是由储存药物、控制释放速度、驱动释放3部分组成,适用于需要维持一定的药物浓度的给药系统,如肝癌患者的化疗药物治疗等。
水凝胶具备多层次、多尺度的微细结构以及良好的亲水性,吸收大量水分子后体积膨胀数倍,水分子包裹在网络结构中使得水凝胶具有了一种流体的性质,适合于作为大分子药物的控释材料[3]。水凝胶药物载体在缓释的同时还可以保护蛋白分子不受外界有害因素的干扰,应用于上述DDS系统对药物缓释有较大意义。
类风湿性关节炎(RA)[30]是一种好发于手足小关节滑膜的自身免疫疾病,以软骨与骨破坏为主。以两亲性聚合物温敏性水凝胶结合甲氨蝶呤[31],在关节腔内注射可以起到短期内库存药物并缓释,有助于减少频繁给药带给患者的痛苦并降低感染风险。
骨关节炎(osteoarthritis,OA)是一种好发于全身承重关节的退行性病变[32],以关节软骨破坏为主要表现。骨关节内(intra-articular,IA)给药[33]通过选取具有良好安全性、生物相容性、可控释放性等优良特性的水凝胶载体[34],将含有药物的载体通过关节内注射的方式注入靶关节,达到高效的局部给药[35]的效果。医师还可以改变关节局部温度或磁场等外界因素来调整水凝胶载体与药物分子间的亲和程度,从而控制药物的释放速度的作用来减轻药物反应。
Matsuzaki等[36]研究发现,雷帕霉素-胶束(rapamycin-micelles-hydrogels)单位时间内药物释放率要低于对照组,说明这类水凝胶药物载体具有缓释性;KANG等[37]通过形成共价键的方式合成HA/PEG/KGN水凝胶,实验证明这类水凝胶药物载体具有保护关节软骨延缓病情进展的作用。
4 水凝胶在关节置换手术中的应用
关节置换可以提高术后生活质量,但手术不可避免会对关节产生损伤,引起术后出血、疼痛,假体无菌性松动、负重界面磨损严重等一系列问题,为解决上述问题需要在术后应用镇痛、止血药物以及关节隔离支撑类材料来延长人工假体的使用时间。
4.1 关节置换术后止血
关节手术损伤较大,术中、术后容易出现失血较多的问题,时利军等[38]发现在局部关节腔内注射氨甲环酸[39]、肾上腺素、止血凝胶等药物混合制成的“鸡尾酒”制剂可以有效降低出血。Aggarwal等[40]发现富含血小板血浆(platelet-rich plasm)与凝血酶及钙离子结合形成的PRP凝胶能够在减少术后出血的同时加快损伤组织的恢复。
4.2 关节置换术后镇痛
选择性COX-2抑制剂类药物通过阻止致炎前列腺素的生成达到术后镇痛的作用,在低疼痛刺激下,患者能够积极地完成关节功能锻炼促进膝关节功能恢复。通过将选择性COX-2抑制剂类药物分子与水凝胶药物载体相结合,再将其注入关节腔中去起到长效抑制疼痛的效果,因为水凝胶载体可以缓慢地释放药物,可以起到长时间术后镇痛的效果。
4.3 降低关节置换假体摩擦
关节置换后的人工关节假体缺乏关节软骨,缺乏正常膝关节结构具有的缓冲和润滑能力。Kamata等[41]科学家报道了使用聚乙二醇(PEG)改性制成水凝胶,其多孔、稳定的三维网状结构特性适合储存并缓慢地释放关节液,使关节假体具有低摩擦,磨损低的良好性能。Gong等[42]研究发现,在负载存在的情况下,水凝胶网格体系中的水会分散到表面,增加润滑层的厚度减少摩擦,因此水凝胶用作填充剂可以有效减少摩擦,降低损耗。
5 问题及不足
目前大多数水凝胶材料仍处于研究阶段,大多技术不成熟。我国对水凝胶在关节慢性运动损伤与生物工程方面的研究较少。水凝胶在生物工程领域研究涉及生物工程、分子化学、材料学等多个学科,研究层面需要深入到组织细胞、分子层面,为实现水凝胶的临床应用需要多学科的理论支持,如何将多学科的理论方法应用于特定的水凝胶材料并解决相关问题是目前亟需解决的问题。
天然水凝胶与合成水凝胶在生物相容性与机械强度方面各具优劣,应用于关节软骨损伤修复的水凝胶应当同时具备较高的机械强度与良好的生物相容性,如何制备兼具上述优点并且性质稳定的水凝胶是目前亟需解决的问题。
6 总结与展望
本文回顾研究了各种水凝胶的发展、分类及自身特性,详细阐述了不同关节慢性运动损伤情况下水凝胶的应用情况。未来的工作重心在于,进一步提高应用于关节损伤修复水凝胶系统的稳定性,水凝胶材料需要具备一定的机械强度,才能够抵抗关节运动带来的剪切力作用。应用于支架材料的水凝胶除了具有营养,生物相容性,利于细胞黏附等特性外,还要具备一定的智能性,便于注射及微创操作。现有的水凝胶材料无法具备上述的全部优势,随着各种新材料的不断研发,会有更多优良性质的水凝胶材料应用在关节慢性运动损伤的治疗中。
