基于增强CT的影像组学模型对BCLCB期肝细胞癌治疗方式选择的研究进展
2021-06-23胡志鹏孙强胡泽民陈伟强
胡志鹏,孙强,胡泽民,陈伟强*
肝脏恶性肿瘤是恶性程度最高的肿瘤之一,是目前全球第六大常见恶性肿瘤和第四大癌症相关死亡原因。其中肝细胞癌(HCC)约占所有肝脏恶性肿瘤的90%[1,2]。巴塞罗那临床肝癌分期(Barcelona clinic liver cancer,BCLC)是应用最广的HCC临床分期系统,BCLCB期(中期)肝癌是肝癌患者中最大的亚群,对于BCLCB肝癌,BCLC分期推荐行经动脉化疗栓塞术(TACE)作为一线治疗方法。但近年来,多项临床研究[5-12]发现部分BCLCB期肝癌患者行肝切除术(LR)后显示出优于TACE的疗效,故显然对所有BCLCB期肝癌患者行TACE并不合适。但是,目前还没有强有力的证据表明,BCLCB期肝癌患者中哪一部分的患者是肝切除术的最佳手术对象。
影像组学作为近年来新兴的一个对医疗图像进行深度特征挖掘的研究方法,其特征反映了肿瘤的异质性,运用在多种恶性肿瘤的临床决策及预后预测中起到了相当重要的作用,在癌症研究与治疗中变得越来越重要。本文主要叙述通过基于增强CT的影像组学方法所建立的模型可能为BCLCB期肝癌患者提供个体化的治疗方案。
1 BCLC B期肝癌的管理
1.1 肝癌分期与治疗
肝癌患者的管理是由巴塞罗那临床肝癌(BCLC)分期指导的,BCLC是肝癌预后分类和治疗选择最广泛使用的系统,并得到了欧洲肝脏研究协会(EASL)和美国肝病研究协会(AASLD)指南的推荐[3-5]。巴塞罗那临床肝癌(BCLC)分期将肝癌分为4个阶段:即A期(早期)、B期(中期)、C期(晚期)及D期(末期),是世界上用于评估肝癌患者预后并为每个阶段选择最合适的治疗方案提供支持的最常用的分期系统[3,4]。
早期(BCLCA期)包括单发病灶或3个结节均≤3 cm(无血管侵犯或肝外扩散)且肝功能未受影响的患者,患者可以从潜在的治疗(切除、移植或消融)中受益。中期(BCLC B期)肝癌患者,则定义为≥3个肿瘤(不论大小),或2~3个肿瘤(最大直径>3 cm),没有肿瘤相关症状、大血管侵犯或肝外扩散的情况。BCLCB期肝癌包含了肝功能Child-Pugh A-B和大/多灶性肝癌患者组成的异质性群体。TACE被推荐作为BCLCB期肝癌患者首选治疗方案。随着肝切除术技术的成熟及推广,肝癌的部位和数量逐渐不再是LR的主要影响因素,有研究[5,6]表示BCLCB期肝癌是LR的禁忌症,但也有多项研究表示LR是完全可以作为部分患者治愈肝癌的治疗方式[10-12]。
此外对于晚期肝癌(BCLCC期):肿瘤已经扩散到肝脏之外或血管侵犯,和/或具有轻微的癌症相关症状,ECOG分级1~2),及终末期肝癌(BCLCD期):有肝功能低下或明显的癌症相关症状,ECOG分级>2)的患者,系统治疗及支持性护理目前被认为是一线治疗的标准治疗[3,4]。
1.2 BCLCB期肝癌的预后及治疗
BCLC B期肝癌涵盖了广泛且高度可变的肿瘤负担,是肝癌患者中最大的亚群,患者可出现最少三个肿瘤(其中一个>3 cm)或多至任何数量的肿瘤。同样,这种疾病可能局限于一到两个肝段,或者是多叶的和广泛的。在预后方面,BCLC B期肝癌患者的历史队列研究显示,未经治疗的中位生存期一年存活率为50%,中位存活率为10个月[7,8]。由于目前肝癌管理和治疗的进展,存活率有相当的改善,但是Giannini的研究表明,在最差和最好的中期患者亚组之间,未经治疗的中位生存期从5个月到25个月不等[9]。BCLCB期肝癌的上述异质性使临床试验研究、个体化治疗和预测变得困难。
一般情况下,BCLCB期肝癌推荐的治疗方式是姑息性的TACE,然而,并不是所有的中期肝癌患者都适合接受TACE治疗,尤其是肿块较宽、多发结节或肝功能受损的患者。LR治疗BCLCB期肝癌是有争议的,一项纳入11项研究,3366例患者的荟萃分析[10]及多项研究表明[11,12],肝切除术在部分的BCLCB期病例中可能是有效的,接受TACE或联合治疗的患者可以考虑进行根治性治疗,如LR,甚至肝移植(liver transplantation,LT)。目前大多数研究都考虑采用部分BCLC B期的肝癌患者行外科手术干预,例如,在一份纳入了85例多结节BCLC B期肝癌患者的研究中,Wada等人报告的5年总生存率(OS)为63.4%,并得出结论,指定为BCLCB期不应成为手术的绝对禁忌症[11]。更特别是,Yin等人进行的随机对照试验(RCT)表明,部分BCLCB期肝癌患者中,LR优于TACE[12]。总体而言,TACE在两个随机对照试验中被证明具有显著的治疗益处[13,14]。但由于在这一阶段使用的大多数治疗方法缺乏强有力的科学证据,且指南建议之间存在重大差异,根据不同中心的临床医生观点、习惯治疗方式、手术能力的不同,其决策可能有所不同。
2 影像组学
影像组学是一个新兴的发展迅速的研究领域,是2012年由荷兰学者Lambin提出的通过计算机深度挖掘临床中常见的医学影像(如CT、MR、B超PET-CT等)中提取出高通量、理想的、可重现的特征,包括人眼难以识别或量化的复杂信息,再通过特征工程将海量的数据特征筛选出有价值的部分用于指导临床决策。
影像组学的临床研究主要集中在肿瘤学上的应用。基因组分析表明,肿瘤异质性是生存的预后决定因素,是癌症控制的障碍[15-18]。由于肿瘤的空间异质性及时间异质性,尽管作为肿瘤诊断“金标准”的活组织病理学检查能捕获小部分肿瘤组织的异质性,但通常只捕获单个解剖部位,并不能反映肿瘤的整体异质性。相反,影像组学通过提取计算机断层扫描(CT)、正电子发射断层扫描(PET-CT)或磁共振成像(MRI)等各种医疗图像中各层面的影像组学特征可以捕获整个3D范围的肿瘤,获得肿瘤各个点及整体的异质性。影像组学特征数据是可挖掘的,在足够大的数据集中,它们甚至可以用来发现以前未知的疾病进化、进展和治疗反应的标记和模式。研究者们意在收集具有诊断、预后和/或有预测价值的特征,我们称之为定量成像生物标记物。
如图1所示[19],影像组学的研究流程包括:图像获取、感兴趣区域的分割、图像预处理、感兴趣区域特征的提取及量化、特征降维、特征分析预测与建模等。目前,已有多种商业软件包可以进行影像组学特征的提取,这为特征提取的标准化情况提供了便利。这些软件包包括local image feature extraction(LIFEX)、imaging biomarker explorer(IBEX)、MaZda、TEXRADTM(Feedback plc,Cambridge,Chang Gung Image Texture analysis,UK)和RADIOMICSTM(OncoRadiomics,Maastricht,The Netherlands)[20],这些硬件和软件的进步使肿瘤的组织病理生理学定量成像得以实现。
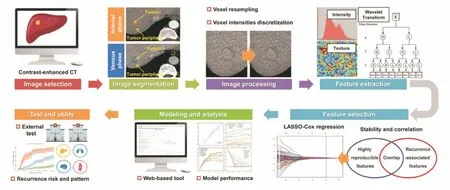
图1 影像组学研究流程图[19]
在影像组学的概念中,组织的基因表型、蛋白质模式改变以及分子改变可在宏观影像学特征上有所表现,其相互之间存在着密切关系。影像组学特征,作为其中明确疾病的存在或肿瘤类型的依据,亦可用于肿瘤的分层、预测治疗反应或复发时间。由于影像组学特征可能提供关于整个肿瘤异质性信息,因此可能用于建立相关模型作为肿瘤分级分层的依据。近期已建立了多项影像组学模型,如:如同组织病理学诊断肺癌的肿瘤模型[21];预测肿瘤部分的遗传表型[22];预测肿瘤对治疗的反应[23];对肿瘤复发[24]、淋巴结转移[25]或远处转移[26]以及生存期的预测[27]等。基于这些模型对于多种肿瘤有效的预测,影像组学正显示出巨大的潜力,作为一个新兴的研究领域,随着更深入的发展,影像组学对成像数据进行更复杂的分析必然远远超出对可见组织变化的定性评估。通过深度挖掘利用其特征,未来可能会给肿瘤患者“个体化”治疗和肿瘤特异性的诊断检查提供更多依据。
3 基于增强CT的影像组学在肝癌中的应用
肝脏增强CT在肝癌患者的筛查、早期发现和治疗中起着至关重要的作用,几乎所有怀疑或确诊患者均会常规完善肝脏增强CT检查用以明确诊断,并将其作为治疗方式选择的依据及疗效观察的首选检查方式[28]。由于肝癌患者增强CT的无创性、可重复性及易获得性,随着影像组学的引入,基于增强CT的影像组学在肝癌分析治疗的研究中提供了一个非常有价值的手段。目前影像组学在肝癌的研究主要集中在肝癌的鉴别与分级、危险因素的预测、及预后评估等。
多项研究[29-31]均证实基于增强CT的影像组学方法能明显提高肝癌的诊断准确率。在Mokrane等人[29]的研究中共纳入了27个中心178例不确定肝结节的肝硬化患者进行了回顾性分析,所有患者在增强CT中均无法区分肝脏结节的肿瘤性病变和非肿瘤性病变,通过活检证实77%的患者为恶性肝结节,研究者通过影像组学技术将结节分类为HCC或非HCC,得到的曲线下面积(AUC)为0.70,并列举实例如图2[29],表明影像组学诊断肝结节不确定的肝硬化患者具有相当的优越性。同样,Raman[30]等人则通过基于增强CT的影像组学方法对经病理证实的17例局灶性结节增生、19例肝腺瘤、25例HCC和19例正常肝实质进行影像组学分析,建立的模型成功预测了区分了3种病变类型和正常肝脏,准确度分别为:腺瘤91.2%,局灶性结节增生94.4%,肝细胞癌98.6%,总体准确度为84.9%,而两名影像科医生读阅同一份图像,总体准确度则为72.2%和65.6%,在这项研究中,样本量偏小,并且未建立验证集验证其结论,但也证明了基于CT的影像组学具有较高的预测分类性能。Nie等[31]将156例经手术病理确诊为非肝硬化肝局灶性结节增生(FNH)和肝细胞癌(HCC)的增强CT图像通过影像组学的方法提取并分析特征并通过多因素Logistic回归分析构建影像组学结合临床因素诺模图,在训练集和验证集的AUC值分别为0.979和0.917,对鉴别非肝硬化肝局灶性结节增生和肝细胞癌具有良好的预测价值。
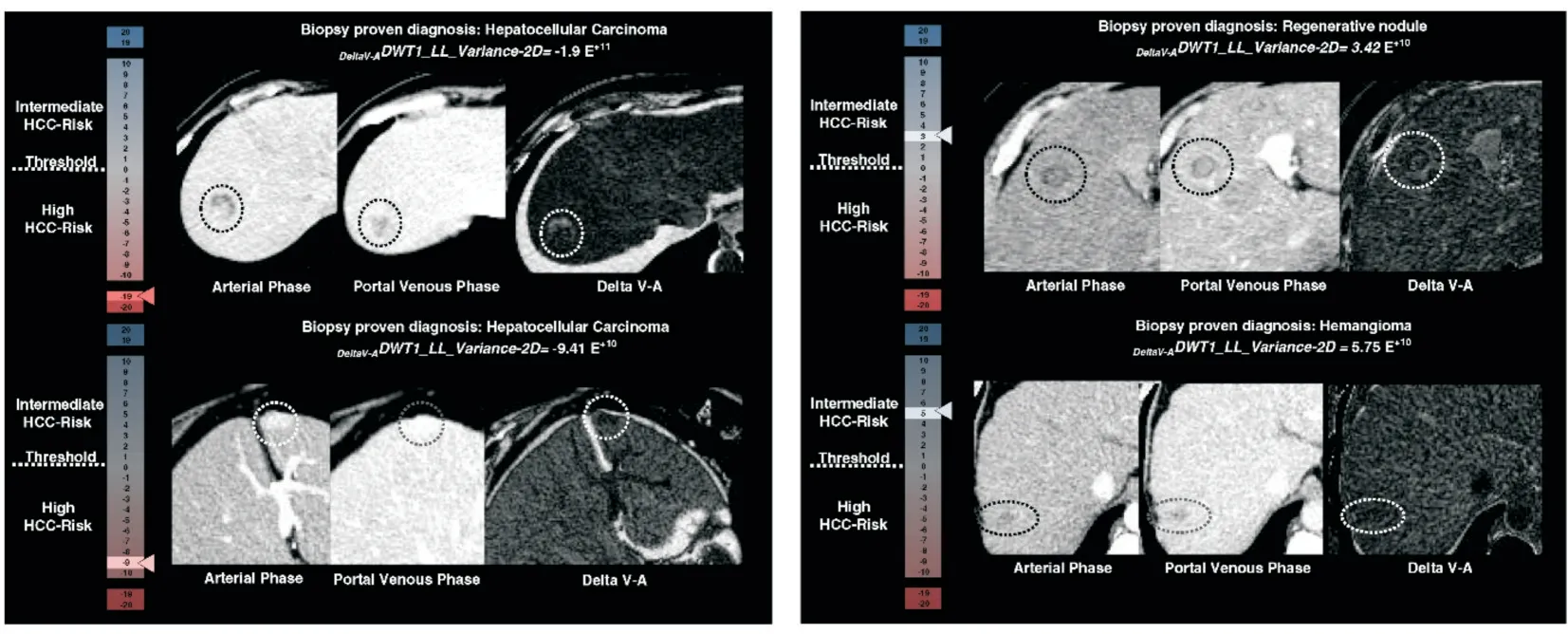
图2 基于增强CT的影像组学方法预测不确定肝结节良恶性的实例[29]
在预测肝癌复发的危险因素及预后评估中,基于增强CT等影像组学方法更是表现优异。微血管浸润(microvascular Infiltration,MVI)是已经被证实的肝癌患者术后早期复发和存活率的主要独立预测因子,在术前如能够准确识别对预测术后复发及预后非常有帮助,但目前术前尚不能充分确定。多项研究[31-34]已经开发出基于CT的影像组学模型来预测术前MVI,其特异度在0.76和0.91之间,包含临床变量的模型获得了更高的性能。Xu等人[31]的基于肝脏增强CT建立的影像组学模型可以识别出88%的MVI阳性病例,实例如图3示[31],在一定程度上预测了复发的可能性。通过影像组学分析三期增强CT的方式识别微观特征,从而能够检测到肿瘤的微观浸润,这对指导患者治疗方式及手术切除范围具有指导性的价值。
亦有研究表明[35-38],基于CT的影像组学方法在有效预测肝癌预后方面有潜在的优势,Zhou等[36]通过215例HCC患者的肝脏增强CT图像进行影像组学分析,共筛选出的21个影像组学特征可用于预测患者术后早期复发,其准确性、特异性、敏感性均高于传统临床因素,如果将影像组学特征与临床因素联合能更准确地预测HCC术后的早期复发,可以用于HCC患者的术前评估和术后监测。在Akai[35]等人的研究中总共提取了25项特征分析评估患者无病生存期和总生存期的个体风险,并通过这些特征构建的模型有效预测了可切除肝癌患者的预后。由于这些均是术前即可获得的数据,影像组学特征和临床参数、放射学特征相结合是目前更为常用方法,用于术前评估肝癌患者的早期复发更为全面、准确。
这些研究都表明基于增强CT的影像组学特征对指导肝癌的诊断、预后预测评估是极有潜力的,但在对治疗方式的选择及在BCLCB期肝癌分层中却鲜有研究涉及。
4 基于增强CT的影像组学模型对中期肝癌的分层的展望
最近,关于影像组学对TACE后局部反应的预测能力也已经被证实是可行的,Reimer和Kim等[39,40]的研究表明TACE后肝转移瘤的治疗反应可以用基于增强CT的影像组学方法分析来确定。这个结果对肝癌的研究是相当有意义的,主要是由于目前对BCLCB期肝癌的治疗方式以TACE为主,临床医生更多的是根据经验、习惯和患者的选择拟定的治疗方式,对于部分不同的肝癌患者实际上并不能提供个体化治疗方案,术前能预测TACE后的肿瘤反应无疑为我们的治疗提供更好的依据。
如上所述,对于BCLC B期肝癌患者而言,手术及TACE都是可选的治疗方式,但需要强调的是,至今暂无很好的分层方法为BCLCB期肝癌患者提供个性化治疗方案,随着对肝癌认知的发展,肝癌的治疗趋势正在发生变化,亟待完成的就是建立更完善有效的模型对BCLC B期肝癌依据治疗推荐的不同进行更为细致的分层。
肝癌的不同生物学特性,包括肝癌的异质性及分子特征对预后起着决定性的作用。目前我们获得其生物学特性的来源方式就是活组织检查,但是基于当前的影像图像采集方案已经达到如此复杂优异的程度,当肝细胞癌的诊断标准全部满足时,组织活检是不必要的。于是基于增强CT的影像组学作为一种非侵入性的并可能提供关于整个肿瘤异质性信息的方式,可能提供生物学层面更为有效的分层。
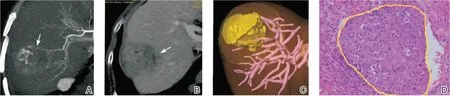
图3 1例68岁男性,CT表现为肝右叶4.3 cm实性肿块,通过影像组学模型计算的MVI危险度为78.2%(病理学确认为MVI)[31]。
5 总结与展望
影像组学是一个非常年轻的领域,尽管目前已取得大量的研究成果,并且开发的多种预测模型所得出的结果经验证与临床实际相符,但这项技术尚未成熟,仍有许多挑战需要解决。影像组学特征可能是肝癌的独立的预后因素,因为它们可以与肝癌的生物学特性相关。由于影像组学能对肝癌病灶进行整体的评估,有效评估肝癌的异质性,因此,结合影像组学特征、临床参数及影像学特征所建立的模型有可能为BCLCB期肝癌患者提供一个合理的风险分层,进而制定出有效的临床决策,具有较大的潜力。
