骨髓间充质干细胞来源的外泌体通过促进轴突再生促进坐骨神经损伤修复
2021-06-23曾迪藩钟梅李卫王其友
曾迪藩,钟梅,李卫,王其友
周围神经损伤是一种威胁人类健康的常见神经系统疾病[1],它对轴突和神经元具有直接和破坏性作用,并继发神经炎症,氧化应激,细胞凋亡和反应性神经胶质增生。有效治疗周围神经损伤的关键是损伤神经的轴突功能的修复,损伤远端的效应器官的恢复支配。而目前诸如精细手术、神经移植、全身抗炎治疗的治疗结局并不能令人满意。
干细胞移植是外周神经损伤治疗的有效策略之一,先前的研究表明BMSCs可以通过调节微环境来促进结构和运动功能的恢复,并促进神经发生和轴突延长[2]。然而,由于其低存活率和免疫原性,直接移植到受损组织的BMSCs治疗效果有限。最近的研究发现干细胞的治疗效果主要与其旁分泌活性密切相关[3],这为外周神经损伤之后的干细胞治疗开辟了新的思路。
外泌体直径在40~150 nm,源自多囊泡内涵体,来源于几乎所有细胞类型。作为BMSCs旁分泌的载体,BMSC-EXOs携带可溶性因子、脂质、蛋白质和核酸,促进细胞间通讯并调节多种生理功能[4]。因此,我们假设BMSC-EXOs可以促进轴突再生治疗坐骨神经损伤,据此设计实验以探索BMSC-EXOs对神经细胞的调控作用,并通过检测轴突再生检验对坐骨神经损伤的修复作用。
1 材料与方法
1.1 细胞培养
1.1.1 大鼠BMSCs的分离与培养 所有涉及动物的实验程序均已获得中山大学动物保护和使用委员会的批准,实验动物(SD大鼠)饲养在(22±3)°C和光照/黑暗12小时轮替,充足的水和食物喂养。在无菌条件下分离Sprague-Dawley(SD)大鼠的股骨和胫骨,在无菌PBS缓冲液中洗涤并转移到在含有10%FBS的DMEM液培养皿中。去除骨两侧的骨骺,并用培养基反复冲洗髓腔,直到冲洗出髓腔中的所有骨髓。在1000×g离心10 min后,将细胞沉淀物重新悬浮在MSCs培养基上:DMEM,5μL/mL青霉素,5μL/mL链霉素(P/S;Gibco)和10%FBS(Biochrom)。将细胞置于37℃,100%空气湿度和5%CO2下孵育。当细胞增殖达到培养瓶底部面积的80%时,将大鼠的BMSCs以1∶3传代培养。
1.1.2 肾上腺嗜铬细胞瘤(PC12)细胞的培养及分组 从中国科学院细胞库购买的PC12细胞在含有10%胎牛血清(FBS)的1640培养基中培养,然后在37℃的培养箱中在5%CO2下培养。将PC12细胞分为对照组、30μg外泌体治疗组、60μg外泌体治疗组,分别加入0μg外泌体、30μg外泌体、60μg外泌体,72 h后进行检测。
1.2 外泌体的提取与鉴定
①通过超速离心法提取外泌体[5]。即将BMSCs的培养基在4℃下以300×g离心15 min以沉淀细胞碎片。取上清液在4°C下以2000×g离心20 min后,上清液转移到新的离心管中,再以10 000×g离心30 min,最后以100 000×g离心90 min上清液。最后将沉淀物重悬于150μL无菌PBS中,并保存在-20℃的冰箱中。②透视电镜检测:按使用说明,在100 kV透射电子显微镜下观察提取物的形态。③外泌体粒径检测:我们使用了纳米颗粒跟踪分析(NTA)系统(LM10 NanoSight,美国)和纳米颗粒跟踪分析软件来跟踪纳米颗粒的运动速率。根据Stockes-Einstein方程分析粒度和浓度。④蛋白免疫印迹法检测:用RIPA缓冲液裂解外泌体,并提取蛋白质。测量每组的浓度。使用抗CD63、抗TSG101一抗孵育于4℃过夜。然后与辣根过氧化物酶缀合的第二抗体温浴2 h反应。最后,使用发光成像系统(上海天能科技有限公司)进行检测。
1.3 PC12细胞吞噬外泌体实验
①外泌体标记:我们使用PKH67绿色荧光通过标记细胞膜来标记外泌体。标记共同培养12 h后,将PC12细胞用2%甲醛固定15 min,PBS洗涤,然后用Hoechst细胞核染色。共聚焦显微镜用于观察,并记录结果。②免疫荧光检测:用提取的外泌体处理PC12细胞,将PC12细胞用2%甲醛固定15 min,PBS洗涤,5%山羊血清和0.2%Triton X-100制成的破膜液破膜1 h,并用抗GAP43抗体和抗NF-200抗体孵育于4℃过夜,次日孵育荧光二抗1 h。最后,用Hoechst(德国,Hoechst AG)将细胞核染色,并在共聚焦显微镜下观察并测量轴突长度。③蛋白免疫印迹法检测:用RIPA缓冲液裂解PC12细胞,并提取蛋白质。使用抗NF-200、抗GAP43一抗孵育于4℃过夜。然后与辣根过氧化物酶缀合的第二抗体温浴2 h反应。最后,使用发光成像系统进行检测。
1.4 动物模型及分组
使用SD大鼠(200~300 g,n=18,由广东省医学实验动物中心提供)。①皮下注射戊巴比妥钠(50 mg/kg)和丁丙诺啡镇痛药(ESSEX Chemie AG,瑞士,0.01~0.05 mg/kg)。②将2%异氟烷用于麻醉大鼠。③在手术后3和5天皮下注射抗生素(瑞士拜耳医疗保健公司,Baytril 2.5%,5~10 mg/kg)。将动物随机分为损伤组和治疗组(n=6)。损伤组及损伤疗组均经大鼠股后正中切口暴露坐骨神经后,用大止血钳钳夹坐骨神经,上满三齿,约10 min,神经形变,肉眼可见部分碎裂;止血后,治疗组缝合皮肤前通过一次微注射器注射将60μg外泌体注射到大鼠坐骨神经的损伤部位。
1.5 坐骨神经组织学分析
在第4周,对处死的大鼠进行0.9%氯化钠和4%多聚甲醛的心内灌注。然后取出坐骨神经,并用4%多聚甲醛后固定过夜。使用PBS溶液洗涤后将样品冷冻保存。组织学染色过程为:将包括损伤部位在内的脊髓组织包埋在石蜡中,对组织进行苏木精和曙红(HE),Masson三色染色和免疫组织化学染色,然后在显微镜下观察。
1.6 坐骨神经免疫荧光检测
使用冷冻切片机将坐骨神经切片切成10μm厚的切片,得到冷冻切片,4%多聚甲醛固定,通过免疫荧光的程序和抗体进行处理。最后使用共聚焦显微镜进行观察。
1.7 统计学处理
所有数据均表示为平均值±标准差(SD),并通过SPSS21.0软件进行统计分析。通过使用Bonferroni检验和单因素方差分析。每个实验重复三遍,并将结果绘制在图中。当P<0.05时,考虑到显著差异。
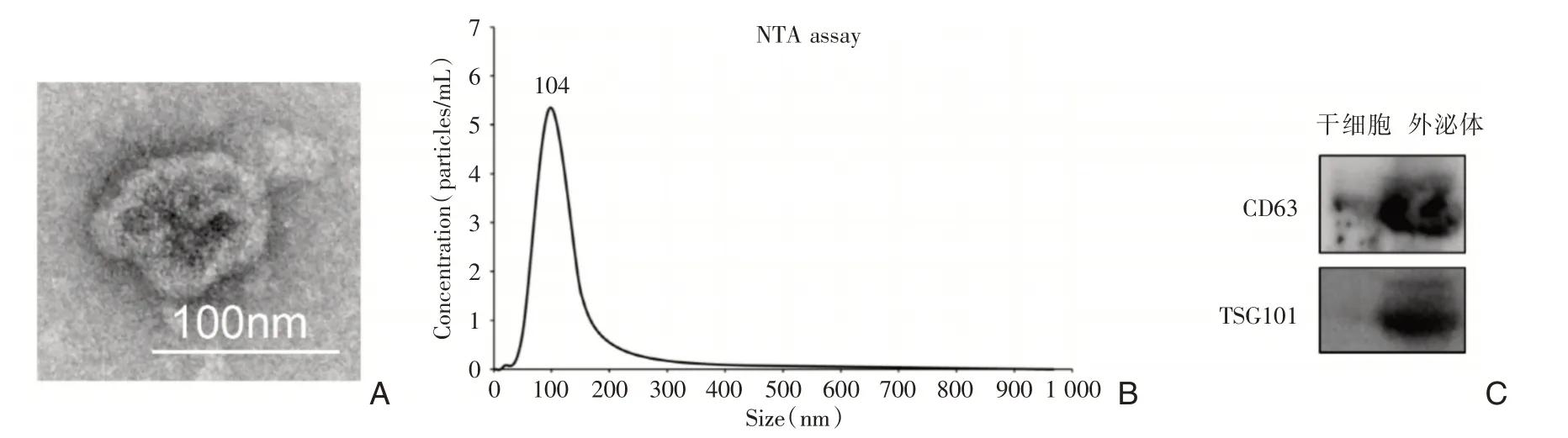
图1 骨髓间充质干细胞外泌体的鉴定 A:外泌体的电镜图;B:外泌体的粒径分析图;C:外泌体的蛋白免疫印迹检测
2 结果
2.1 外泌体的提取与鉴定
通过超速离心法获得的提取物进行电镜观察,该物质呈中央凹陷的茶托囊泡状,符合外泌体的形状;显微镜粒径分析表明,提取物的直径大多数粒径在40 nm至150 nm之间,与外泌体的直径一致;通过蛋白质印迹检测,提取物能够表达CD63、TSG101,这表明提取物与外泌体特征一致。由此证明提取物为BMSC-EXOs。
2.2 体外PC12细胞吞噬外泌体实验
将来自BMSC-EXOs添加到PC12细胞培养基中以观察其吞噬作用。如图所示,PC12细胞核被PKH67标记的外泌体所包围,表明外泌体已成功摄取到细胞质中。
2.3 外泌体促进PC12细胞轴突生长实验
分别使用0剂量(对照组)、30μg BMSC-EXOs和60μg BMSC-EXOs处理PC12细胞。如图3所示,PC12细胞的轴突长度显著增加,该结果直接证实了BMSC-EXOs在促进PC12细胞轴突生长中的独特作用。
2.4 外泌体促进PC12细胞轴突相关蛋白表达实验
与空白组相比,外泌体组轴突相关蛋白NF-200蛋白、GAPA43蛋白明显升高,表明BMSCEXOs可以促进神经细胞的轴突生长。蛋白免疫印迹法定量检测表明,NF-200蛋白和GAP43蛋白含量随着BMSC-EXOs含量的增加而增加(**P<0.01;***P<0.001),这表明BMSC-EXOs通过增加NF-200、GAPA43蛋白水平营养神经细胞和促进轴突再生。
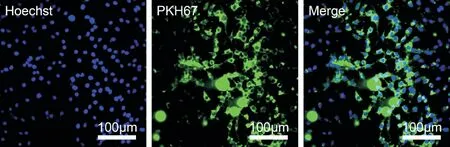
图2 体外PC12细胞吞噬外泌体实验
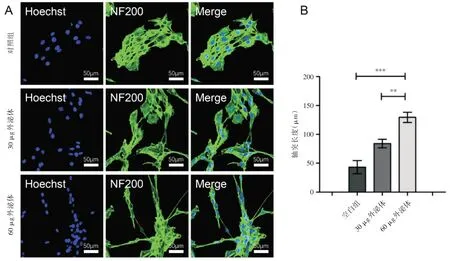
图3 外泌体促进PC12细胞轴突生长实验 **P<0.01;***P<0.001
2.5 外泌体治疗坐骨神经损伤实验
通过HE和Masson染色在挤压伤中观察到细胞的减少和病变范围的形成。治疗组的病变范围很小,而损伤组则保留明显的病变范围(图5)。
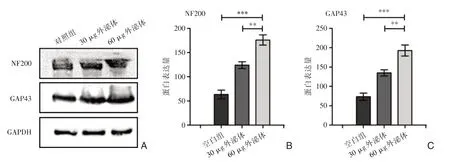
图4 外泌体促进PC12细胞轴突相关蛋白表达实验 A:蛋白免疫印迹法检测轴突相关蛋白表达;B、C:轴突相关蛋白定量分析。**P<0.01;***P<0.001
2.6 外泌体治疗坐骨神经损伤的免疫组化实验
通过免疫荧光检测轴突相关蛋白的表达。BMSC-EXOs治疗组的NF-200蛋白含量明显高于损伤组。同时可见治疗组的坐骨神经出现新的连接及病变范围的缩小。这一发现表明,外泌体在促进坐骨神经损伤中的轴突生长方面发挥了作用。
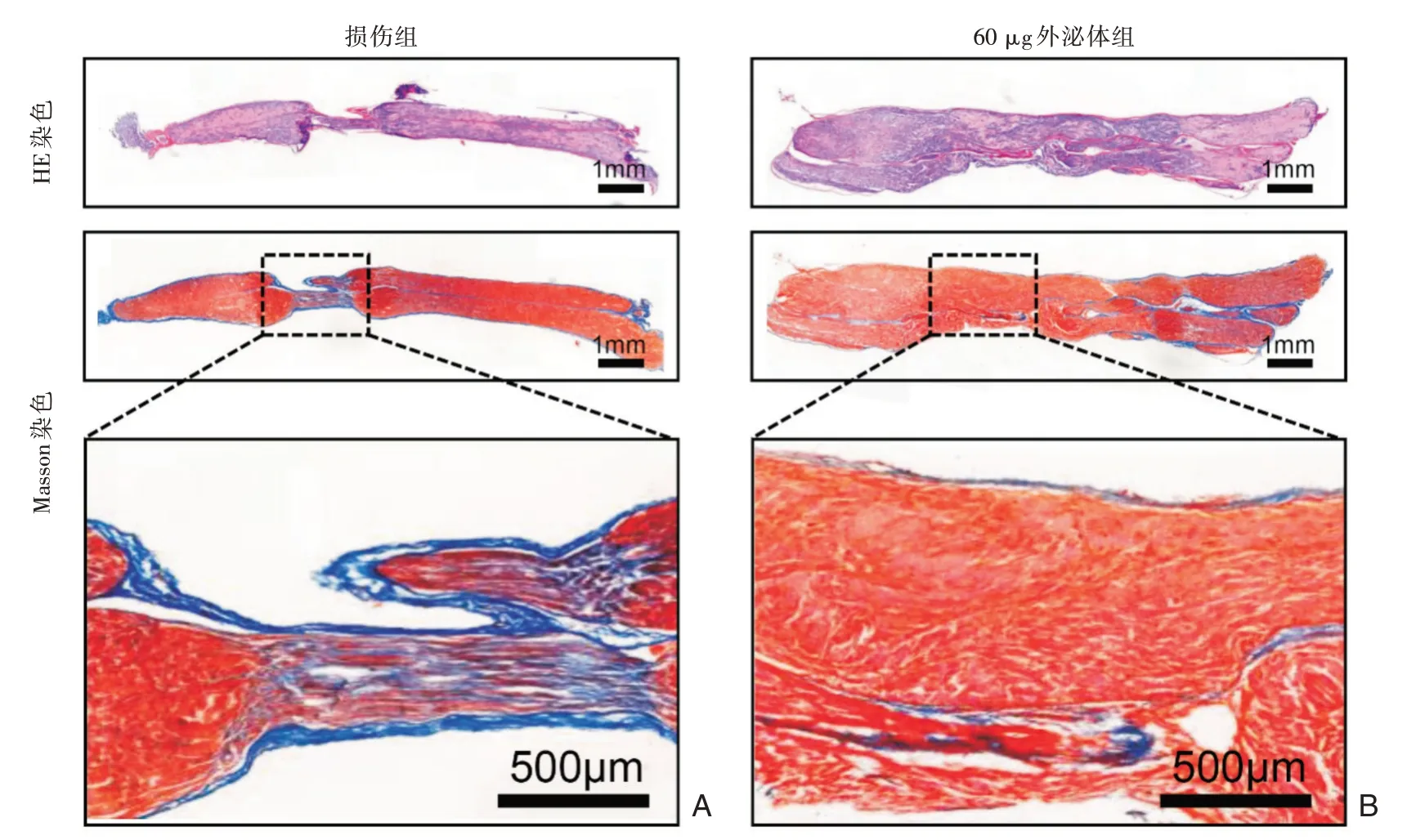
图5 外泌体治疗坐骨神经实验 A:坐骨神经的HE染色;B:坐骨神经的masson染色实验
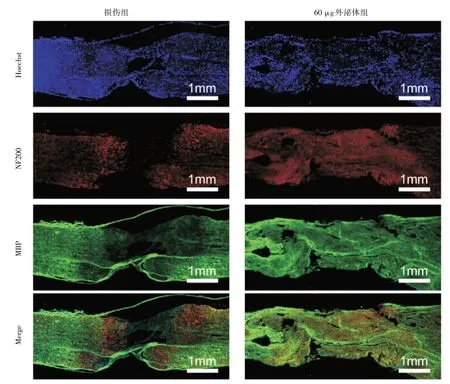
图6 外泌体促进坐骨神经的免疫组化实验
3 讨论
基于干细胞移植的治疗神经损伤的实验,已经显示出其促进神经再生、轴突再生和髓鞘形成的能力[6,7]。在此过程中,干细胞通过旁分泌作用传递多种因子,从而影响神经细胞的功能。已有的研究表明,不同来源的干细胞外泌体促进背根神经节神经元、皮层神经元和坐骨神经的神经突生长[2,8]。外泌体的重要功能是物质交换和细胞信号传导,从而实现调节靶细胞的增殖、分化、代谢、凋亡[9]。此外,外泌体还具有低免疫原性及无伦理风险的优势。本研究通过粒径分析、透视电镜检测及特异表面标记,证明成功提取了BMSCEXOs。在PC12细胞实验中,BMSC-EXOs有效被吞噬,其内的细胞信号因子也同时进入PC12细胞,并有效促进了PC12细胞的轴突生长及轴突相关蛋白的表达,同时,随BMSC-EXOs的治疗剂量的增加,轴突的长度及轴突相关蛋白的表达增强。因此我们认为BMSC-EXOs至少激活了PC12细胞,其中包括增殖及轴突再生的机能。
大鼠坐骨神经挤压是一种广泛用作外周神经损伤的疾病模型。通过局部注射BMSC-EXOs治疗大鼠坐骨神经损伤,本研究从组织学上观察到损伤的坐骨神经有效吞噬BMSC-EXOs,并在4周后观察到损伤的病变区域缩小,损伤神经重新连接,与此同时,损伤轴突也得以再生,实验结果令人鼓舞。而其中的作用机制与外泌体传递的神经营养因子、miRNA、调节神经炎症、促进血管再生反应有关。研究表明,外泌体的miRNA谱与母细胞有明显的差别,外泌体能传递特定miRNA促进靶细胞神经发生和髓鞘形成[10,11];此外,既往实验证明间充质干细胞外泌体富含多种神经营养因子,例如神经胶质细胞源性神经营养因子(GDNF)、成纤维细胞生长因子1(FGF-1)、脑源性神经营养因子(BDNF)、胰岛素样生长因子-1(IGF-1)和神经生长因子(NGF)[12],外泌体发挥的有益作用与传递这些神经营养因子密切相关。外泌体具有调节神经炎症的作用,抑制IL1B、IL6、TNFA和IL12P40的表达同时,提高抗炎蛋白IL10和TGF-β1的水平[13]。外泌体促进周围血管的再生同样提供了轴突再生的微环境[11,14]。我们认为BMSC-EXOs的治疗作用贯穿于损伤及修复的过程。最终我们在大鼠体内进行疗效验证,治疗组的坐骨神经的解剖形态及镜下结构,轴突相关蛋白的表达,都明显优于损伤组,支持我们的设想。
综上所述,本研究在体外实验中证实BMSCEXOs被PC12细胞摄入可以明显促进轴突的生长和延伸,体内实验则证实了应用BMSC-EXOs治疗可明显促进轴突再生并减少病变面积,探索了BMSC-EXOs在坐骨神经损伤中的治疗作用,由此为干细胞疗法的旁分泌作用提供佐证,推测外泌体是干细胞疗法的不可忽视的治疗角色。本研究丰富了外泌体治疗神经损伤的机制研究,为后期外泌体的研究提供新的参考。
