光生物调节作用对高糖环境下成骨细胞影响的体外实验研究*
2021-06-23王欢欢
王欢欢 苌 彪 李 炜 温 宁
由外伤、炎症、肿瘤等引起的颌骨缺损在口腔临床中极为常见,而糖尿病患者因机体长期处于高血糖水平,会引起骨代谢紊乱,影响颌骨缺损修复[1]。有研究表明,光生物调节作用(photobiomodulation,PBM)可以作用于骨缺损区促进骨再生[2-3]。光生物调节作用又叫做低强度光疗、弱激光治疗等,主要指利用低强度的激光照射组织或细胞,引起光生物反应的治疗方法。光生物调节作用局部温度不会明显提高,不会对组织或细胞产生不可逆性损伤[4]。本研究主要探讨了高糖环境下,光生物调节作用对成骨细胞增殖分化的影响,以期为促进高糖环境下颌骨缺损的修复提供理论依据。
1.材料和方法
1.1 主要材料和仪器 成骨细胞前体细胞MC3T3-E1 细胞株(中国科学院细胞库)、CCK8 试剂盒(上海碧云天,中国)、碱性磷酸酶染液(Sigma-Aldrich,美国),碱性磷酸酶检测试剂盒(上海碧云天,中国)、茜素红染液(北京索莱宝,中国)、ReverTra Ace qPCR RT Master Mix(TOYOBO,日本)、SYBRGreen RealtimePCR Master Mix-Plus(TOYOBO,日本)、BCA 试剂盒(上海碧云天,中国)。
半导体激光器MDL-III-808nm-FC(808±5nm,长春新产业光电技术有限公司,中国)、倒置光学显微镜BX 53(Olympus,日本)、细胞培养箱(Thermo,美国)、分光光度计(BioTek,美国)、QuantStudio 7 Flex Real-Time PCR 仪(Thermo,美国)。
1.2 细胞培养 MC3T3-E1 以α-MEM 培养基(含胎牛血清10%、双抗1%、葡萄糖浓度5.5mmol/ L)在培养箱中(37℃、5 %CO2)培养,每两天更换一次培养基,待细胞融合至80-90%时进行传代培养。当进行成骨诱导时,更换为成骨诱导液(含有地塞米松10nM、β-磷酸甘油10mM、维生素C50ug/ mL的α-MEM)。
1.3 实验分组 实验分为四组,分别为对照组、光照组、高糖组、高糖+光照组。对照组和光照组在低糖培养基(葡萄糖浓度5.5mmol/ L)中培养,高糖组和高糖+光照组在高糖培养基(葡萄糖浓度25mmol/ L)中培养。待细胞贴壁后,光照组和高糖+光照组给予808nm 近红外激光连续照射(20mW/ cm2,10min,12J/ cm2),每天一次。激光器输出功率为320mW,方形光斑边长4cm,照射距离50cm。
1.4 细胞活力检测 将MC3T3-E1 接种于96 孔板中(2.0×103个/ 孔),置培养箱孵育过夜(5%CO2,37℃)。待细胞贴壁后,按实验分组给予相应处理。分别在24h、48h 和72h,参照CCK-8试剂盒说明书测定各孔的吸光值,依据公式计算每组的细胞活力。每组设置5 个复孔,实验重复3 次。

1.5 碱性磷酸酶染色 将MC3T3-E1 接种至48 孔板(1.0×104个/ 孔),培养箱中孵育24 小时后,按实验分组给予相应处理。每两天各组更换对应新鲜成骨诱导培养液,培养至14 天时进行碱性磷酸酶染色:移除培养基,不含钙离子的PBS 清洗3 次→4%多聚甲醛固定20min,超纯水清洗两遍→300μL 碱性磷酸酶染液染色15min,超纯水洗去未结合染液→倒置光学显微镜观察,相机拍摄大体图。每组设置3 个复孔,实验重复3 次。
1.6 碱性磷酸酶活性检测 将MC3T3-E1 接种至6 孔板(2.0×105个/ 孔),培养箱中孵育24小时后,按实验分组给予相应处理。每3 天各组更换对应新鲜成骨诱导培养液,培养至14 天时进行碱性磷酸酶活性检测:移除培养基,不含钙离子的PBS 清洗3 次→加入100μL IP 裂解液→收集细胞裂解液到EP 管→12000g,4℃,离心5min,取上清→BCA 法检测样本蛋白浓度→参照碱性磷酸酶活性检测试剂盒说明书,检测各组上清405nm吸光度,并换算出碱性磷酸酶活性。
1.7 茜素红染色 将MC3T3-E1 接种至48 孔板(1.0×104个/ 孔),培养箱中孵育24 小时后,按实验分组给予相应处理。每3 天各组更换对应新鲜成骨诱导培养液,培养至21 天时进行茜素红染色:移除培养基,不含钙离子的PBS 清洗3 次→4%多聚甲醛固定20min,超纯水清洗两遍→300μL 茜素红染色30min,超纯水洗去未结合染液→倒置光学显微镜观察,相机拍摄大体图。用Image Pro Plus 6.0 对钙结节染色面积进行分析。每组设置3 个复孔,实验重复3 次。
1.8 实时荧光定量PCR 检测成骨基因OCN、Runx2 表达 将MC3T3-E1 接种至6 孔板(2.0×105个/ 孔),培养箱中孵育24 小时后,按实验分组给予相应处理。每3 天各组更换对应新鲜成骨诱导培养液,培养至21 天时参照TRIZOL 试剂盒说明书提取细胞总RNA,并检测RNA 浓度。根据ReverTra Ace qPCR RT Master Mix 试剂盒说明书进行逆转录:5x RT Master Mix2 μL,RNA 模板1μg(x μL),DEPC 水(8-x)μL,37℃15min→98℃5min→4℃维持。最后进行PCR:维持阶段:95℃60s→循环阶段(40 次):95℃60s,60℃15s,72℃45s→融解曲线分析。引物序列由上海生工合成(见表1)。用2-ΔΔCt法计算基因的相对表达。

表1 成骨基因引物序列
1.9 统计学分析 所有数据均使用x¯±SD(平均值±标准差)表示,采用GraphPad Prism 6 制作图表并进行统计学分析,单因素方差分析(one way-ANOVA)评价多组间的统计学差异,P﹤0.05 表示差异具有统计学意义(* 表示P﹤0.05,** 表示P﹤0.01,***表示P﹤0.001)。
2.结果
2.1 光生物调节作用对MC3T3-E1 细胞活力的影响 在本研究中,我们采用了808nm 近红外激光连续照射,功率密度20mW/ cm2,照射时间为10min,能量密度为12J/ cm2。从图1 可以看出,在24h 时,与对照组相比,光照组MC3T3-E1 的细胞活力增强(P﹤0.05),高糖组无统计学差异;在48h、72h 时,与对照组相比,高糖组细胞活力受到抑制(P﹤0.05、P﹤0.001),光照组细胞活力增强(P﹤0.001);
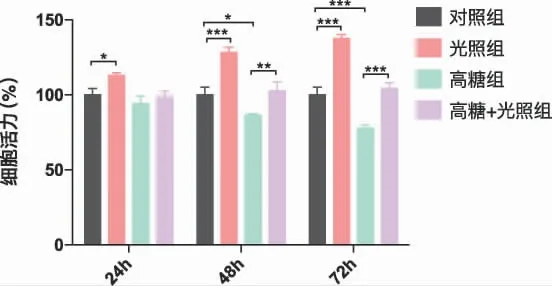
图1 24h、48h、72h 各组细胞活力(*P﹤0.05,**P﹤0.01,***P﹤0.001)
高糖+光照组与高糖组相比,在24h 时细胞活力无统计学差异,在48h、72h 时细胞活力提高(P﹤0.01,P﹤0.001);高糖+光照组与对照组相比,在24h、48h、72h 时细胞活力无统计学差异。
2.2 光生物调节作用对碱性磷酸酶染色及活性的影响 我们在14 天时对碱性磷酸酶进行染色,并对碱性磷酸酶活性进行定量分析。如图2 所示,碱性磷酸酶被染成蓝色,大体图和镜下图不能明显区分出各组染色强度。定量结果显示(图3),与对照组相比,光照组碱性磷酸酶活性显著升高,高糖组降低,差异具有统计学意义(P<0.01),高糖+光照组与高糖组相比,碱性磷酸酶活性增高(P﹤0.05);高糖+光照组与对照组相比,碱性磷酸酶活性无统计学差异。
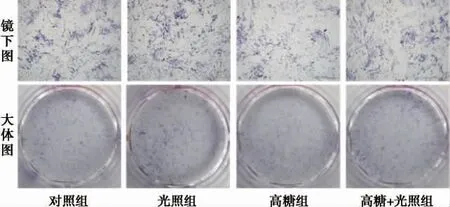
图2 14 天时碱性磷酸酶染色情况
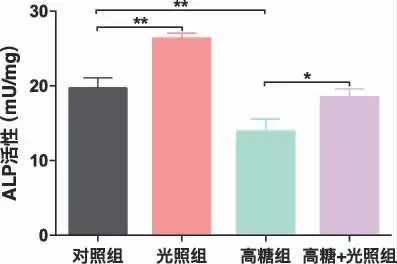
图3 14 天时碱性磷酸酶活性(*P﹤0.05,**P﹤0.01)
2.3 光生物调节作用对细胞外钙沉积的影响细胞外钙沉积能被茜素红染成红色,是反应成骨细胞分化终末阶段的重要指标。从图4 中可以看出,各组钙结节呈现出不同程度的点状沉积。为了更好的对钙沉积水平进行评价,我们用Image ProPlus 6.0 对钙结节染色面积进行半定量分析(图5)。结果显示,与对照组相比,光照组钙结节明显增多(P<0.001),高糖组钙结节显著减少(P<0.05);高糖+光照组与高糖组相比,钙结节显著增加;高糖+光照组与对照组相比,钙结节也相对增加,差异具有统计学意义(P<0.01)。
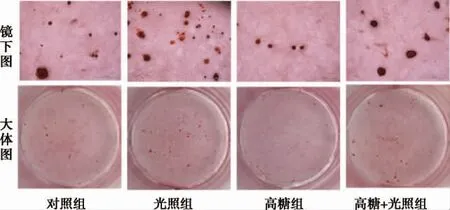
图4 21 天时细胞外钙沉积情况
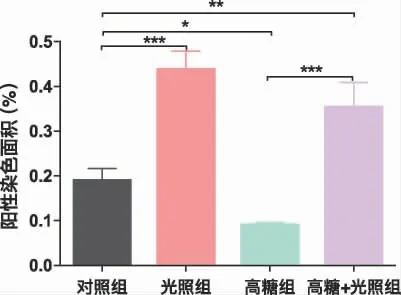
图5 21 天时细胞外钙沉积半定量图(*P﹤0.05,**P﹤0.01,***P﹤0.001)
2.4 光生物调节作用对成骨基因OCN、Runx2表达的影响 骨钙素(Osteocalcin,OCN) 是一种骨基质蛋白,由成骨细胞合成并分泌,在成骨细胞分化及骨基质矿化中起重要作用[5]。Runx2 作为骨细胞的特异性转录因子,参与多种信号通路调控成骨分化过程[6]。在本实验中我们检测了21 天时MC3T3-E1 中OCN 和Runx2 的表达。如图6 所示,与对照组相比,高糖组OCN 和Runx2 的表达受到了抑制(P<0.01、P<0.05),光照组OCN和Runx2 的表达增强(P<0.01);高糖+光照组与高糖组相比,OCN 和Runx2 的表达增强(P﹤0.05,P﹤0.01);高糖+光照组与对照组相比,OCN 和Runx2 的表达无统计学差异。

图6 21 天时成骨基因相对表达情况(*P﹤0.05,**P﹤0.01)
3.讨论
全球有数亿人罹患糖尿病,由于肥胖和人口老龄化的影响,其患病率在逐年上升,其中中国糖尿病患者数排名第一[7]。骨愈合受损是糖尿病重要并发症之一[8],糖尿病可影响颌骨和牙槽骨的骨代谢,导致骨质疏松、骨愈合不良等。据报道,糖尿病患者的骨折愈合时间延长了87%[9],其中2 型糖尿病患者牙槽骨再生量约减少55%[10]。研究显示,高糖环境可导致体内钙磷代谢紊乱,抑制成骨细胞的增殖和分化,打破骨代谢平衡,使糖尿患者骨愈合受损[1]。在本实验研究中,与对照组相比,高糖组细胞活力下降,钙结节明显减少,碱性磷酸酶活性降低,OCN 及Runx2 的表达下降,说明在高糖环境中成骨细胞的增殖分化受到了抑制,与目前的研究结论相同。
大量研究表明,光生物调节作用具有减轻炎症反应、促进伤口愈合、营养神经等作用,并且能够促进骨再生[2,3]。光生物调节作用机制主要通过细胞色素c 氧化酶吸收光子提高线粒体功能,促进ATP 生成,同时影响细胞通路中重要的酶,促进各种基因表达,活性氧及一氧化氮在此过程中也被认为发挥重要作用[11,12]。Pyo 团队研究了808nm 激光照射(功率密度80mW/ cm2,能量密度1.2J/ cm2,24 h/ 次,共3 次)对低氧环境下人成骨细胞的影响,结果显示光生物调节作用可促进低氧环境下骨形成蛋白2、骨钙素、转化生长因子β1基因的表达[13]。Michael 用820nm 镓-铝-砷化物(Ga-Al-As)激光照射下颌牵张成骨动物模型新西兰大白兔(功率400mW,能量6J,共6 个位点),结果发现光生物调节作用能促进牵张成骨过程中骨再生,联合弱激光进行牵张成骨,可缩短治疗周期[14]。Aras 等用808nm 激光(功率密度250mW/ cm2,能量密度5J/ cm2)对安装有扩弓矫治器的骨质疏松大鼠腭中缝进行照射,一天一次,共照射4 次,研究显示光生物调节作用能显著增加成骨细胞数量[15]。Khadra 研究弱激光(1.5J/ cm2和3J/ cm2)对人成骨样细胞在钛植入材料上增殖分化的影响,结果表明光生物调节作用能促进植入体周围组织细胞的增殖与分化,进而促进种植体与周围骨组织的早期愈合[16]。以上结果均表明,光生物调节可促进颌骨中成骨细胞的增殖与分化。在本研究中,光照组与对照组相比,成骨细胞MC3T3-E1 细胞活力增强,钙结节增多、碱性磷酸酶活性增强、OCN 和Runx2 表达上升,说明光生物调节可促进成骨细胞的增殖和分化,与上述报道结果一致。
此外,光生物调节作用还可以明显改善口腔粘膜溃疡引起的炎症反应[17]。有报道运用能量密度为8J/ cm2,波长为660nm 的Ga-Al-As 激光照射牙周炎部位,发现牙周膜细胞TNF-α、IL-1β、IL-6和IL-8 的表达下降,细胞内cAMP 的浓度上升,牙周炎症得到了很好的控制[18]。光生物调节作用与其他方式联合应用,也取得良好的效果。2020 年Thalaimalai 课题组将光生物调节作用与富含血小板的纤维蛋白(PRF)联合治疗牙周缺损,结果显示在6 个月后,与单纯应用PRF 相比,联合治疗组出血指数(BI)、牙周探诊深度(PPD)、相对临床附着水平(CAL)、牙槽骨高度等指标均显著改善[19]。此外,有文章总结了光生物调节作用在糖尿病中的应用,光生物调节作用可以改善胰岛素抵抗、降低糖耐量,改变体内氧化应激状态[20],但光生物调节作用对高糖环境下颌骨缺损修复的影响未见报道。
在本实验中,我们探究了高糖环境下,光生物调节作用对成骨细胞MC3T3-E1 增殖分化的影响。CCK8 实验结果提示,与高糖组相比,高糖+光照组可促进MC3T3-E1 的细胞活力,并随时间延长,促进效果越显著;细胞分化实验结果显示,在弱激光的照射下,处于高糖环境的成骨细胞MC3T3-E1 钙结节增加、碱性磷酸酶活性增强、OCN 和Runx2表达上升,说明光生物调节可促进高糖环境下成骨细胞的增殖与分化。目前光生物调节作用常用波长为600~1000nm,功率密度主要在1~500mW/ cm2,波长、功率密度、照射时间、照射频率、总能量等参数与治疗效果密切相关[12]。本实验仅选择了一种设定的弱激光照射参数,以后可通过改变照射参数进行系列研究,更好的促进成骨细胞的增殖分化。通过深入研究,以期为解决糖尿病患者颌骨缺损修复提供实验依据。
