CGF 对人根尖牙乳头干细胞增殖分化及迁移能力的影响*
2021-06-23张伟祥冯保静
张伟祥 白 雪 冯保静
年轻恒牙及未完全发育牙齿的根尖区组织含有大量前体细胞,Sonoyama 等[1]首先将这部分处于未分化状态的细胞分离培养,经检测其阳性表达干细胞表面标记分子,具有高增殖率、较强的自我更新能力和多向分化潜能,并命名为根尖牙乳头干细胞(stem cells from apical papilla,SCAPs)。研究显示来源于同一牙齿的SCAPs 较同源牙髓干细胞(dental pulp stem cells,DPSCs)和牙周膜干细胞(periodontal ligament stem cells,PDLSC)具有更强的增殖、分化能力[1-3]。另外,SCAPs 所处的生长环境血运侧支循环较髓腔内的DPSCs 更为丰富,因此当牙髓发生感染时,DPSCs 将失去活力,SCAPs却可继续保持其活性[4]。SCAPs 的出现为牙齿组织工程再生提供了新的方向,SCAPs 因其更强的增殖能力和多向分化潜能被认为是组织工程治疗中非常具有潜力的种子细胞,在牙齿修复再生及组织重建中起着重要作用。
CGF 是近年来发现的一种新型血液来源的生物支架材料,由静脉取血后通过差速离心制作而成[5]。CGF 作为继富血小板纤维蛋白(platelet-rich fibrin,PRF)、富血小板血浆(platelet-rich plasma,PRP)后的新一代血小板浓缩物,其不仅是新一代生物支架材料,富含多种高浓缩的纤维蛋白(fibrous protein)及生长因子(growth factor),包括血管内皮生长因子(vascular endothelial growth factor,VEGF)、表皮生长因子(epidermal growth factor,EGF)、血小板衍生生长因子(platelet derived growth factor,PDGF)、转移生长因子-β(Transferring growth factor-β,TGF-β)、类胰岛素生长因子(insulin-like growth factor,IGF)以及成纤维细胞生长因子(fibroblast growth factors,FGF)等[6]。研究报道CGF 既有利于牙龈细胞增殖、粘附及胶原纤维的合成,加快软组织愈合[7],又能促进骨髓间充质干细胞的分化[8]。另外,CGF 具有纤维蛋白三维网状结构,制备过程中可捕获多种生长因子,并在后期节律性缓慢释放,为细胞的三维生长提供生物性支架材料[6,9],使得CGF 在牙髓损伤修复及及组织工程再生领域具有广阔临床应用前景。
目前研究发现自体CGF 可显著促进SCAPs增殖、迁移及成骨向分化,但患有贫血等血液疾病者其自体CGF 的使用受到了限制,那么异体CGF是否能够发挥同样的作用尚不明确,为阐明人自体CGF 及异体CGF 对SCAPs 影响的差异,本实验通过制取自体及异体CGF,检测其对SCAPs 生物学特性的影响,为异体CGF 的临床应用提供实验依据。
1.材料与方法
1.1 主要试剂与仪器 胰蛋白酶(Hyclone,美国);磷酸盐缓冲液(PBS)、胰酶细胞消化液、α-MEM培养基(Hyclone,美国);CCK-8(DOJINDO,日本);ALP 试剂盒(碧云天,中国);紫外线分光光度仪(Eppendorf,德国);实时定量PCR 仪(ABI,美国);细胞培养箱(Heraeus,德国);逆转录试剂盒(Takara,日本);倒置相差显微镜(Olympus,日本);胎牛血清(FBS);(Hyclone,美国);酶联免疫检测仪(BIO-TEK,美国);细胞培养板(Costar,美国);CD29、CD90、CD105、CD34、CD45(BIOLEGEND,美国);牛血清白蛋白(BSA)(Biosharp,中国)。
1.2 hSCAPs 的分离、培养及鉴定 口腔颌面外科收集12 名15~22 岁志愿者正畸拔除前磨牙及第三磨牙,要求牙齿完整无龋坏且根尖未发育完全,其中6 名志愿者同期抽取静脉血,进行自体CGF 膜片制备。拔除牙齿立即放入冰浴PBS 中,超净台内反复冲洗牙齿表面并去除牙龈、牙周膜软组织,使用手术刀片分离出根尖牙乳头组织放入1.5mL EP 管,使用眼科剪将根尖牙乳头组织块剪碎至1mm3大小,加入Ⅰ型胶原酶(3mg/ mL),轻柔混匀后放入37℃细胞培养箱中消化45min,10min 使用移液枪混匀一次,终止消化、离心去上清,细胞重悬并接种于培养瓶中,待细胞融合率达80%左右时,扩大培养用于后续实验。
流式细胞术鉴定:取第3 代hSCAP 接种于培养瓶,当hSCAP 融合率达80%左右,消化细胞为单细胞悬液后离心,0.5%牛血清白蛋白(BSA)重悬细胞,在流式细胞仪样品管中分别加入1mL 细胞悬液(1×106个/ mL),常温下孵育细胞悬液与目标抗体(CD29、CD90、CD105、CD34、CD45、IgG)1h,1000r/ min 离心后去上清,PBS 洗脱未结合抗体,上机检测表面标记物。
hSCAPs 成骨向诱导及成脂向诱导培养:当hSCAP 融合率达80%左右时,将培养基更换为成骨诱导培养基或成脂诱导培养基[9],诱导培养4 周后吸弃培养基,4%多聚甲醛固定细胞15min,使用三蒸水洗脱残留多聚甲醛,参照茜素红及油红O染色说明书进行染色,显微镜下观察并记录脂滴及钙化结节形成情况。
1.3 CGF 膜片的制备 经安阳市第六人民医院伦理委员会审批同意,在口腔颌面外科招募12名15~22 岁男性志愿者,要求身体健康,无系统性疾病,使用真空采血试管采取志愿者前臂静脉血,其中6 名志愿者拔除前磨牙或第三磨牙,进行自体根尖牙乳头干细胞培养。血液放入离心机,设置CGF 程序,Medifuge 离心机差速离心13 分钟,即可见真空管内富CGF 纤维蛋白凝块分为三层,中间层即为CGF 纤维蛋白层。分离出富CGF 纤维蛋白,制备CGF 膜,裁剪备用。hSCAPs 患者来源的CGF 为自体CGF 组(AutogenousCGF,A-CGF),其他志愿者来源的CGF 为异体CGF(homogenous CGF,H-CGF),A-CGF 和H-CGF 各六组。
1.4 CCK8 检测细胞增殖 将自体及异体CGF置于96 孔板中,取20μl 浓度为5×105/ ml 的细胞悬液接种于96 孔板自体及异体CGF 上,置于细胞培养箱中培养2h 左右,待细胞附着后,补加培养基至l00μl,分别培养1、3、5、7 天后,吸弃培养基,PBS 轻柔漂洗2 次,更换为100μl 的CCK-8工作液孵育2 小时,酶联免疫检测仪测定各组450nm 处吸光度(OD)值。
1.5 ALP 活性检测 将自体及异体CGF 置于6 孔板中,取500μl 浓度为5×105/ ml 的细胞悬液接种于6 孔板自体及异体CGF 上,置于细胞培养箱中培养2h 左右,待细胞附着后,补加培养基至2ml 培养24h,将培养基更换为成骨诱导液培养7天、14 天,对照组(Con)更换为不含CGF 膜的成骨诱导液,根据说明书测定各组ALP 活性。
1.6 实时定量聚合酶链反应检测成骨/ 成牙基因表达
成骨诱导培养液条件下培养7 天,提取细胞总RNA 并逆转录成cDNA,以cDNA 为模板,采用Real Time-PCR 检测各组ALP、DSPP、BSP、OCN 成骨/ 成牙相关基因的表达,以β-actin 为内参基因。Real Time-PCR 反应条件及反应体系参照说明书操作,引物序列见表1。

表1 成骨相关基因引物序列
1.7 Transwell 检测细胞迁移 在24 孔板Transwell 小室的下层加入自体或异体CGF 膜及600μL 培养液,细胞培养箱孵育24 小时,取生长状态良好的第3 代hSCAPs,胰酶消化后采用a-MEM 重悬细胞,取150μL(5×104/ ml)细胞悬液接种于小室,培养24h 后,多聚甲醛固定小室上迁移的细胞,用小棉签擦去小室上层为迁移细胞,1g/ L 结晶紫染色液20 分钟,清洗后显微镜下观察并记录细胞迁移数量。
1.8 统计学分析 采用SPSS13.0 软件对数据作单因素方差分析,组间比较采用t 检验或方差分析,实验均各重复3 次,数据为均数±标准差,P<0.05 具有统计学意义。
2.结果
2.1 hSCAPs 的培养及鉴定 hSCAPs 成骨、成脂向诱导4 周后,茜素红染色可见成骨诱导组细胞可形成大量钙化结节(图1),而油红O 染色可见成脂诱导组细胞内有红色脂滴形成(图2),说明hSCAPs 具有多向分化潜能。流式结果显示CD105、CD90、CD29 呈阳性表达,而CD34、CD45 则阴性表达,符合间充质干细胞的表面分子表达特性(图3)。

图3 根尖牙乳头干细胞流式鉴定
2.2 CGF 对hSCAPs 增殖能力的影响 CCK-8检测结果显示,自体CGF 组(A-CGF)、异体CGF组(H-CGF)和对照组在培养hSCAPs 1d 时,各组间无明显统计学差异(P>0.05),而在第3、5、7d时,A-CGF 组及H-CGF 组的OD 值均明显高于对照组(P<0.05);而A-CGF 组与H-CGF 组间无显著性统计学差异(P>0.05)(图4)。

图4 自体及异体CGF 对hSCAPs 增殖活性的影响
2.3 CGF 对hSCAPs 成骨/ 成牙能力的影响hSCAPs 成骨诱导培养7d、14d 后,A-CGF 组及H-CGF 组的ALP 活性均显著高于对照组(P<0.05),而A-CGF 组与H-CGF 组间无统计学差异(P>0.05)(图5)。qPCR 检测结果显示,A-CGF 组及H-CGF组中ALP、DSPP、BSP、OCN 基因的表达均高于对照组,差异有统计学意义(P<0.05)(图6)。

图5 自体及异体CGF 对hSCAPs ALP 活性的影响
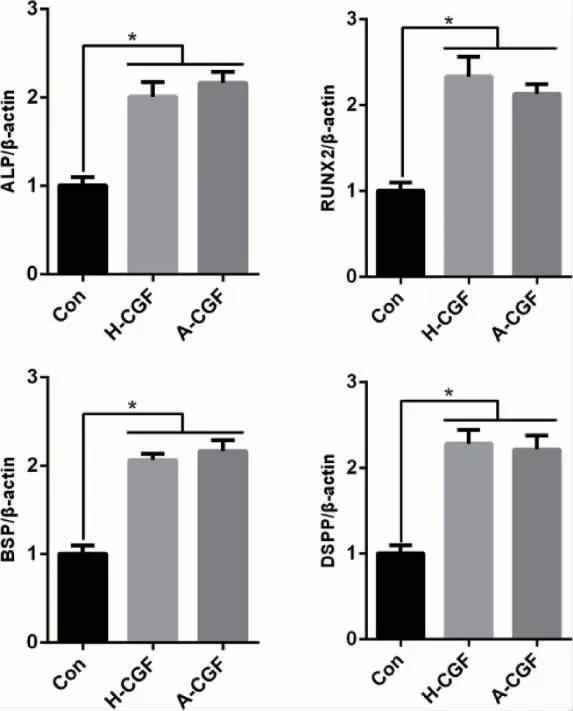
图6 自体及异体CGF 对hSCAPs 成骨/ 成牙基因表达的影响
2.4 CGF 对hSCAPs 迁移能力的影响 细胞接种Transwell 上室后24h,A-CGF 组及H-CGF组迁移至下室的细胞数目均明显高于对照组(P<0.05),且A-CGF 组较H-CGF 组中细胞迁移数量更多,组间有显著性统计学差异(P<0.05)(图7)。
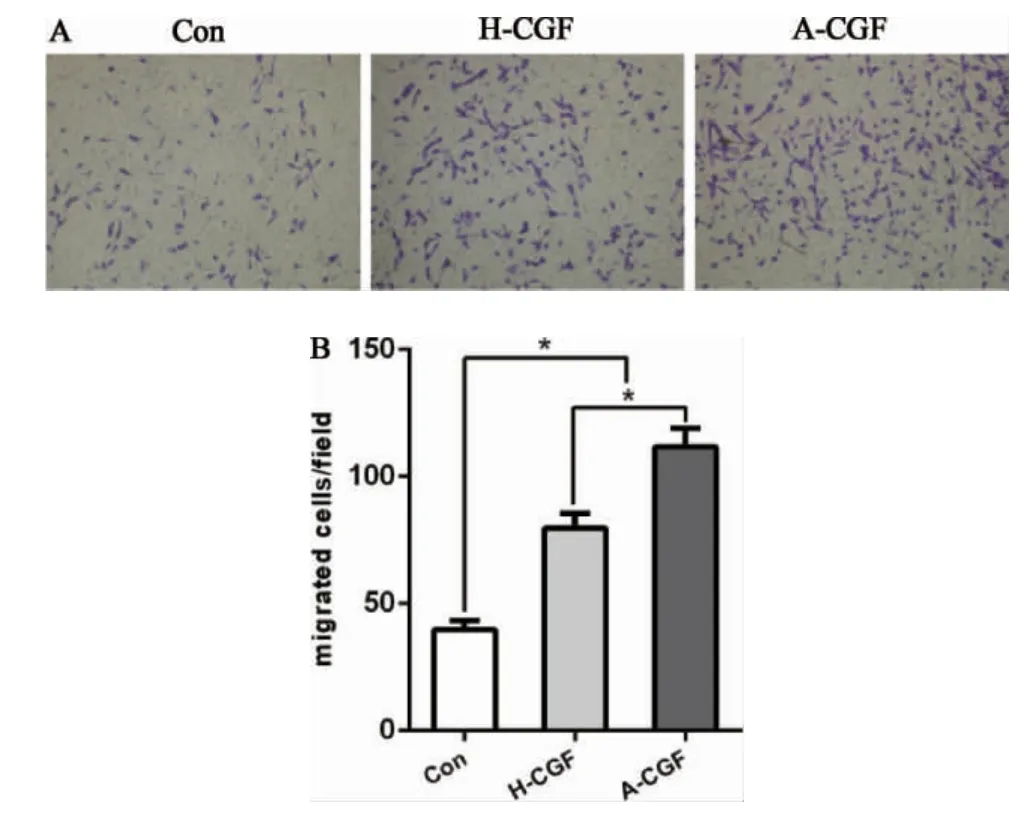
图7 自体及异体CGF 对hSCAPs 迁移能力的影响
3.讨论
SCAPs 属于间充质干细胞,主要生活在牙根未发育完全的年轻恒牙及乳牙中,其具有高度增殖能力和成骨/ 成牙分化能力,在牙根发育过程中发挥着重要作用[10]。研究显示SCAPs 可调控端粒末端转移酶和细胞凋亡蛋白,使其相较于其他牙源性干细胞增殖能力更强[1-3]。Zhang H 等人将SCAPs接种于羟基磷灰石(HA-TCP)支架材料,两者复合后植入裸鼠皮下,可形成典型的牙髓-牙本质样复合体结构[11],提示SCAPs 是一种非常具有组织工程应用前景的种子细胞。
CGF 在2006 年被首次报道以来,以其兼具生物支架材料和富含多种生长因子的特性迅速成为研究热点。CGF 通过特殊的不间断差速离心方法制取,使其能够形成更加致密、强度更高的纤维网状支架,并能更好的富集高浓度纤维蛋白和生长因子[12]。CGF 中生长因子的缓慢释放相较于PRP 和PRF 更接近组织愈合的自然过程,在软、硬组织愈合过程中的促进作用更强[9]。研究发现,CGF 刺激间充质干细胞后,可通过TGF-β/ BMP、Wnt/β-catenin 等通路上调干细胞内成骨基因的表达,进而调控细胞成骨向分化,促进骨组织再生[13]。Hong 等[14]发现,CGF 内的细胞因子可趋化牙髓干细胞聚集,促进细胞增殖和分化,在根尖周炎中炎症性牙髓的再生中发挥重要作用。Ding 等临床研究表明CGF 在牙髓再生治疗中可发挥缓慢释放细胞生长因子和作为细胞生长支架的双重作用,不仅能替代牙髓血运重建传统治疗中的血凝块,还可提高牙髓再生治疗的成功率[15]。体外研究显示自体CGF 可促进PDLSC 的增殖、成骨向分化能力[16],而hSCAP 在牙根的形成和发育中发挥关键作用,尤其是根尖诱导成形术中牙根继续发育的重要细胞来源,明确CGF 对SCAP 生物学特性的影响对CGF 在牙组织工程中的应用具有重要意义。
本研究选取自体CGF 及异体CGF 对hSCAPs进行培养,检测hSCAPs 的增殖、迁移及成骨/ 成牙分化等生物学特性。CCK8 实验结果显示,初期CGF 对hSCAPs 增殖的影响尚不明显,而自体及异体CGF 在第3、5、7 天均可明显促进hSCAPs的增殖。ALP 活性及qPCR 检测成骨/ 成牙基因结果显示,自体及异体CGF 对SCAPs 成骨/ 成牙向分化具有显著促进作用,而自体及异体CGF 组间对hSCAPs 增殖、成骨分化的影响无明显差异。细胞迁移实验则显示自体及异体CGF 对hSCAPs迁移能力具有明显促进作用,且自体CGF 比异体CGF 对hSCAPs 促迁移作用更为明显。我们推断自体CGF 相较于异体CGF 含有更多可诱导hSCAPs迁移的细胞因子,进而导致自体CGF 相较于异体CGF 对hSCAPs 具有更强的促迁移作用。研究表明,制备CGF 过程中,真空离心管的不同规格可使最终获得的CGF 纤维支架具有一定的差异[17],并且不同志愿者的身体状况、年龄、性别及生活习惯等差异较大,则制备出的CGF 在浓度和活性方面也会产生较大差异[18];因此,本实验制备CGF时选用18~20 岁健康男性志愿者,并采用同一批次静脉血采集管,以减少年龄、性别差异引起的实验误差。
综上,CGF 作为最新一代的血小板纤维蛋白浓缩物,在压制成膜后可为细胞提供生长及增殖的空间,富含多种细胞生长因子并具有可吸收性生物膜的特性,在牙髓-牙本质再生中可发挥重要作用。本研究显示自体及异体CGF 均可明显促进SCAPs增殖、迁移能力,增加碱性磷酸酶活性、提高成骨/成牙相关基因的表达水平,促进成骨/ 成牙向分化,为异体CGF 在口腔组织工程临床应用中提供理论基础。
