TMIGD1在结肠癌中的表达及对结肠癌细胞增殖和侵袭的影响
2021-06-23吴云桦谭敏王子君孙学军李凡妮
吴云桦 谭敏 王子君 孙学军 李凡妮
结肠癌是常见的消化道恶性肿瘤之一,在全球范围内,其发病率及病死率均位于前列,是严重威胁人类健康的恶性疾病[1]。进一步探究结肠癌发生发展的分子机制,有助于促进我们对该病的认识并寻求有效的治疗方式[2]。TMIGD1(Transmembrane and immunoglobulin domain-containing protein 1)是新近发现的一种细胞粘附分子,主要表达于肠和肾脏的上皮细胞[3]。现有研究表明,TMIGD1在肾上皮细胞中高表达,具有抑制肾上皮细胞迁移、保护肾细胞免受氧化损伤的功能;然而在肾癌细胞中,其表达下调并表现出抑制肾癌细胞增殖、迁移及细胞周期等抑癌基因活性[3-4]。另有研究表明,在正常肠道黏膜上皮逐步发展成为癌前病变及结肠癌的过程中,TMIGD1含量显著下降,然其机制尚不清楚[5]。本研究通过分析TMIGD1在结肠癌及相应癌旁正常结肠上皮组织中的表达情况,采用慢病毒包装系统建立稳定过表达TMIGD1的SW480结肠癌细胞株,检测TMIGD1对结肠癌细胞增殖、克隆形成、细胞周期以及迁移和侵袭的影响,并分析其潜在机制。
1 材料与方法
1.1 结肠癌组织、细胞及病毒转染
采用GEPIA数据库(http://gepia.cancer-pku.cn/)对TMIGD1在结肠癌组织以及正常肠粘膜组织中表达情况进行对比,其中包括癌组织275例,正常组织349例。 此外,收集2019年6月—2019年12月在西安交通大学第一附属医院普通外科行手术切除的结肠癌组织及其相应癌旁正常组织40例,并收集患者临床病理资料,包括27例男性,13例女性,平均年龄为65岁±12岁。本研究征得所有入组患者同意并签署知情同意书,通过西安交通大学第一附属医院伦理委员会同意。本研究中使用的人结肠癌细胞系SW480由西安交通大学第一附属医院医学转化中心馈赠。细胞培养于含有10%胎牛血清(四季青)和1%双抗(Hyclone)的DMEM高糖培养基(Hyclone),培养条件5%CO2、37℃。TMIGD1过表达质粒购自上海吉玛公司,慢病毒转染严格按照操作说明进行。
1.2 免疫组织化学染色
临床标本置于10%福尔马林(青岛捷世康生物科技有限公司)中固定24 h,然后石蜡包埋并制备4 μm病理切片。抗原修复采用高压修复法,免疫组织化学SP法染色按照试剂盒说明书进行(武汉博士德生物工程有限公司),TMIGD1抗体(货号:bs-9427R,北京博奥森生物技术有限公司)稀释浓度为1∶50。免疫组织化学染色评分参照既往文献所述[6],由两位独立的研究人员进行。
1.3 MTT实验
取对数生长期的细胞,以5 000个细胞/孔接种于96孔板中(200 μL/孔),待细胞生长融合后,每孔加入20 μL MTT溶液(上海源叶生物科技有限公司),培养4 h后弃去孔板中的上清液,每孔加入150 μL DMSO溶液,摇荡10 min,通过酶标仪检测吸光度(490 nm)OD值,计算细胞增殖率。
1.4 平板克隆形成实验
于6 cm细胞培养皿中接种1 000个细胞,充分摇匀后放置于培养箱中培养14天,每3~5天更换培养基,并在显微镜下定时观察细胞生长情况,培养14天后,2%结晶紫溶液对孔内细胞染色,镜下拍照并统计每孔的克隆形成数目。克隆率=克隆形成数目/接种细胞数目×100%。
1.5 细胞周期检测
于6孔板中接种2×105个细胞,培养24 h后使用含EDTA的0.25%胰酶消化细胞为单细胞悬液,PBS溶液洗涤2遍后弃上清液,使用预冷的70%乙醇于-20℃固定过夜。次日离心沉淀细胞,PBS洗涤1次后加入RNase A,于37℃下孵育30 min以充分降解细胞内RNA,离心并弃去上清液,加入PI染液悬浮细胞,于4℃避光孵育30 min,通过流式细胞仪上机检测,结果用FlowJo软件进行细胞周期分析。
1.6 Transwell小室实验检测细胞迁移和侵袭
以200 μL体积无血清培养基将4×105个细胞加入至Transwell小室上层,将含10%血清的完全培养基500 μL加入至下室,于培养箱中培养48 h后4%多聚甲醛固定10 min,使用1%结晶紫染色30 min,用湿棉签轻轻擦去小室内贴壁细胞,置于倒置显微镜下观察,随机选取5个高倍镜视野对穿膜细胞进行计数。
1.7 Western blot实验
使用RIPA蛋白裂解液(西安赫特公司)冰上裂解细胞30 min后,离心并通过BCA试剂盒(西安赫特公司)进行蛋白定量,制备蛋白样品。分离胶浓度为12%,每孔加入20 μg蛋白,电泳120 min后30 V电压PVDF转膜过夜,5% BSA/TBST溶液封闭30 min,加入相应一抗在4℃孵育过夜,TBST洗涤3次,随后孵育二抗1 h,TBST洗涤2次后通过电化学发光法进行检测。抗体信息如下:p21(1∶1 000,Immunoway公司),Cyclin D1(1∶1 000,Immunoway公司),E-cadherin(1∶1 000,Proteintech公司),Vimentin(1∶1 000,Proteintech公司),Snail1(1∶1 000,Proteintech公司),GAPDH(1∶1 000,Proteintech公司)。
1.8 细胞粘附率检测
细胞粘附采用细胞粘附检测试剂盒(北京百奥莱博科技有限公司)进行。包被96孔板后,每孔接种5×104个细胞,设置5个平行对照。将细胞于37℃培养30 min后吸除培养基,然后用相应的培养基洗涤3次,每孔加入100 μL新鲜培养基,然后加入10 μL细胞染色液。37℃孵育4 h后通过酶标仪于450 nm处测定各孔的吸光度值。细胞粘附率(%)=(待测细胞OD-空白OD)/(对照细胞OD-空白OD)×100%。
1.9 统计学方法
本研究使用SPSS 18.0行统计学分析,计量资料满足正态分布使用t检验和配对t检验,并采用均数±标准差表示。计数资料使用卡方检验或者Fisher精确检验。重复测量设计资料使用重复测量方差分析并用Bonferroni法进行两两比较,P<0.05为差异具有统计学意义。
2 结果
2.1 TMIGD1在结肠癌中的表达情况
通过检索GEPIA数据库发现,相较于癌旁正常组织,TMIGD1在结肠癌组织中呈低表达(图1A)。对收集的结肠癌相应临床标本进行免疫组织化学染色发现,TMIGD1主要表达在细胞质和细胞膜,并且肿瘤组织中TMIGD1免疫组织化学染色评分明显低于癌旁正常组织(t=3.013,P=0.003)(图1B,C)。
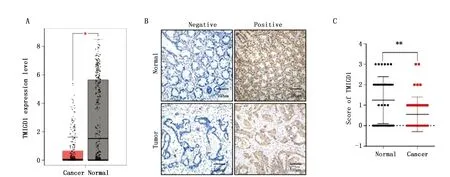
图1 TMIGD1在结肠癌肿瘤组织和癌旁正常组织中的表达情况
2.2 结肠癌组织中TMIGD1的表达与临床病理因素的关系
进一步分析结肠癌中TMIGD1的表达与患者临床病理因素之间的关系,发现TMIGD1的阴性表达与结肠癌的淋巴结转移(P=0.037)和TNM分期(P=0.022)密切相关(表1)。
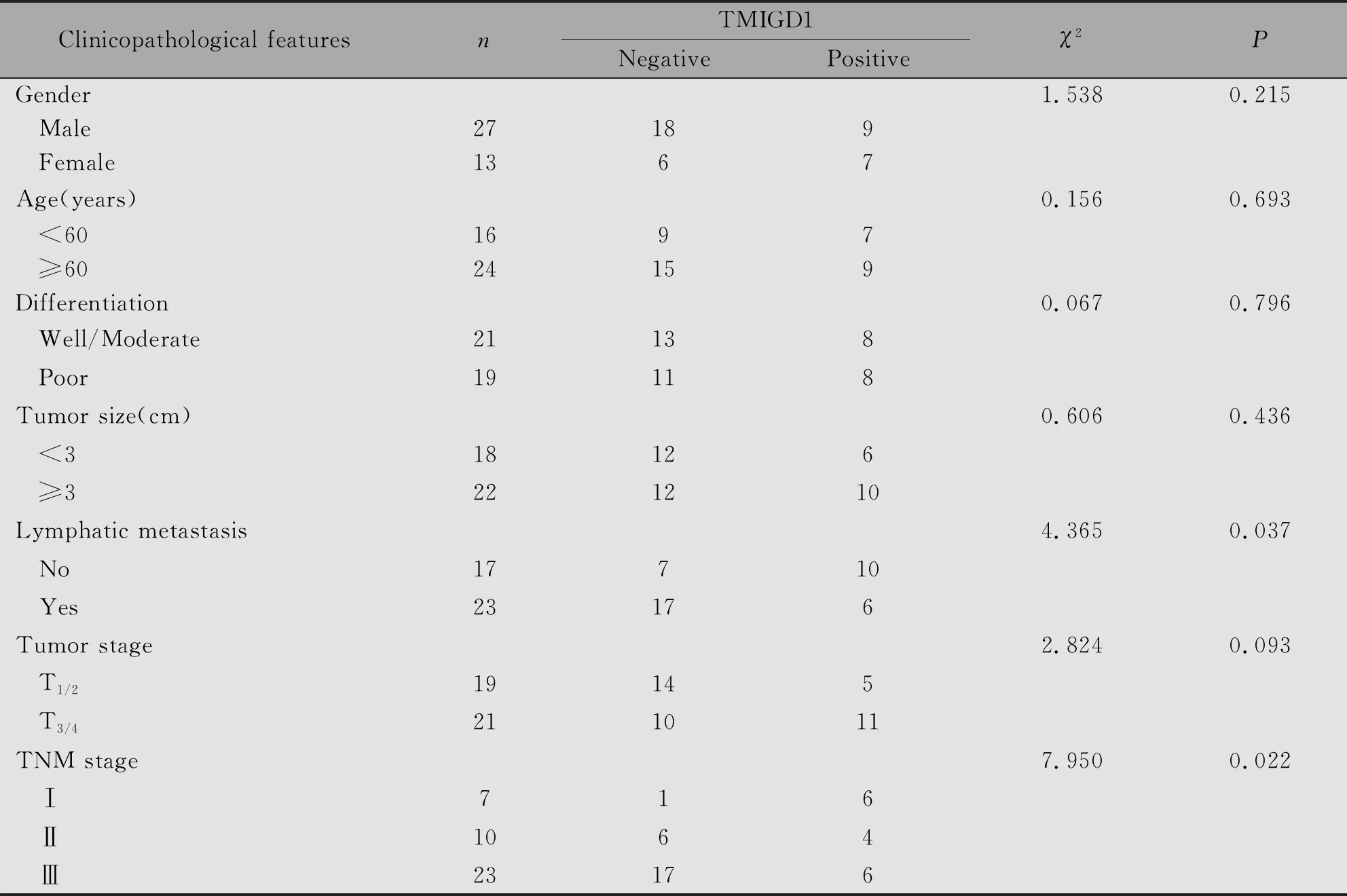
表1 结肠癌中TMIGD1的表达与临床病理因素之间的关系
2.3 过表达TMIGD1能够抑制结肠癌细胞SW480的增殖能力
为进一步了解TMIGD1对结肠癌细胞生物学行为的影响,我们构建了稳定过表达TMIGD1的细胞株。通过体外细胞实验,发现过表达TMIGD1后结肠癌细胞的增殖能力自第4天开始受到抑制(P<0.05)(图2A),并且克隆形成能力也明显降低(t=6.236,P=0.003)(图2B)。结肠癌细胞中G0/G1期的细胞数目明显升高(t=8.601,P=0.001)(图2C)。通过Western blot检测细胞周期相关蛋白,发现过表达TMIGD1细胞株中p21表达明显升高(t=5.768,P=0.004),而Cyclin D1的表达明显降低(t=5.745,P=0.005)(图2D)。
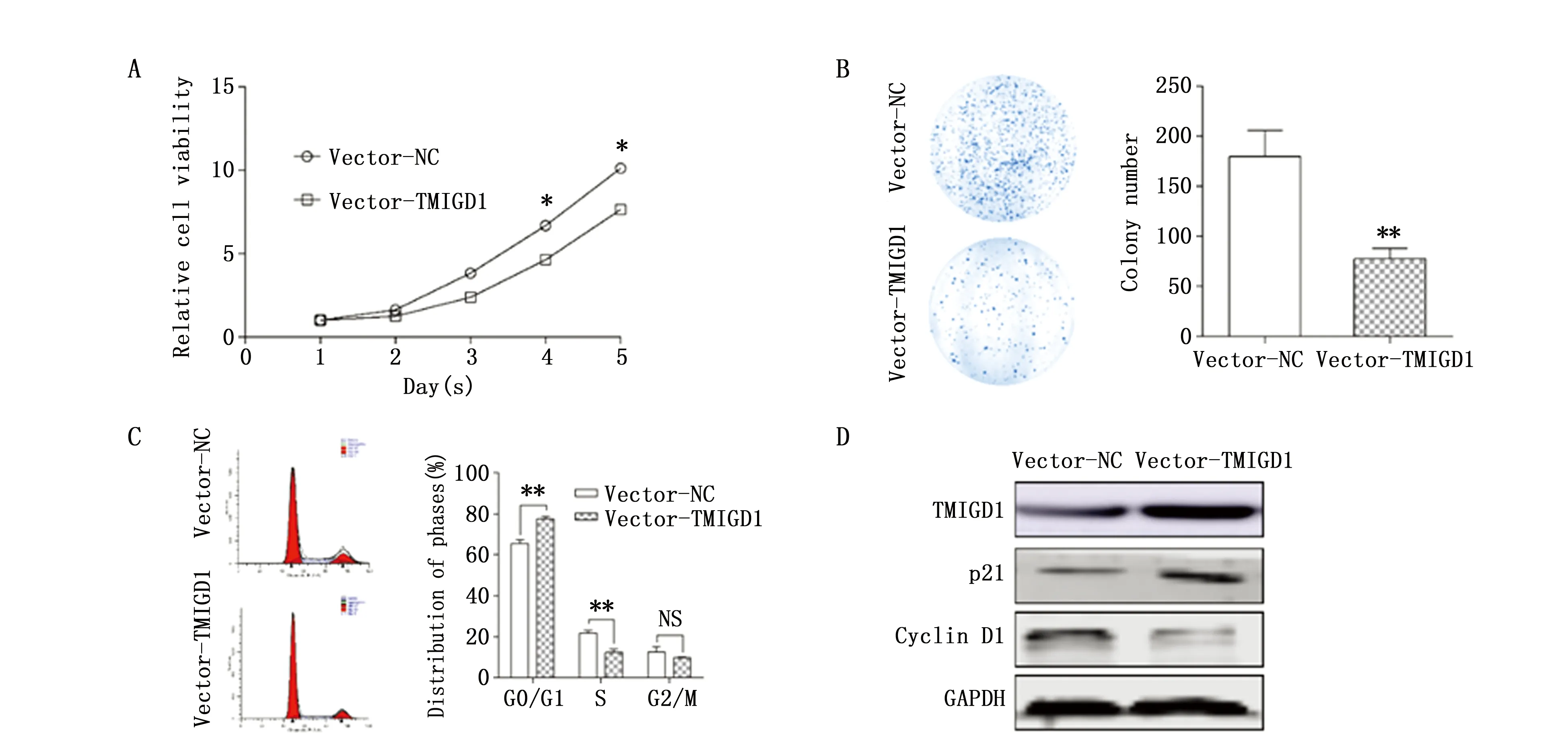
图2 过表达TMIGD1能够抑制结肠癌细胞SW480的增殖
2.4 过表达TMIGD1能够抑制结肠癌细胞SW480的迁移侵袭能力
Transwell实验,发现过表达TMIGD1后,细胞的迁移能力(t=3.388,P=0.028)和侵袭能力(t=4.571,P=0.010)受到抑制(图3),结合本研究关于TMIGD1与结肠癌的淋巴结转移和TNM分期的相关性结果,表明TMIGD1可能影响结肠癌细胞株的迁移与侵袭能力。
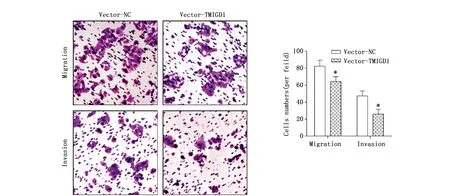
图3 Transwell实验检测TMIGD1过表达组与对照组细胞的迁移与侵袭能力(200×)
2.5 TMIGD1能够促进结肠癌细胞SW480的粘附能力
本研究通过Western blot检测TMIGD1过表达组和对照组中EMT相关蛋白E-cadherin、Vimentin和Snail1的表达,但两组细胞并无差异(图4A)。由于TMIGD1是细胞粘附分子之一,进一步检测了两组细胞的粘附能力,发现过表达TMIGD1能够明显促进细胞的粘附(t=5.985,P=0.004)(图4B)。
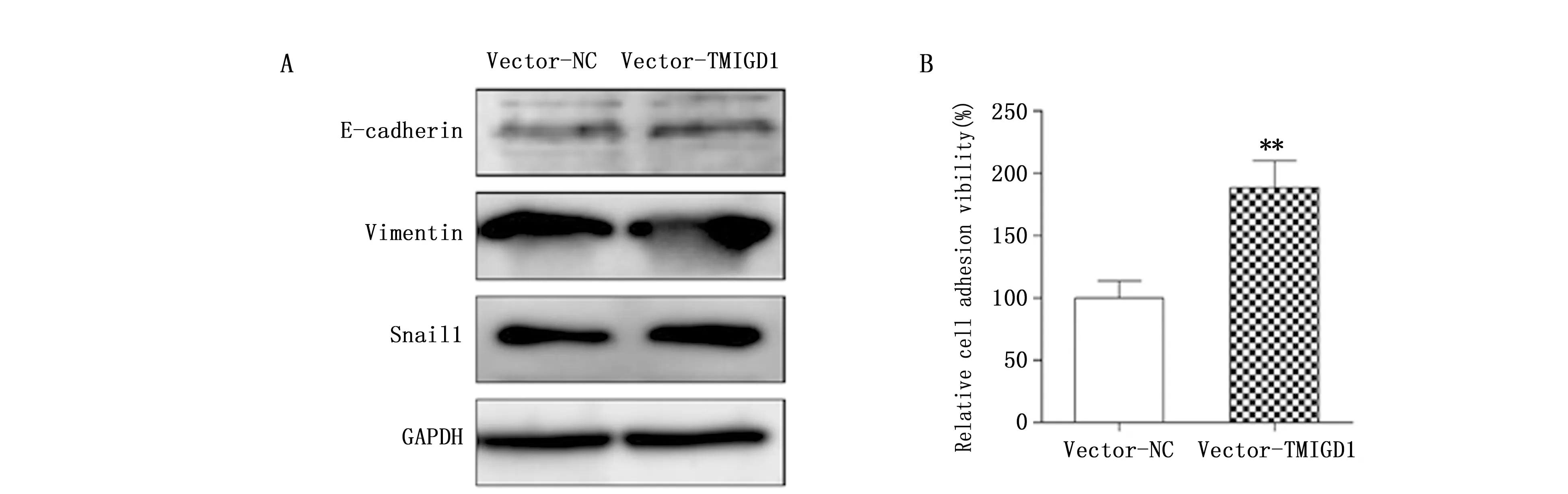
图4 TMIGD1对EMT相关蛋白及细胞粘附能力的影响
3 讨论
随着人们生活方式和环境的改变,结肠癌的发病呈上升趋势[7]。虽然目前有关结肠癌治疗的理论和技术手段已经取得了一定的进展,但肿瘤转移和复发仍是影响患者预后的重要因素[8-9]。因此,积极探究结肠癌的发生发展机制,寻求新的治疗靶点是目前的研究热点之一。
TMIGD1属于新近发现的一类细胞表面粘附分子,本研究旨在探究TMIGD1与结肠癌发生发展的关系。通过生物信息学GEPIA数据库分析发现,相较于癌旁正常组织,TMIGD1在结肠癌中呈现低表达;随后本研究对收集的结肠癌临床标本进行免疫组织化学染色,进一步证实了该结果,并且发现TMIGD1的阴性表达与结肠癌的淋巴结转移和TNM分期密切相关。此前已有研究发现TMIGD1在结肠癌组织中呈现低表达[10],与本研究结果一致。
本研究进一步实验结果表明,过表达TMIGD1能够降低SW480细胞增殖及克隆形成能力,并将细胞周期阻滞在G0/G1期;同时,过表达TMIGD1细胞株中p21表达明显升高,而Cyclin D1的表达明显降低,提示TMIGD1可能通过影响调控细胞周期的相关蛋白来抑制细胞的增殖。此前,Meyer等[4]研究发现过表达TMIGD1通过活化p38蛋白的磷酸化上调p21等蛋白的表达,从而抑制肾癌细胞的增殖,这与本研究的结果相符;此外,该研究进一步在基因水平发现C/EBPβ/TMIGD1信号通路在调控肾癌细胞TMIGD1表达方面发挥了显著作用。后续研究需进一步验证该机制在结肠癌中的作用,并探索是否存在新的分子机制。
恶性肿瘤的重要特征之一是局部侵袭和远处转移[11],本研究发现过表达TMIGD1可以明显抑制SW480细胞的迁移和侵袭能力。上皮-间质转化(EMT)是目前影响肿瘤转移的常见假说,即上皮细胞在特定条件下转化为间质细胞,失去极性及正常的细胞间连接,变成具有间质细胞形态和特性的一类细胞[12]。既往研究表明,EMT过程能够赋予细胞迁移侵袭能力,与患者预后不良密切相关[13]。本研究中,Western blot结果显示TMIGD1对EMT相关蛋白E-cadherin、Vimentin和Snail1的表达均无影响,提示TMIGD1抑制肿瘤转移的机制与EMT无关。而随后对细胞粘附能力检测发现,过表达TMIGD1能够明显促进细胞的粘附。这与TMIGD1促进肾小管上皮细胞与基底膜的粘附这一结论相符[4]。然而,关于TMIGD1促进细胞粘附的具体分子机制尚不清楚。
目前,对于TMIGD1在结肠癌发生发展过程中作用的认识仍较局限,后续研究应进一步探索其相应的分子机制;另外,应将对TMIGD1的研究与临床紧密结合,进一步分析TMIGD1的表达与患者病情及预后之间的关系,从而为寻求新的结肠癌诊断及治疗方式做铺垫。
综上所述,本研究表明TMIGD1在结肠癌中低表达,其与结肠癌的淋巴结转移和TNM分期密切相关。过表达TMIGD1可以抑制SW480结肠癌细胞的增殖、克隆形成、细胞周期进展以及迁移和侵袭能力,并促进细胞的粘附过程,提示TMIGD1可能在结肠癌进展中发挥抑癌基因的作用,具有作为肿瘤早期诊断标志物的潜在作用,并可为结肠癌的靶向治疗提供新的参考和方向。
