电离辐射对胃肠道间质瘤细胞增殖以及Ano1蛋白表达的影响
2021-06-23陈诣佳胡笑宇杨文生康政宇何升东
陈诣佳,胡笑宇,刘 希,杨文生,康政宇,何升东,张 林
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是胃肠道最常见的间质肿瘤,其表达的Ano1与GIST的生长增殖密切相关,可通过抑制胰岛素样生长因子结合蛋白5的表达,从而促进GIST生长增殖,同时也是GIST表达的一个敏感特异性标记物[1-2]。以往观念认为,GIST属于软组织肉瘤,对放射治疗不敏感[3],但其实在某些情况下放疗已被纳入GIST的多学科治疗策略。放疗作为手术的辅助手段,可能会抑制GIST对伊马替尼耐药性的发生,而且术前放疗有助于减少切除范围保留更多正常组织和更安全的剂量递增[4-5]。此外,在局部进行性或转移性GIST中,与放疗造成的毒性损伤相比,进行短期放射治疗对减轻具的局部症状更为有效[6-7]。最近十几年来,国外已有不少放疗在胃肠道间质瘤治疗中取得了明显效果的报道,但是目前尚未见对GIST放疗机制的基础研究报道。因此,本研究拟通过研究GSIT对电离辐射的敏感性,从而临床上GIST的放疗提供科学依据,为GIST放疗机制的研究奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 细胞来源和培养 实验细胞为人胃肠道间质瘤细胞GIST-T1,由北京北纳创联生物技术研究院提供。细胞培养基为CM5-1,成分为89%McCoy’s 5A培养基+10%胎牛血清+1%双抗。细胞于37℃、含5%CO2的培养箱中培养,细胞贴壁生长,上皮细胞样,梭形,成块生长。
1.1.2 主要试剂及仪器 医用电子直线加速器(美国VARIAN公司),McCoy’s 5A培养基(美国Hyclone公司),胎牛血清(美国Sciencell公司),兔源Anti-TMEM16A多克隆一抗、山羊抗兔IgG H&L(HRP)二抗(英国Abcam公司),PAGE凝胶快速制备试剂盒(上海雅酶生物科技有限公司),蛋白预染marker、GAPDH抗体(Thermo Fisher公司),Total RNA提取试剂盒、逆转录试剂盒(日本TaKaRa公司),CCK-8试剂盒(碧云天生物技术有限公司),二氧化碳培养箱、高速低温冷冻离心机、超声波细胞破碎仪(美国ThermoFisher公司),超净工作台(苏州华新空调净化有限公司)。
1.2 方法
1.2.1 GIST细胞分组与电离辐射 参考RYOO S B等[8]和钟军等[9]的文献,电离辐射采用医用直线加速器,辐射线源为1.25 MeV的γ射线,照射总剂量分别为2 Gy、5 Gy、7 Gy。照射剂量率为1.0 Gy/min。实验时间点分别为照射后1天,2天,3天,4天,5天。
1.2.2 细胞增殖 取对数生长期的GIST-T1细胞,PBS洗涤,胰蛋白酶消化后收集,250 g离心5 min,吸除上清液,制备单细胞悬液,调节细胞密度3×104个/mL,100μL/孔接种于96孔板中,待细胞贴壁后,设置0 Gy、2 Gy、5 Gy、7 Gy组,每组6重复,按实验方案进行电离辐射,同一块板为相同辐射剂量。电离辐射后放入孵箱,培养1 d、2 d、3 d、4 d、5 d后,吸弃上清,无血清培养基1:10稀释CCK8试剂,避光加入已稀释CCK8工作液110μL/孔,并轻轻晃动培养板数次,37℃、5%CO2恒温继续培养1.5 h。将孔板中的待检测液体每孔吸取90μL移入干净的96孔板中,使用酶标仪在450 nm波长处测定各孔的吸光值。
1.2.3 细胞凋亡 取对数生长期的GIST-T1细胞,PBS洗涤,胰蛋白酶消化收集,250 g离心5 min,吸除上清液,制备单细胞悬液。调节细胞密度5×104个/孔,500μL/孔接种于24孔板中。待细胞贴壁后,设置未照射、2 Gy、5 Gy、7 Gy组,每组3重复,同板为相同辐射剂量。电离辐射后细胞分别培养1 d、2 d、3 d、4 d、5 d后,收集上清,用PBS洗涤细胞2次,用不含EDTA胰酶消化,收集细胞与备用上清混匀,将细胞液移入1.5 mL管中。350 g离心5 min,吸除上清液,PBS洗涤1次,弃上清。用500μL的Binding Buffer重悬细胞,加入5μL AnnexinV APC混匀后,加入5μL的PI混匀。室温避光,反应10 min,进行流式细胞仪检测。
1.2.4 蛋白质印记 按说明书提取细胞总蛋白,NanoDrop2000核酸蛋白仪测定蛋白浓度。使用10%SDS-PAGE凝胶电泳,260 A,120 min转入PVDF膜中,脱脂奶粉室温封闭2 h,TBST洗膜10 min×3遍,分别加入TMEM16A抗体、GAPDH抗体(1:1000),4℃摇床过夜。TBST洗膜10 min×3遍,二抗(1:50000)室温孵育90 min,TBST洗膜10 min×3遍。ECL发光液覆盖,显影曝光处理。
1.2.5 RT-PCR 按照RNAiso Plus试剂盒的说明,用RNAiso Plus从新鲜培养细胞中提取总RNA。通过NanoDrop2000测定RNA浓度和纯度,使用逆转录试剂盒Prime Script RT Master Mix转录RNA为cDNA。根据Prime Script RT Master Mix试剂盒说明书,进行RT-PCR反应,反应条件为95℃,30 s和60℃,45秒,共40个循环,GAPDH为内参。引物由擎科生物有限公司设计合成,引物序列如下:Ano1上游引物:5’-CATCACACCAAGCCGACCTC-3’;Ano1下游引物:5’-CCCTGGAAGCCCTAAGACT-3’;GAPDH上游引物:5’‐CAATGACCCCTTCATTGACC-3’;GAPDH下游引物:5’‐GACAAGCTTCCCGTTCTCAG-3’。
1.3 统计学分析 所有数据用Excel软件处理,SPSS20.0软件分析,结果以(±s)表示。组间计量资料对比作方差齐性和正态性检验,满足方差齐性,以one-wayANOVA法进行方差分析,不满足方差齐性,则以非参数法检验。以P<0.05为差异有统计学意义。
2 实验结果
2.1 细胞生长状态观察 胃肠道间质瘤细胞在CM5-1培养基中培养。如图1,倒置显微镜下观察,放大倍数10×10,细胞贴壁生长,上皮细胞样,梭形,成块生长。见图1。
GIST细胞接受电离辐射后第1天,如图2,倒置显微镜下观察,放大倍数10×10,视野内细胞数量,照射组与未照射组相比差别不大,照射后第1天电离辐射对细胞增殖的抑制效应不明显。
图2 电离辐射后1天细胞生长形态
GIST细胞接受电离辐射后第2天,如图3,倒置显微镜下观察,放大倍数10×10,视野内细胞数量,2 Gy照射组与未照射组相比差异不大,而5 Gy、7 Gy照射组与未照射组相比可发现细胞数量略少。

图3 电离辐射后2天细胞生长形态
GIST细胞接受电离辐射后第3天,如图4,倒置显微镜下观察,放大倍数10×10,视野内细胞数量,2 Gy照射组不如未照射组密集,5 Gy照射组少于未照射组,7 Gy照射组更少,可见微量细胞漂浮于培养基上,可能是凋亡细胞。

图4 电离辐射后3天细胞生长形态
GIST细胞电离辐射后第4天,如图5,倒置显微镜下观察,放大倍数10×10,视野内细胞数量,2 Gy照射组不如未照射组密集,5 Gy照射组明显少于未照射组,可见微量漂浮细胞,7 Gy照射组细胞数量更少,可见少量漂浮细胞,可能是凋亡细胞。

图5 电离辐射后4天细胞生长形态
GIST细胞接受电离辐射后第5天,如图6,倒置显微镜下观察,放大倍数10×10,视野内细胞数量,未照射组极度密集,多于2 Gy照射组,2 Gy照射组可见微量漂浮细胞,5 Gy照射组细胞数量远不如未照射组,可见少量漂浮细胞,7 Gy照射组细胞数量更少,可见多量漂浮细胞,可能是凋亡细胞。
图1胃肠道间质瘤细胞生长形态

图6 电离辐射后5天细胞生长形态
2.2 细胞增殖活性检测结果 GIST细胞在接受电离辐射后,其增殖受到抑制。相同照射剂量下,随着照射后时间延长,抑制增殖的作用越来越明显;相同时间点下,提高照射剂量能增加电离辐射对GIST细胞增殖的抑制作用。通过公式抑制率=(1-实验组OD/对照组OD)×100%,计算不同电离辐射剂量处理后细胞的抑制率。见表1。
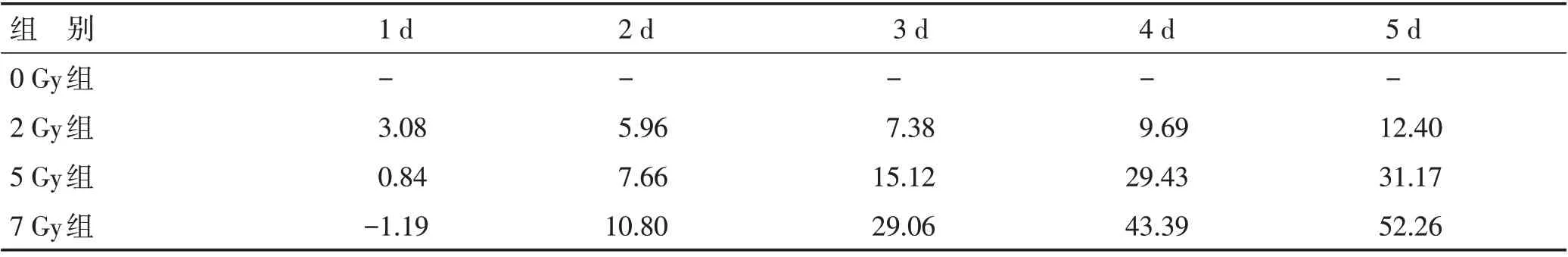
表1 不同电离辐射剂量处理细胞后的抑制率(%)
2.3 细胞凋亡检测结果 细胞凋亡实验表明,胃肠道间质瘤细胞在接受电离辐射后,出现细胞凋亡的现象。在相同照射剂量下,随着照射后时间延长,细胞凋亡率逐渐升高;在相同时间点下,照射剂量越大,细胞凋亡率越高。见表2。
表2 电离辐射对细胞的凋亡影响(±s)
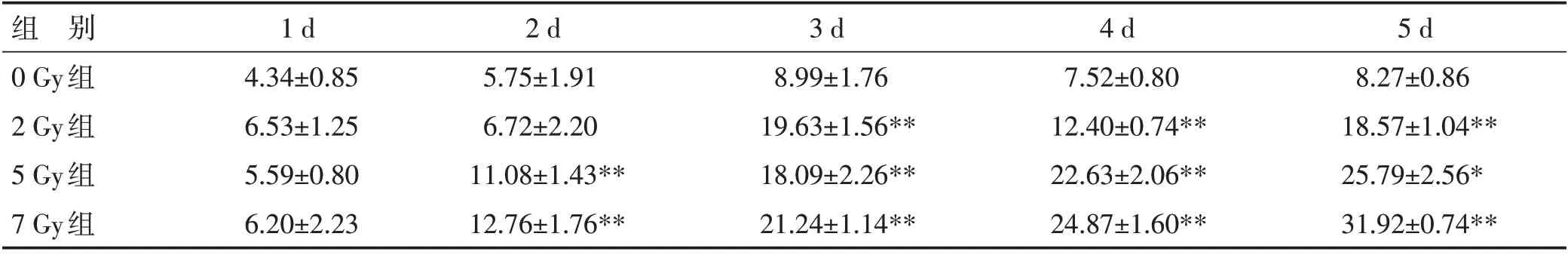
表2 电离辐射对细胞的凋亡影响(±s)
注:与同时间点0 Gy组相比,*为P<0.05,**为P<0.01
组 别0 Gy组2 Gy组5 Gy组7 Gy组5 d 8.27±0.86 18.57±1.04**25.79±2.56*31.92±0.74**1 d 4.34±0.85 6.53±1.25 5.59±0.80 6.20±2.23 2 d 5.75±1.91 6.72±2.20 11.08±1.43**12.76±1.76**3 d 8.99±1.76 19.63±1.56**18.09±2.26**21.24±1.14**4 d 7.52±0.80 12.40±0.74**22.63±2.06**24.87±1.60**
2.4 RT-PCR结果 电离辐射后,胃肠道间质瘤细胞的Ano1表达随时间呈现先下降然后逐渐回升的趋势。随着照射总剂量增加,对Ano1的表达抑制越来越明显。照射剂量越大,Ano1的表达抑制作用越早达到最大值,同时Ano1的表达恢复越来越慢。见表3、图7。

表3 电离辐射对胃肠道间质瘤Ano1、mRNA的表达影响

图7 电离辐射后Ano1的mRNA表达(a、b、c)
2.5 蛋白免疫印记结果 如图8,Ano1蛋白是一条114 KD的条带,符合Ano1蛋白分子量的大小。胃肠道间质瘤细胞接受照射后Ano1的蛋白表达变化趋势基本能符合照射后Ano1的mRNA表达变化趋势。随着照射剂量增大,Ano1表达下降幅度越来越大,下降的速度越来越快,恢复越来越慢。见表4、图8。
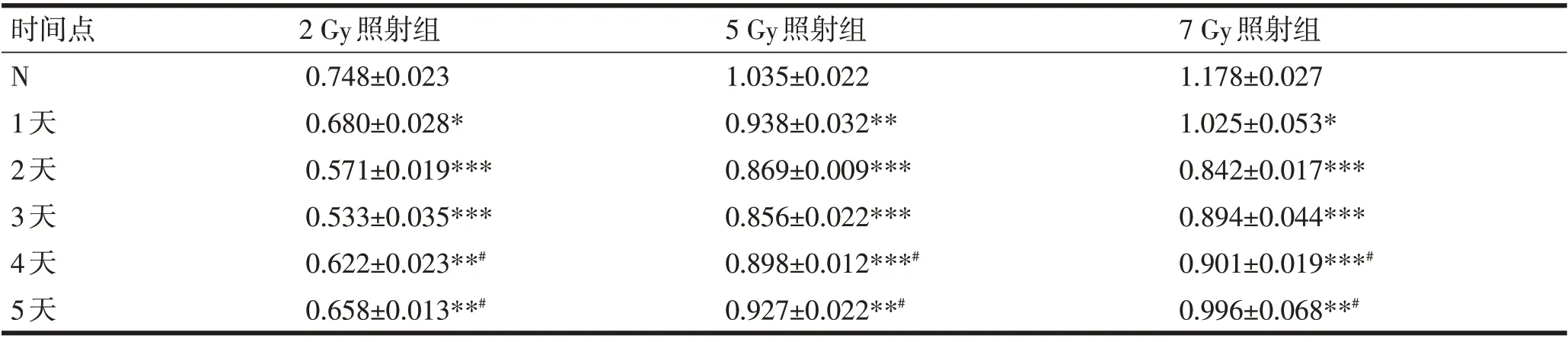
表4 电离辐射对胃肠道间质瘤Ano1蛋白的表达影响
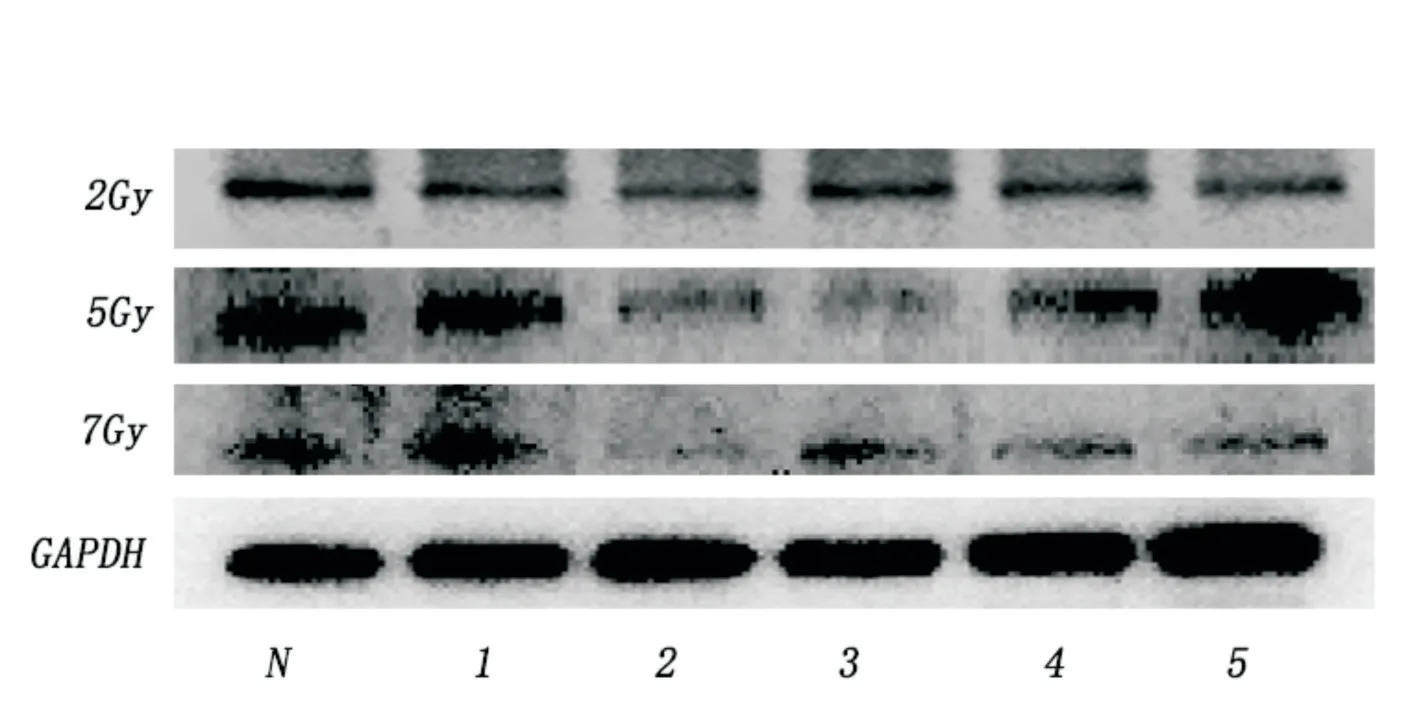
图8 Ano1蛋白表达量
3 讨论
放射治疗是治疗肿瘤的重要手段之一。影响疗效的因素是多方面的,如肿瘤的位置,肿瘤的大小、乏氧细胞的数量、肿瘤细胞的放射敏感性、治疗计划的合理性等。其中肿瘤细胞的放射敏感性是最重要的内在因素[10]。影响肿瘤细胞对放射治疗敏感性的因素有很多,其中肿瘤细胞的增殖活性与肿瘤细胞的放疗敏感性密切相关[11]。因此,我们采用CCK8实验,检测不同剂量照射后,各个时间段GIST细胞的增殖活性。本研究表明,电离辐射对GIST细胞的活性影响具有剂量和时间效应。GIST细胞在接受电离辐射后,其增殖受到抑制。在同一时间点,照射剂量越大,抑制细胞增殖的作用越大。在同一剂量照射,随着照射后时间延长,电离辐射对细胞的增殖抑制作用越来越明显。因此,电离辐射对GIST细胞的抑制作用具有剂量依赖性和时间依赖性,需要一定的剂量并且通过一定的时间积累才能达到抑制肿瘤增殖的效果。所以我们下一步实验可通过增加不同剂量照射组,适当延长照射后的时间,计算抑制作用达到峰值时的天数,进而寻找适合的照射剂量和照射周期,为未来临床上GIST放疗方案的制定提供参考。
细胞凋亡率是衡量肿瘤细胞放射敏感性的另一项重要指标。本实验表明,电离辐射可以诱导GIST细胞发生凋亡。相同照射剂量,随着照射后时间延长,细胞凋亡率逐渐升高;相同时间点,照射剂量越大,细胞凋亡率越大。证明了放射诱导的GIST细胞凋亡具有时间和剂量的依赖性。
我们的研究表明,GIST细胞在接受电离辐射后,在mRNA水平上,Ano1的表达呈现出先降低,随着时间缓慢恢复的趋势,且随着照射剂量增加,Ano1表达下降的程度越大、下降速度越快而且Ano1的表达恢复速度越慢。在蛋白质水平上与mRNA趋势一致。已有研究表明,Ano1与GIST细胞的生长发育密切相关,有着调节促进GIST细胞生长的功能[2]。除了GIST外,在胃癌中,Ano1的转录激活可以促进胃癌的进展,Ano1在胃癌组织中过表达,并且与胃癌肿瘤-淋巴结转移阶段相关。在体外实验中,敲低Ano1显着抑制了胃癌细胞的迁移和侵袭,而Ano1的缺失导致体内肿瘤转移受到抑制[12]。而在MCF7和MDA-MB-231乳腺癌细胞中,用T16Ainh-A01或siRNA抑制Ano1可以显着抑制细胞增殖。siRNA敲低Ano1诱导G0/G1细胞周期停滞,并显着抑制乳腺癌细胞的侵袭性[13]。因此,Ano1在各种不同类型的肿瘤中,无论是在调控肿瘤增殖方面还是在控制肿瘤转移侵袭等方面都起着不可或缺的作用,我们研究电离辐射对GIST细胞Ano1的表达变化,除了为GIST的放疗机制奠定基础,还能为其他类型肿瘤放疗机制的研究提供新的思路。综上所述,电离辐射对GIST细胞具有抑制细胞增殖和促进凋亡的作用,这也提示GIST细胞对电离辐射有一定敏感性,这为未来制定GIST的放疗方案提供了参考,为放疗在GIST治疗中的应用提供了科学依据,更是为进一步研究GIST放疗机制奠定了基础。本研究表明,GIST细胞接受照射后,Ano1的表达出现先降低、后回升的变化趋势,为以后深入研究GIST的放疗机制,进一步继续以Ano1为靶点研究GIST放疗敏感机制奠定了研究基础。
