茶叶加工过程对咖啡叶化学成分和抗氧化活性的影响
2021-06-22纪大乙马海乐山云辉陈秀敏
纪大乙,丁 健,田 雨,马海乐,2,3,山云辉,陈秀敏,2,3,*
(1.江苏大学食品科学与工程学院,江苏镇江212000;2.江苏大学食品物理加工研究院,江苏镇江212000;3.江苏大学食品营养与安全国际研究中心,江苏镇江212000;4.云南省德宏黑柔咖啡有限公司,云南芒市678400)
咖啡是继水和茶之后的第三大饮料,国际咖啡组织数据显示,2019年全球咖啡出口总量达1.687亿袋[1]。咖啡种植主要分布于赤道附近的热带和亚热带地区如南亚、中南美洲和非洲等。在我国,咖啡主要种植于云南省。由于咖啡的经济价值以及咖啡与人类健康的关系,咖啡豆的生物活性和化学成分被广泛研究。咖啡叶通常被认为是无价值或低价值的咖啡树副产物,有关咖啡叶的研究还非常欠缺。在主要的咖啡产地如埃塞俄比亚,印度尼西亚等地,咖啡叶具有200多年被作为茶饮料的历史,而且被当地的居民作为民族药物用于治疗或缓解多种疾病或不适症状,比如,在非洲,咖啡叶被用于治疗肠道疼痛和腹泻;在古巴,被用于缓解偏头痛;在墨西哥,被用于缓解发烧[2]。
目前,国内外对咖啡叶的研究主要侧重于生产地区、种属、生长阶段对其化学成分的影响方面以及简单的应用性研究。刘丽[3]采用晒青绿茶的加工工艺对咖啡鲜叶进行加工,研制出咖啡叶茶;山云辉[4]采用熏蒸、揉捻、干燥和包装的工艺流程将咖啡叶制作成茶。以上研究均通过对加工咖啡叶茶的感官评价来研究加工工艺并制备出色香味上乘的咖啡叶茶,然而这些研究并未探讨茶叶加工过程如何影响咖啡叶茶的化学成分以及生物活性。
由于咖啡叶含有丰富的植物化学成分,包括生物碱(咖啡因和葫芦巴碱)、酚酸类(咖啡酸、绿原酸、对香豆酸、阿魏酸、芥酸)、黄酮类化合物(花青素、槲皮素、槲皮素葡萄糖苷、异栎素、芸香苷、山萘酚)、儿茶酚类化合物、氧杂蒽酮类化合物(芒果素、异芒果素)以及氨基酸等活性化合物[5],近年来,咖啡叶对人体健康的影响受到了越来越多的关注。咖啡叶中的化学成分具有抗氧化、抗炎症、抗癌症等生物活性[6]。本实验室曾采用多种茶叶加工方法,将咖啡叶加工成茶,并研究了各种茶叶加工方法对咖啡叶的化学成分、抗氧化和抗炎活性的影响[7-9]。我们的前期研究发现,日式绿茶加工法加工的咖啡叶茶具有最高的化学成分和生物活性,而红茶加工法加工的咖啡叶茶则含有最低的活性成分。然而,每一个加工步骤(萎凋、揉捻、发酵、干燥)如何影响咖啡叶的基础成分、化学成分和抗氧化活性,以及上述指标在每一加工步骤中的变化规律如何尚未知。因此,本研究对不同叶龄的咖啡叶进行分步处理,探索叶龄和每个加工步骤对咖啡叶中基础成分、化学成分和抗氧化活性的影响规律,以期阐明影响咖啡叶茶质量的关键步骤,为高品质的咖啡叶茶的优化加工奠定基础。
1 材料与方法
1.1 材料与仪器
阿拉比卡卡地莫咖啡树鲜叶 于2018年8月29号上午采摘自云南后谷咖啡种植园,咖啡叶初步筛选后装纸箱并放入冰袋,然后经空运于8月31日到达镇江,进行进一步的加工;绿原酸异构体标准品(5-咖啡酰奎尼酸(5-caffeoylquinic acid,5-CQA)、4-咖啡酰奎尼酸(4-caffeoylquinic acid,4-CQA)、3-咖啡酰奎尼酸(3-caffeoylquinic acid,3-CQA)、3,5-二咖啡酰奎尼酸(3,5-dicaffeoylquinic acid,3,5-diCQA)、3,4-二 咖 啡 酰 奎 尼 酸(3,4-dicaffeoylquinic acid,3,4-diCQA)、4,5-二咖啡酰奎尼酸(4,5-dicaffeoylquinic acid,4,5-diCQA))、芦丁、芒果苷、咖啡因、葫芦巴碱 成都曼思特生物技术有限公司;2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzoth-iazoline-6-sulfonic acid,ABTS)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitro-phenylhydrazine,DPPH)、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,TROLOX) 上海MACKLIN公司;福林酚试剂(Folinol reagent,FC)北京SOLARBIO公司;乙腈(Acetonitrile,ACN)、2,4,6-三吡啶基三嗪(2,4,6-Tri(2-pyridyl)-striazine,TPTZ)、2,2-偶氮二(2-甲基丙基咪)二盐酸盐(2,2'-Azobismethylpropionamidine)dihydrochlorid,AAPH)及其它化学试剂 国药集团化学有限公司。
SPD-M20A高效液相色谱系统(SPD-M20A high performance liquid chromatography system,HPLC)日本岛津公司;Tecan Spark®10M酶标仪 上海帝肯贸易有限公司。
1.2 实验方法
1.2.1 咖啡叶加工 将新鲜的咖啡叶分为幼叶(Y)和成熟叶(M),根据Chen等[8]处理咖啡叶方法对鲜咖啡叶进行加工处理。将鲜咖啡幼叶和成熟叶分别进行萎凋12 h,揉捻5 min,发酵2 h或48 h后晒干。咖啡幼叶发酵2 h表示为Y-2 h,咖啡幼叶发酵48 h表示为Y-48 h,咖啡成熟叶发酵2 h表示为M-2 h,咖啡成熟叶发酵48 h表示为M-48 h。咖啡叶每经过一个加工步骤后分成两部分,一部分用于冷冻干燥,另一部分继续后续的加工,直到干燥。将干燥后的咖啡叶磨成粉末过100目筛子,然后保存于-20℃冰箱中备用。
1.2.2 咖啡叶预处理 称取0.5 g干咖啡叶粉末于100 mL烧杯中,加入15 mL沸水,于100℃水浴锅中提取10 min,然后用中速定性滤纸抽真空过滤,固体残渣再用相同体积的沸水提取一次,两次提取上清液混合并分装保存于-80℃冰箱中备用。
1.2.3 基础成分测定 参照GB 5009.3-2016测定水分;GB/T 8305-2013测定水浸出物;苯酚比色法测定可溶性糖[10];茚三酮法测定游离氨基酸(GB/T 8314-2002);凯氏定氮法测定蛋白质(GB 5009.5-2010)。
1.2.4 植物化学成分测定
1.2.4.1 HPLC定量分析生物碱和多酚 根据Chen等[8]测定植物化学成分的方法。采用HPLC法对咖啡叶提取物中的葫芦巴碱、咖啡因、芒果苷、芦丁、绿原酸(3-CQA,4-CQA,5-CQA,3,4-diCQA,3,5-diCQA,4,5-diCQA)含量进行测定。将咖啡叶提取物用超纯水稀释两倍,过滤器(0.22μm)过滤后上机检测。
色谱条件:色谱柱:Phenomenex Kinetex C18(100 mm×4.8 mm,5μm);时间程序:0~10 min,95%~80%A;10~13.5 min,80%A;13.5~18 min,80%~95%A;18~21 min,95%~5%A;21~23 min,5%~95%A;23~25 min,95%A,A相为0.1%三氟乙酸,B相为ACN;柱温:25℃;流速:1.5 mL/min;进样量:5μL。用Waters 2998 PDA检测器进行检测,检测波长分别为葫芦巴碱(264 nm)、咖啡因(280 nm)、芒果苷和芦丁(257 nm)、绿原酸(325 nm)。
1.2.4.2 总酚含量测定 总酚含量(Total phenol content,TPC)测定根据Chen等[9]描述的方法进行了一些修改。将样品稀释20倍,在96孔板上先加入0.1 mg/mL没食子酸标准品/样品20μL,再加入100μL 10倍稀释的FC试剂,室温反应1 min,最后加入80μL 75 mg/mL碳酸钠(NaCO3)溶液,室温避光反应30 min后在765 nm处测量吸光度。
1.2.4.3 总黄酮含量测定 根据赵佳利等[11]所描述的方法测定总黄酮含量(Total flavonoids content,TFC)。将样品用70%乙醇稀释适当倍数,在20 mL试管中先加入4 mL 0.2 mg/mL芦丁标准品/样品,再加入0.3 mL的10%硝酸铝溶液,静置6 min后加入4 mL的4%氢氧化钠溶液,最后加入1.7 mL的30%乙醇溶液,静置15 min后在510 nm处测量吸光度。
1.2.5 抗氧化活性测定
1.2.5.1 ABTS分析 根据Chen等[12]的方法对样品进行测定分析。将样品用水稀释20倍,在96孔板上先加入0.25 mmol Trolox标准品/样品(0~20μL),再加入180μL ABTS工作溶液,室温避光反应10 min,在734 nm处测量吸光度。然后用公式(1)计算出不同浓度下的抑制率,以浓度为横坐标抑制率为纵坐标进行回归,分别得到样品和Trolox的回归曲线。抗氧化活性以Trolox当量抗氧化能力(Trolox equivalent antioxidant capacity,TEAC)表示,通过公式(2)进行计算。
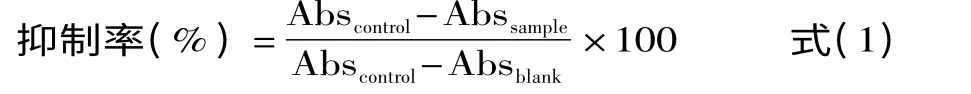
式中:Abscontrol表示ABTS工作液的吸光度即阳性对照,Abssample表示样品+ABTS工作液的吸光度,Absblank表示只有水的吸光度即阴性对照。

式中:样品或Trolox斜率是以浓度为横坐标,抑制率为纵坐标所作曲线的斜率。
1.2.5.2 DPPH分析 根据Chen等[12]提出的方法进行DPPH测定。将样品用甲醇稀释适当的倍数,在96孔板上先加入0.2 mmol Trolox标准品/样品(0~180μL),再加入20μL DPPH工作溶液,室温避光反应10 min,在519 nm处测量吸光度。结果以TEAC表示,计算方法同上。
1.2.5.3 FRAP分析 根据Benzie等[13]的方法进行FRAP测量。将样品用乙醇稀释10倍,在96孔板上先加入20μL标准品/样品,再加入180μL FRAP工作溶液,37℃反应20 min,在593 nm处测量吸光度。结果以TEAC表示,计算方法同上。
1.2.5.4 ORAC分析 根据Chen等[12]提出的方法进行ORAC测定。将样品用水稀释1000倍,在96孔板上先加入2 mmol Trolox标准品/样品(0~40μL),再加入100μL磷酸盐缓冲液(75 mmol pH 7.0),60μL荧光素钠盐(200 nmol),37℃反应10 min,最后加入200 mmol AAPH,在激发波长485 nm,发射波长527 nm条件下测量吸光度60次。用公式(3)计算曲线下面积后与样品浓度进行回归,然后以样品的回归曲线的斜率除以Trolox的斜率将ORAC值换算成Trolox当量。
式中:Ai为在第i次的荧光强度,A1为第1次的荧光强度。
1.2.6 相关性分析 将上述所测指标(基础成分、植物化学成分和抗氧化活性)进行相关性分析,分析各指标与加工步骤之间的关系。用MINITAB 17软件(Minitab Inc.,State College,PA,USA)进行主成分分析结果的分析。
1.3 数据处理
用Excel 2010软件处理数据并绘图,数据表示为三个平行实验的平均值±标准差,用MINITAB 17软件(Minitab Inc.,State College,PA,USA)进行统计分析,Tukey检验或t检验分析各组之间的显著差异,P<0.05表明有显著差异。
2 结果与分析
2.1 基础成分分析
表1为咖啡叶经各加工步骤后基础成分包括水分、水浸出物、可溶性糖、游离氨基酸、可溶性蛋白的含量。咖啡叶中水分含量受每个加工步骤的影响显著(P<0.05),呈下降趋势,且幼叶的含水量始终高于成熟叶。由于咖啡叶含水量随着叶龄的增长而降低,所以鲜咖啡幼叶含水量(79.87%)显著高于成熟叶(72.65%),且在萎凋、揉捻、发酵和干燥过程中幼叶与成熟叶含水量之间存在显著性差异。比较发酵时间对咖啡叶水分含量的影响发现,发酵2 h的咖啡叶含水量高于48 h,可能是因为水分在发酵过程中逐渐蒸发[14]。
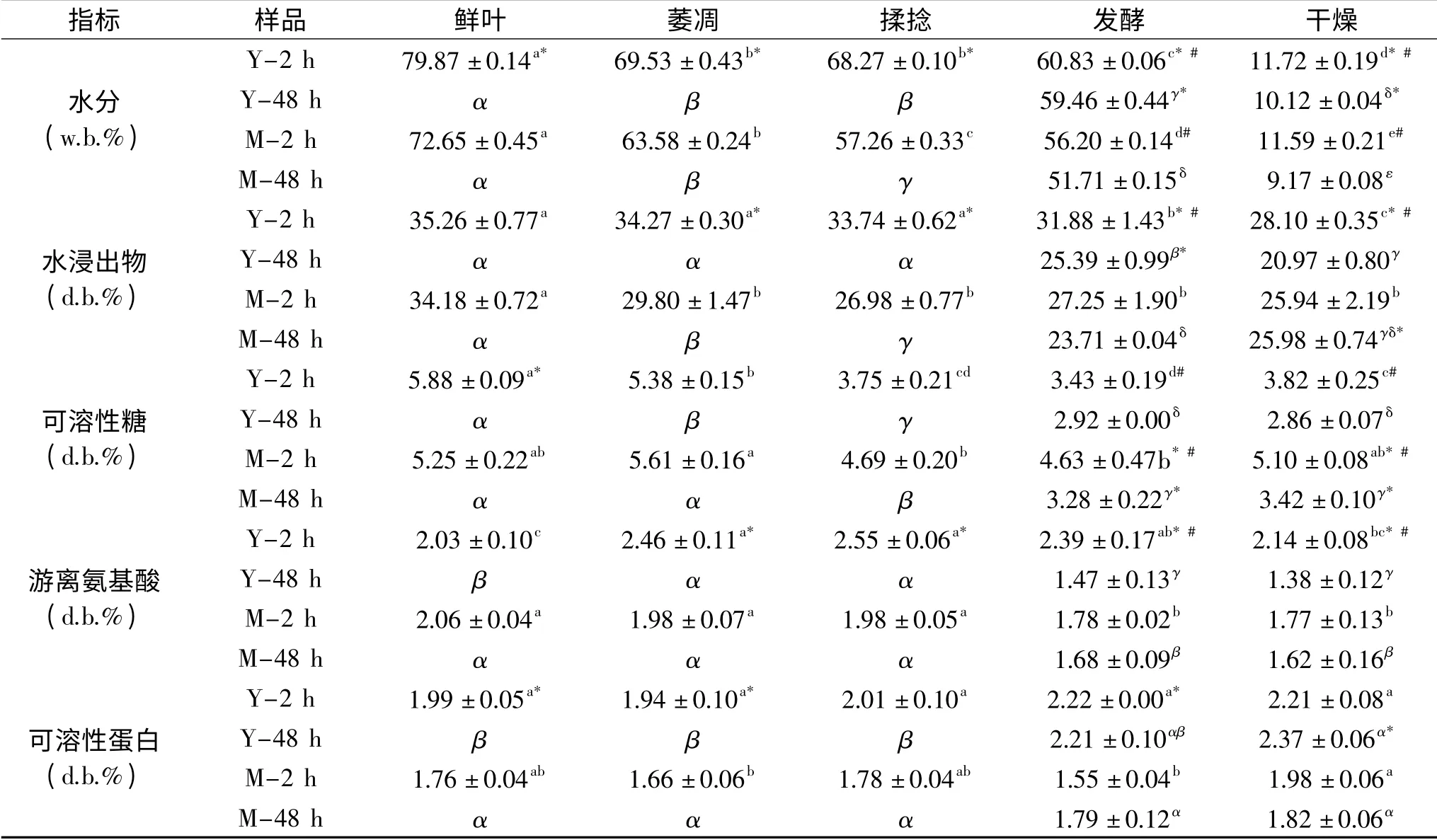
表1 咖啡叶中基础成分含量(%)Table 1 Proximate composition content of coffee leaves(%)
鲜咖啡幼叶和成熟叶的水浸出物含量分别为35.26%和34.18%无显著性差异。咖啡幼叶和成熟叶的水浸出物含量在加工过程中总体上呈下降趋势,可能是由于在加工过程中不可挥发的化合物转化成可挥发的香气物质[15];发生氧化聚合反应与化学聚合反应等,使得可溶性物质转化成不可溶性物质[16],从而使得水浸出物含量降低;在发酵过程中可溶性化合物被微生物代谢消耗等[17]。咖啡叶水浸出物含量受每个加工步骤影响但影响效果不同,发酵和干燥使幼叶水浸出物含量显著下降(P<0.05),但萎凋和揉捻不显著;发酵48 h的成熟叶中水浸出物含量显著降低(P<0.05)。萎凋时咖啡幼叶和成熟叶的水浸出物含量降低,其原因是鲜叶维持生命活动的消耗[18];发酵和干燥过程中,咖啡幼叶的水浸出物含量显著降低(P<0.05),是因为微生物生长消耗了部分水浸出物且酚类化合物与蛋白质反应结合生成不可溶化合物[16]。咖啡叶的年龄显著影响每个加工步骤中的水浸出物的含量,且幼叶水浸出物含量高于成熟叶(发酵48 h除外)。发酵时间显著影响咖啡叶的水浸出物的含量,且对不同叶龄的咖啡叶的影响程度不同。发酵2 h的水浸出物含量高于48 h,因为微生物生长消耗水浸出物[16]。幼叶发酵48 h后水浸出物相对于前一步骤降低了8.35%,而成熟叶水浸出物只降低了3.27%,其原因可能与幼叶中的酶活性高,微生物生长和消耗快有关[19]。
可溶性糖是增加咖啡叶茶茶汤甜味和减少苦涩味的关键,且可溶性糖可以与游离氨基酸产生美拉德反应,是咖啡叶茶香气与风味物质的重要来源。因此,了解各加工步骤中可溶性糖含量的变化规律以及影响可溶性糖含量的关键步骤,对制备出高品质咖啡叶茶至关重要。由表1所示,鲜咖啡幼叶与成熟叶的可溶性糖含量分别为5.88%和5.25%,有显著性差异(P<0.05),可能是随着咖啡叶叶片的成熟,其光合作用不断增强但呼吸速率下降,所以成熟叶中的碳水化合物主要为淀粉[19],因此可溶性糖含量少。在加工过程中,可溶性糖含量因叶龄和加工方法的不同而存在差异。萎凋时咖啡幼叶可溶性糖含量显著降低,成熟叶含量升高,其原因可能为萎凋时淀粉酶活性提高促进淀粉水解[16],使得成熟叶可溶性糖含量升高,而幼叶在多糖水解的同时发生呼吸氧化且呼吸氧化占主导作用[20],因此幼叶中可溶性糖含量降低;揉捻,发酵48 h和干燥过程中咖啡叶可溶性糖含量呈下降趋势,但2 h发酵后干燥的叶子可溶性糖含量升高。发酵2 h后可溶性糖含量显著高于48 h,其原因可能在微生物和酶等作用下,可溶性糖被消耗[21]。
氨基酸是咖啡叶茶香气和滋味的主要来源,是茶良好滋味的主要物质,因此尽量减少因加工造成的游离氨基酸含量的降低是保持咖啡叶茶茶汤鲜味的保障。由表1所示,鲜咖啡幼叶和成熟叶之间氨基酸含量相似,无显著性差异,含量分别为2.03%、2.06%;氨基酸含量在加工过程中的变化趋势与咖啡叶的年龄相关。在咖啡幼叶中,萎凋过程使氨基酸含量显著(P<0.05)增高,相对鲜咖啡幼叶增高0.43%,是原因萎凋时水分减少,蛋白酶酶活升高,使得蛋白质和多肽被水解成氨基酸,而成熟叶萎凋时氨基酸无显著性差异,是因为成熟叶中蛋白酶的活性较幼叶低,因此在萎凋过程中水解生成的氨基酸相对较少,从而氨基酸的含量变化不大[22-23]。揉捻时咖啡叶氨基酸含量升高或保持不变,但在发酵和干燥过程中氨基酸含量下降,其原因是受温度、微生物和酶的影响,氨基酸产生多种反应包括氨基酸热降解、酶促降解、美拉德反应等,导致氨基酸含量降低[24];且加工的步骤对幼叶的影响比成熟叶大,可能是因为幼叶中的酶活性更高,因此受影响更大[25]。发酵时间对氨基酸含量的影响程度与叶龄相关。幼叶中的氨基酸含量在发酵48 h后下降了1.08%,而成熟叶只下降了0.30%,其原因幼叶具有更高的酶活,因此发酵时间越长,微生物分解代谢氨基酸量越多[25]。
由表1所示,鲜咖啡幼叶与成熟叶之间可溶性蛋白含量相似,无显著性差异,含量分别为1.99%,1.76%。咖啡叶中可溶性蛋白含量受每个加工步骤的影响不显著,与鲜咖啡叶比较,上下幅度在0.02%~0.38%之间。萎凋时咖啡叶可溶性蛋白含量略降低,原因为萎凋使得咖啡叶水分减少,细胞液浓度增高,酶活增加,可溶性蛋白被酶解[26];揉捻时含量略升高,可能因为揉捻使细胞破碎,促进可溶性蛋白的溶解[27];干燥过程使得咖啡叶可溶性蛋白含量达到最大值,幼叶与成熟叶的含量分别为2.37%、1.98%,比鲜叶高0.38%、0.22%。由于咖啡叶年龄的不同,在萎凋和发酵过程中,幼叶与成熟叶的蛋白含量存在显著性(P<0.05)差异。发酵时间对咖啡叶可溶性蛋白含量无显著影响。在整个加工过程中,咖啡叶中可溶性蛋白含量变化不显著。
2.2 植物化学成分分析
2.2.1 HPLC定量分析生物碱和多酚 图1(A)为植物化学成分的标准品色谱图,图1(B)为鲜咖啡幼叶的高效液相色谱图,咖啡叶中的植物化学成分的含量在表2中显示。表2为咖啡叶经各加工步骤后植物化学成分包括咖啡因、芒果苷、芦丁、3-CQA、4-CQA、5-CQA、3,4-diCQA、3,5-diCQA的含量。

图1 标准品(A)、鲜咖啡幼叶样品(B)在257 nm的高效液相光谱图Fig.1 HPLC profile at 257 nm of Standard(A)and Fresh young coffee leaf sample(B)
咖啡因又称1,3,7-三甲基黄嘌呤,是一种兴奋剂,具有消除疲劳、促进新陈代谢和兴奋中枢神经系统的作用[28]。有研究表明咖啡因可以预防早产儿支气管肺炎[29]和阿尔茨海默症[30]等疾病。由表2所示,鲜咖啡幼叶中咖啡因的含量(24.65 mg/g)显著(P<0.05)高于成熟叶(10.85 mg/g),其原因为幼叶中的咖啡因合成酶活性高,因此合成的咖啡因含量高[31]。随着叶片的成熟,咖啡浆果生成,叶子中的咖啡因转移到果实中,且咖啡因会缓慢代谢生成黄嘌呤,从而导致成熟叶中咖啡因的含量降低[31]。咖啡叶中咖啡因含量受每个加工步骤的影响程度不同,幼叶在整个加工过程中总体上呈下降趋势,由鲜叶的24.65 mg/g降为发酵2 h(48 h)后的17.13 mg/g(18.33 mg/g),而干燥后其含量又有所上升,其原因为萎凋、揉捻和发酵过程使得咖啡叶水分减少,细胞破碎和微生物繁殖,导致咖啡因合成酶活性低而N-脱甲基酶活性高,减少咖啡因的合成而加快代谢[32];成熟叶中咖啡因含量变化不显著可能是因为咖啡因主要在幼叶中合成[31]。萎凋,揉捻,发酵和干燥加工步骤均因咖啡叶年龄的不同存在显著性差异,且在整个加工流程中咖啡幼叶的咖啡因含量均高于成熟叶,可能是因为鲜咖啡幼叶的咖啡因含量高于成熟叶且幼叶中咖啡因合成酶活性高[31]。
由表2所示,鲜咖啡幼叶和成熟叶芒果苷含量差异显著(P<0.05),含量分别为3.63和0.83 mg/g;芦丁含量差异显著(P<0.05),含量分别为2.09和0.74 mg/g。咖啡叶中芒果苷和芦丁含量受每个加工步骤影响显著。萎凋时咖啡幼叶与成熟叶中芒果苷和芦丁含量显著升高;揉捻时含量显著降低,原因为揉捻破坏细胞,酶与底物接触彻底,发生多酚类化合物的酶促氧化反应[33];发酵时含量显著降低(M-2 h除外),是由于在酶和微生物作用下芒果苷和芦丁被降解[34],而M-2 h时芒果苷和芦丁含量显著升高(P<0.05);干燥时含量升高(M-2 h除外),可能是因为在热作用下,结合多酚转化成游离多酚[31]。由于咖啡幼叶和成熟叶的初始含量显著不同,所以在萎凋,揉捻,发酵和干燥加工步骤中也存在显著性差异。发酵2 h的芒果苷和芦丁含量高于48 h,其原因可能随着发酵时间的延长,多酚类化合物在多酚氧化酶(Polyphenol oxidase,PPO)或过氧化氢酶(Peroxidase,POD)的作用下发生酶促褐变反应,使得芒果苷和芦丁等物质氧化生成醌类化合物,从而含量降低[35]。

表2 咖啡叶植物化学成分含量(mg/g)Table 2 Phytochemical content in coffee leaves(mg/g)
绿原酸(3-CQA,4-CQA,5-CQA,3,4-diCQA,3,5-diCQA)是咖啡叶中重要的酚类化合物但含量相对较少,其中5-CQA含量最高。由表2所示,咖啡叶中绿原酸含量受每个加工步骤的影响总体呈先下降后升高的趋势。萎凋时绿原酸含量降低,原因可能为萎凋使咖啡叶水分降低,酶活升高,绿原酸在PPO或POD酶作用下发生酶促褐变反应氧化生成醌类化合物[35];揉捻时含量降低是因为揉捻过程中细胞破碎,绿原酸与酶充分接触发生酶促褐变反应;发酵时含量总体呈下降趋势,原因为在发酵过程中绿原酸发生酚酶氧化和非酶氧化反应[36];干燥时含量显著(P<0.05)升高是因为在热作用下绿原酸由结合态转化为游离态[37]。鲜咖啡幼叶的绿原酸含量高于成熟叶是因为合成的绿原酸会随着咖啡树的生长转化成木质素,且随着咖啡浆果的生长,绿原酸从咖啡叶中转移到浆果中,从而使成熟叶中的绿原酸含量降低。发酵2 h的绿原酸含量高于48 h,其原因可能随着发酵时间的延长,在酶和微生物作用下绿原酸氧化分解越多,但发酵2 h后干燥样品的绿原酸含量低于48 h,其原因可能为水分的不同导致的。
2.2.2 总酚及总黄酮含量分析 酚类化合物是常见的抗氧化剂[38-39]。如表3所示,鲜咖啡幼叶的TPC含量显著(P<0.05)高于成熟叶,含量分别为40.53,20.69 mg/g,其原因可能随着叶片的成熟,酚类化合物中的绿原酸转化为木质素且转移到浆果中[31]。咖啡叶中TPC含量受每个加工步骤的影响呈波浪式变化。萎凋时咖啡幼叶与成熟叶中TPC含量显著降低,分别为26.75,14.37 mg/g,原因为萎凋过程中咖啡叶水分减少,氧化反应和酶促反应活跃,多酚类化合物在PPO的作用下生成邻醌[40];揉捻时TPC含量显著升高(P<0.05);发酵时TPC含量总体呈下降趋势,原因为在发酵过程中TPC发生酚酶氧化转化为醌类物质[36],但成熟叶发酵2 h呈上升趋势,其原因可能为福林酚法测定总酚含量时受可溶性糖等物质的干扰使得结果偏高[41];干燥时TPC含量显著增高,原因可能为干燥使得水分急剧下降且在热作用下使得咖啡叶中的结合多酚转化为游离多酚[31]。有研究人员证实,幼叶比成熟叶具有更多的酚类化合物[42-43]。咖啡叶的年龄显著影响每个加工步骤中幼叶与成熟叶的TPC含量,除了咖啡幼叶经2 h发酵后干燥的叶子TPC含量低于其相对应的成熟叶外,其它步骤中幼叶的TPC含量都显著高于成熟叶。发酵时间显著影响咖啡叶TPC含量,且对不同年龄的咖啡叶的影响程度不同。咖啡叶发酵2 h的TPC含量显著高于48 h,是因为随着发酵时间的增长,多酚类化合物在PPO酶作用下被氧化[31]。

表3 咖啡叶中总酚和总黄酮含量(mg/g)Table 3 Content of TPCand TFC in coffee leaves(mg/g)
黄酮类化合物也具有一定的抗氧化能力[44],由表3所示,鲜咖啡幼叶总黄酮含量显著(P<0.05)高于成熟叶,含量分别为12.81和7.51 mg/g,其原因为单糖苷和二糖苷以及三糖苷在幼叶中积累,随着叶片的成熟,黄酮醇含量逐渐减少[45],咖啡叶中总黄酮含量受每个加工步骤影响呈波浪式变化但幼叶与成熟叶的变化趋势相反,幼叶呈下降升高下降趋势,成熟叶呈升高下降升高趋势。萎凋时幼叶总黄酮含量降低4.69 mg/g,成熟叶升高0.39 mg/g,其原因可能为萎凋时水分减少使得酶活增加,黄酮醇类化合物在酶作用下降解;揉捻时幼叶总黄酮含量从鲜叶的12.81 mg/g下降为8.82 mg/g,成熟叶从7.51 mg/g下降为5.98 mg/g,其原因可能为揉捻时酶与底物充分接触促使黄酮类物质快速降解[31];发酵时幼叶总黄酮含量显著降低,其原因为在酶作用下,黄酮类化合物被降解[33],而成熟叶含量显著升高可能是因为生成的邻醌等物质抑制了PPO活性。咖啡叶的年龄显著影响揉捻步骤和发酵48 h后的干燥步骤。咖啡叶发酵2 h的总黄酮含量高于48 h,是因为随着发酵时间的增长,黄酮类化合物在相关酶作用下被降解[36]。
2.3 抗氧化活性分析
大量的研究表明植物中的多酚类化合物是很好的抗氧化剂[44-46]。植物中的抗氧化物清除自由基的机制主要包括以下两方面:氢原子转移(HAT)和电子转移(ET)[47],其中ORAC分析法属于前者,而FRAP、DPPH、ABTS分析法则基于电子转移。本文通过ABTS、DPPH、FRAP和ORAC四种方法研究加工咖啡叶抗氧化性能变化。
如表4所示,用四种抗氧化方法测定不同加工步骤咖啡幼叶和成熟叶,因每种方法的原理不同,所得的抗氧化能力存在差异。因为鲜咖啡幼叶中的酚类和黄酮类化合物含量高于成熟叶,所以鲜咖啡幼叶的抗氧化能力显著高于成熟叶。咖啡叶的抗氧化能力在每个加工步骤中因多酚类化合物含量的变化而变化。在萎凋和揉捻的加工步骤中,幼叶的四种抗氧化能力均高于成熟叶,但发酵和干燥过程因方法原理不同呈现出不同的抗氧化能力。萎凋时因酚类和黄酮类化合物的减少,四种方法测定的抗氧化能力均降低,且幼叶高于成熟叶;揉捻时咖啡叶抗氧化能力几乎呈上升趋势但DPPH和FRAP方法中成熟叶的抗氧化能力降低,可能是因为咖啡叶的抗氧化性除了受酚类及黄酮类化合物影响还受其他抗氧化物质的影响,如蛋白和维生素等[48];发酵时四种方法测定的抗氧化能力变化趋势与酚类和黄酮类变化趋势一致;干燥时抗氧化能力升高,其原因为总酚和总黄酮等抗氧化物质含量升高[49]。咖啡叶的年龄影响每个加工步骤中幼叶与成熟叶的抗氧化能力但影响程度不同。咖啡幼叶和成熟叶发酵2 h的抗氧化能力显著高于48 h,与多酚化合物的变化趋势一致。
2.4 基础成分、植物化学成分和抗氧化活性相关性分析
对含有多个变量的大量数据进行主成分分析,可以将高维度的数据进行降维,找到数据中方差最大的主分量,以便找出原始数据中的特征和规律。图2(A)为根据加工步骤和咖啡叶龄对咖啡叶的分值图,Y表示咖啡幼叶,M表示咖啡成熟叶;图2(B)为咖啡叶18个变量的载荷图(水浸出物、可溶性糖、游离氨基酸、可溶性蛋白、咖啡因、芒果苷、芦丁、3-CQA、4-CQA、5-CQA、3,4-diCQA、3,5-diCQA、TPC、TFC、ABTS、ORAC、DPPH、FRAP)。分值图可解析第一和第二主分量中的聚类、趋势以及异常值,荷载图则更直观的解释前两个主分量主要是与哪些变量相关。荷载图中的变量越靠近则越相关,如果在相反的两个反向则负相关,而如果互相垂直则不相关。结果表明,前三个主分量分别占总方差的52.1%、22.8%和10.5%,因此前三个主分量解释85.4%数据变异。通常对于描述目的,只需要解释80%的方差,因此前三个主分量足够解释数据的变异量。分值图显示,咖啡叶的相似性可以根据加工步骤和叶龄分成4组(图2(A)),其中幼叶和老叶发酵48 h为一组(发酵-M-48 h和发酵-Y-48 h);除了幼叶发酵2 h后干燥的样品其它的干燥咖啡叶为一组(干燥-M-2 h,干燥-M-48 h,干燥-Y-48 h);未经发酵的幼叶为一组(鲜叶-Y,萎凋-Y,揉捻-Y);其它咖啡叶为一组。从载荷图和特征系数可以看出第一主分量与咖啡叶的植物化学成分含量和抗氧化性相关,而第二主分量则与基础成分如水浸出物、可溶性糖和游离氨基酸正相关,然而与可溶性蛋白含量却存在弱负相关。未经过发酵和干燥的幼咖啡叶含有较高的游离氨基酸、可溶性糖、游离氨基酸、芦丁、芒果苷、TFC等,而干燥后的样品绿原酸的含量相对较高。发酵48 h的咖啡叶则植物化学成分、抗氧化性和基础成分都相对较低。从主成分分析图可以看出发酵时间的长短以及干燥的过程对咖啡叶的植物化学成分和抗氧化性有较大的影响。
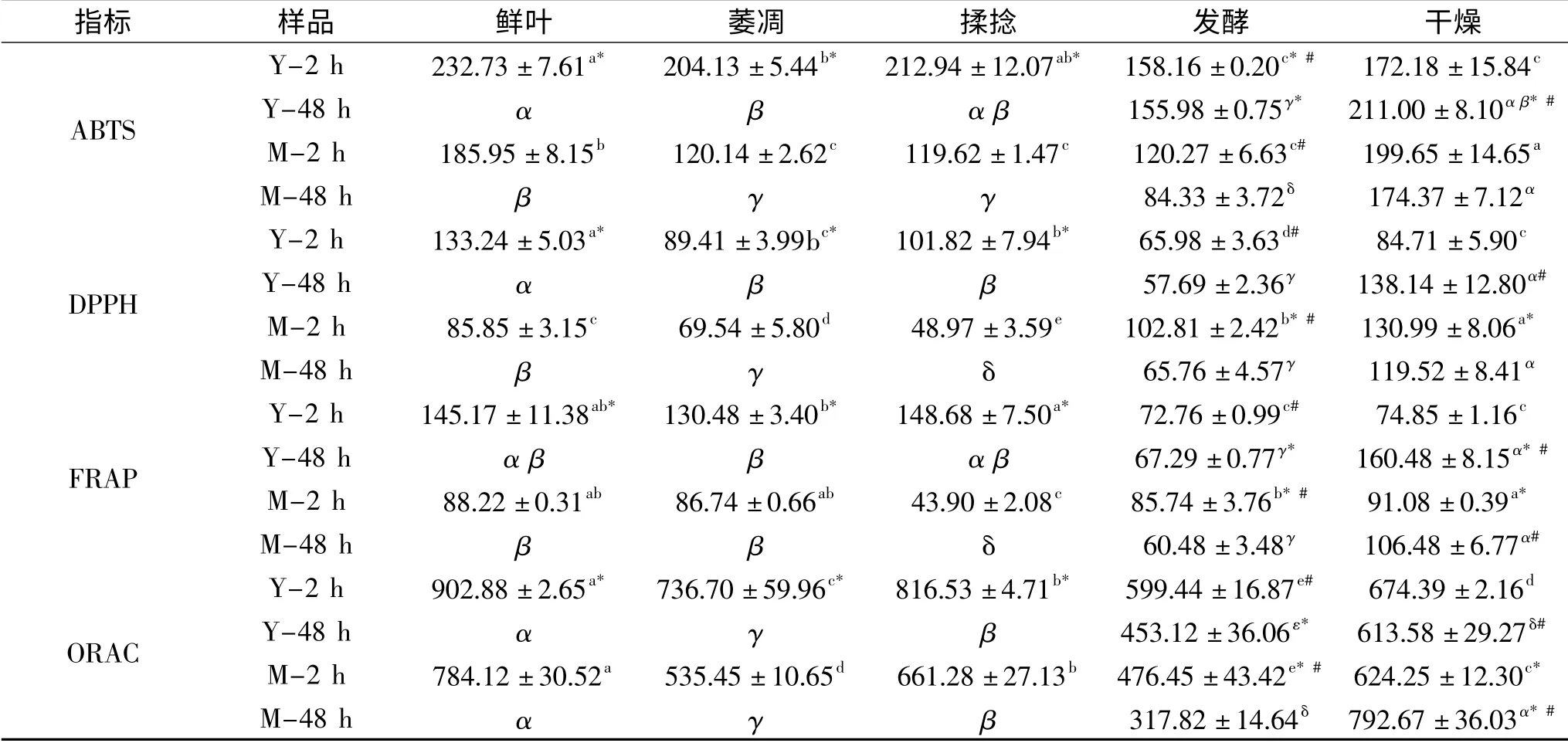
表4 咖啡叶的抗氧化活性(μmol Trolox/g leaf)Table 4 Antioxidant capacities of coffee leaves(μmol Trolox/g leaf)
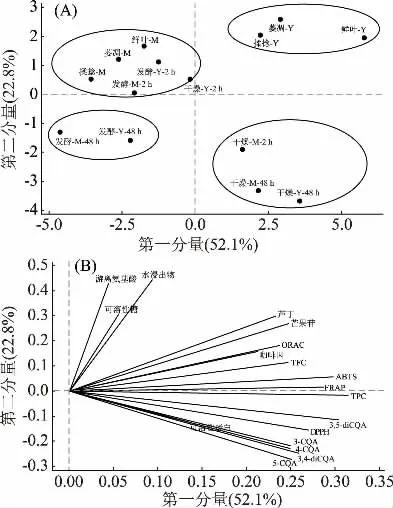
图2 主成分分析Fig.2 Principal component analysis
3 结论
本研究表明鲜咖啡幼叶的水分含量、可溶性糖、可溶性蛋白、咖啡因、多酚类化合物、总酚、总黄酮、抗氧化活性显著(P<0.05)高于成熟咖啡叶,然而水浸出物和游离氨基酸受叶龄的影响并不显著。咖啡叶的基础成分、植物化学成分、抗氧化性在加工过程中的变化受咖啡叶年龄和加工步骤的协同影响。水分含量在加工过程中呈下降趋势,水浸出物、可溶性糖、游离氨基酸和可溶性蛋白含量呈波浪式变化;每个加工步骤对幼叶和成熟叶的影响效果不同;发酵2 h的基础成分含量高于48 h。咖啡叶中的植物化学成分和抗氧化活性在前三个加工步骤中基本上呈下降趋势,然而在干燥后则有所升高。咖啡因含量在幼叶中呈下降趋势,成熟叶中变化不显著,芒果苷和芦丁含量呈先升高后降低再升高趋势,绿原酸含量呈先降低后升高趋势,总酚和总黄酮含量总体呈先降低后升高趋势;与基础成分相同,咖啡叶经2 h发酵的植物化学成分、总酚、总黄酮以及抗氧化活性显著高于发酵48 h的咖啡叶。
发酵步骤是影响咖啡叶的水浸出物、游离氨基酸、可溶性糖、植物化学成分、抗氧化性的关键步骤,发酵时间的延长,上述指标下降地越多。然而,发酵过程对可溶性蛋白的影响并不显著,表明在发酵的过程中咖啡叶的酶和微生物主要利用小分子量的化合物。干燥过程对咖啡叶的植物化学成分和抗氧化活性影响较大,相较于发酵步骤,干燥过程能显著地提高植物化学成分和抗氧化活性。咖啡叶的植物化学成分和抗氧化性与第一主成分相关,而第二主成分则与基础成分的关联较大,且发酵、干燥和叶龄是造成样品差异的主要原因。因此在未来的研究中可侧重研究如何优化发酵过程以保存更多的多酚类化合物以及研究干燥过程如何影响结合和游离多酚的含量以及是否会生成其它具有抗氧化活性的化合物。
