鹿胎肽对巨噬细胞RAW264.7的免疫调节作用
2021-06-22张凯月李春楠王亚苹尹馨雪高晓晨
张凯月,李春楠,兰 梦,王亚苹,尹馨雪,张 辉,高晓晨
(长春中医药大学吉林省人参科学研究院,吉林长春130117)
生物活性肽(Bioactive Peptides,BAP)是指对生物机体的生命活动有益或是具有生理作用的肽类化合物,其分子结构复杂程度不一,含有2~20个氨基酸的特异性蛋白片段,可通过磷酸化、糖基化或酰基化而被修饰[1]。现代研究表明,胎盘中含有多种活性成分,如生物活性肽、免疫球蛋白、氨基酸、矿物质等其他成分,是一种较为理想的免疫调节剂,其作用机制为通过调控巨噬细胞吞噬和抗原递呈功能以及相关细胞因子的表达,从而参与巨噬细胞免疫应答反应[2-3]。巨噬细胞是机体免疫系统的重要细胞之一,具有吞噬、表达相应抗原递呈分子、分泌多种细胞因子等功能,在机体广泛参与清除病原微生物与衰老细胞,发挥免疫调节作用,以维持机体内环境的稳态,在天然免疫中起重要作用[4]。另有研究表明,生物活性肽类成分在免疫调节及抗氧化等方面表现出了重要的生理活性[1]。邓志程等[5]以马氏珠母贝为原料,酶解后经多级分离纯化后得到两种寡肽,通过体外研究发现两种寡肽能明显促进对RAW264.7细胞的吞噬功能,表达其免疫调节作用。
鹿胎为鹿科动物梅花鹿(Cervus nippon Temminck)或马鹿(Cervus elaphus Linnacus)的胎盘和胎兽[6]。近年来的研究表明,鹿胎制剂在抗氧化、免疫调节、抗炎方面表现出良好的活性[7-9]。韩广金等[10]用鹿胎制剂观察大鼠腹腔巨噬细胞吞噬鸡红细胞的现象,证明鹿胎制剂可显著提高大鼠巨噬细胞的吞噬率和吞噬指数。然而对鹿胎中提取的生物活性肽的药理作用研究报道甚少。本实验以鹿胎为原料,通过闪式提取法和超滤的方法制备鹿胎肽,而后根据其对RAW264.7细胞的生长与增殖、细胞形态、吞噬作用、NO分泌和细胞因子分泌及细胞周期的影响,评价其免疫调节作用,以期为鹿胎肽(Deer fetus peptides,DFP)的进一步研究提供实验依据。
1 材料与方法
1.1 材料与仪器
鹿胎 吉林省东鳌鹿业科技开发有限公司;牛血清白蛋白 上海源叶生物科技有限公司;DMEM高糖培养基 美国 Gibco公司;脂多糖(lipopolysaccharides,LPS) 上海源叶生物科技有限公司;噻唑蓝(methyl thiazolyl tetrazolium,MTT) 美国Amresco公司;二甲基亚砜(dimethyl sulfoxide,DMSO)天津市光复精细化工研究所;NO试剂盒、白介素(interleukin,IL)-1β试剂盒、IL-6试剂盒、肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)试剂盒 长春百金生物科技有限公司;中性红细胞增殖及细胞毒性检测试剂盒 碧云天生物技术有限公司;细胞周期检测试剂盒 贝博生物科技有限公司;其余试剂 均为国产分析纯。
HERAEUS HERAcell 150 CO2培养箱 日本三洋公司;Model 680型酶标仪 日本TAKARA公司;CX 23荧光倒置显微镜 日本Olympus公司;JHBE-50T闪式提取器 北京金洋万达科技有限公司;XL90超滤离心机 Beckman公司;GZLY-0.4型药用真空冷冻干燥机 北京速原中天科技有限公司;BD Facscalibur流式细胞仪 美国BD公司。
1.2 实验方法
1.2.1 鹿胎肽的提取及蛋白含量的测定
1.2.1.1 鹿胎的预处理 将鲜鹿胎洗净,绞碎,放置于通风阴暗处阴干,粉碎,过180目筛,即得鹿胎粗粉末。
1.2.1.2 鹿胎肽的提取 取鹿胎粗粉40 g,加入25倍量的水,混匀,用闪式提取器提取10次,每次10 s,所得提取液在3600 r/min下离心10 min,将上清液抽滤,过0.45μm微膜除杂,然后用超滤离心机进行超滤分级,实验选用1、3、10 kDa的超滤膜,将提取液分为总提液、大于10、3~10、1~3 kDa、小于1 k Da五个分子质量段的超滤液分别命名为DFP-1、DFP-2、DFP-3、DFP-4、DFP-5冻干备用。
1.2.1.3 鹿胎肽蛋白含量测定 参考Bradford法测定鹿胎肽的蛋白含量[11-12]。标准曲线的建立:精密称取1.0 mg牛血清白蛋白(BSA)于10 mL容量瓶中,加蒸馏水溶解并定容至刻度。分别取标准液0、0.1、0.2、0.4、0.6、0.8、1.0 mL于干燥试管中,每管补充蒸馏水至1.0 mL。分别加入考马斯亮蓝试剂5 mL,快速涡旋混匀,室温反应5 min,以空白组调零,5~20 min内测定其在595 nm处的吸光度值,绘制标准曲线。
样品测定:将5个样品配制成质量浓度为1 mg/mL溶液,取1 mL加入考马斯亮蓝试剂5 mL,快速涡旋混匀,室温反应5 min,5~20 min内测定其在595 nm处的OD值。
蛋白 质含量(mg/mL)=(Ai-0.0443/6.8665)×Cs
式中:Ai表示样品于595 nm处测得的OD值,Cs表示牛血清白蛋白浓度
1.2.2 鹿胎肽对RAW264.7巨噬细胞增殖作用的影响
1.2.2.1 不同超滤组分对RAW264.7细胞的增殖作用 采用MTT法测定RAW264.7细胞的增殖能力[13-14]。取对数生长期细胞以105个/孔于96孔培养板,每孔150μL,37℃、5%CO2培养箱中培养24 h,待细胞贴壁后,弃去上清液,分别加入100μg/mL的DFP-1、DFP-2、DFP-3、DFP-4、DFP-5溶液150μL,空白对照组为150μL含10%胎牛血清的DMEM高糖培养基,阳性对照组为10μg/mL LPS 150μL,每组5个复孔。在37℃、5%CO2条件下分别培养12、24、48 h,弃去上清液,每孔加入5 mg/mL的MTT 10μL,4 h后加入DMSO 150μL,振荡5 min,于490 nm波长处测其OD值。计算细胞增殖指数[15]。
细胞增殖指数=As/Ac
式中:As表示实验组OD值,Ac表示空白对照组OD值。
1.2.2.2 不同质量浓度DFP-5对RAW264.7细胞的增殖作用 按“1.2.2.1”项下方法,分别加入6.25、12.5、25、50、100、200、400μg/mL的DFP-5溶液150μL,空白对照组为150μL含10%胎牛血清的DMEM高糖培养基,阳性对照组为10μg/mL LPS 150μL,每组5个复孔。在37℃、5%CO2条件下培养24 h,弃掉培养上清液,每孔加入5 mg/mL的MTT 10μL,4 h后加入DMSO 150μL,振荡5 min,于490 nm波长处测其OD值。计算细胞增殖指数。
1.2.2.3 荧光倒置显微镜观察 取对数生长期细胞以105个/孔,每孔2 mL接种于6孔板,37℃、5%CO2培养箱孵育24 h后,吸出培养液,加入质量浓度为12.5、25、50、100、200μg/mL的DFP-5,以LPS(10μg/mL)为阳性对照组,同时设置空白组;孵育24 h后,加入90%DAPI荧光染料染色,室温染色5 min,吸除DAPI染色液,用pH7.2磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2次,用荧光倒置显微镜观察并拍照[16]。
1.2.2.4 中性红吞噬实验 取对数生长期细胞以105个/孔,每孔150μL于96孔板中,37℃、5%CO2培养箱孵育24 h后,弃去培养液,并给予质量浓度为12.5、25、50、100、200μg/mL的DFP-5药物刺激,每组5个复孔,同时设定LPS组和空白组,孵育24 h。吸出上清液,PBS洗涤2次,随后加入200μL细胞培养液,同时加入中性红染液20μL,孵育2 h。除去含有中性红染液的细胞培养液,PBS洗涤1次,于每孔加入中性红检测裂解液200μL,室温摇床上裂解10 min。于540 nm波长处测定OD值,计算细胞吞噬指数[17-18]。
细胞吞噬指数=As/Ac
式中:As表示实验组OD值,Ac表示空白对照组OD值。
1.2.2.5 DFP-5对RAW264.7细胞NO分泌量的影响 将对数生长期RAW264.7细胞接种于96孔培养板,每孔体积200μL,密度为105个/孔,于37℃、5%CO2培养箱中培养24 h,待细胞贴壁后,弃去上清液,分别加入12.5、25、50、100、200μg/mL的DFP-5样品溶液150μL,设置空白组和LPS组,每组5个复孔。于37℃、5%CO2条件下培养24 h后,取上清液150μL,按NO试剂盒说明书测定NO的分泌量。
1.2.2.6 DFP-5对RAW264.7细胞的细胞因子释放的影响 RAW264.7细胞的处理方法同“1.2.2.5”节,在37℃、5%CO2培养箱中培养24 h后,取上清液150μL,按ELISA试剂盒说明书测定各因子IL-1β、IL-6、TNF-α的分泌量。
1.2.2.7 DFP-5对RAW264.7细胞周期的影响 细胞浓度约为105个/mL,每孔2 mL接种于6孔板中,24 h后吸出培养液,分别加入质量浓度为12.5、25、50、100、200μg/mL的DFP-5,同时设置LPS组和空白组,继续孵育,收集样本细胞,细胞数量约为6×106个,用冷PBS洗涤2次,吹散细胞至15 mL离心管中,1000 r/min离心5 min,弃去上清液,用500μL PBS重悬细胞,滴加3 mL 75%冷乙醇,放入-20℃固定1 h,离心,500μL冷PBS重悬细胞,加RnaseA溶液20μL,37℃水浴30 min,离心10 min,弃上清,加入PI染液400μL,轻轻混匀后4℃避光孵育30 min,流式细胞仪检测其结果[19-20]。
1.3 数据处理
2 结果与分析
2.1 鹿胎肽蛋白含量测定
以牛血清白蛋白质量浓度(X)为横坐标,以吸光度OD值(Y)为纵坐标,绘制标准曲线如图1。经公式计算得DFP-1、DFP-2、DFP-3、DFP-4、DFP-5溶液的蛋白含量分别为0.4326、0.2914、0.3160、0.3926、0.3460 mg/mL。

图1 牛血清白蛋白标准曲线Fig.1 Bovine serum albumin standard curve
2.2 不同超滤组分对RAW264.7细胞的增殖作用
从表1中可知,DFP各超滤组分对RAW264.7细胞的增殖均有一定的促进作用;当RAW264.7细胞培养12 h后,DFP-1、DFP-2、DFP-3组分对RAW264.7细胞增殖的促进作用具有显著性差异(P<0.05),DFP-4、DFP-5组分以及LPS组对RAW264.7细胞的促进作用具有极显著性差异(P<0.01)。当RAW264.7细胞培养24、48 h后,5种样品以及LPS组与空白组相比均有极显著性差异(P<0.01),培养时间在24 h时,各组分的增殖能力最强,故后续细胞培养时间均为24 h,且DFP-5组分对RAW264.7细胞的增殖作用与阳性最为接近,因此选择DFP-5做进一步研究。
2.3 不同质量浓度DFP-5对RAW264.7细胞的增殖作用
由图2可知,LPS和DFP-5均能促进RAW264.7细胞的增殖,在质量浓度为6.25~400μg/mL的范围内,RAW264.7细胞的增值指数呈先上升后下降的趋势。当DFP-5质量浓度为12.5、200μg/mL时,对RAW264.7细胞增殖影响显著(P<0.05);当DFP-5质量浓度为25、50、100μg/mL时,对RAW264.7细胞增殖的影响极显著(P<0.01),且25μg/mL质量浓度时增殖指数最大,为1.95±0.09。随着DFP-5质量浓度的继续增加,增殖指数开始骤降,当质量浓度升至400μg/mL时,与空白对照组相比,DFP-5对RAW264.7细胞增殖的影响已无统计学意义(P>0.05),故选择12.5~200μg/mL DFP-5进行免疫调节机制的进一步研究。

图2 不同质量浓度DFP-5对RAW264.7细胞增殖能力的影响(n=5)Fig.2 Effects of different concentrations of DFP-5 on the proliferation of RAW264.7 cells(n=5)
2.4 荧光倒置显微镜观察
由图3可以看出,与空白组相比,不同质量浓度DFP-5与LPS组处理后细胞在数量上发生明显的变化。随着DFP-5从12.5~50μg/mL质量浓度的不断增加,细胞数量也明显增多,但质量浓度为100μg/mL时,数量开始慢慢变少。质量浓度为25μg/mL时,与LPS组数量最为接近。
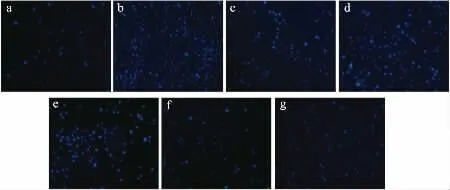
图3 荧光倒置显微镜观察细胞形态(400×)Fig.3 Morphology of RAW264.7 cells observed by fluorescence inverted microscope(400×)
2.5 中性红吞噬实验结果
由图4可得,LPS组和质量浓度为12.5、25、50μg/mL的DFP-5均能极显著增强RAW264.7细胞的吞噬能力(P<0.01),且随着质量浓度的增加,对RAW264.7细胞吞噬能力的刺激作用呈先上升后下降的趋势。当质量浓度增至25μg/mL时,吞噬指数达到1.87±0.12,表明DFP-5能有效激活RAW264.7细胞发挥吞噬作用。
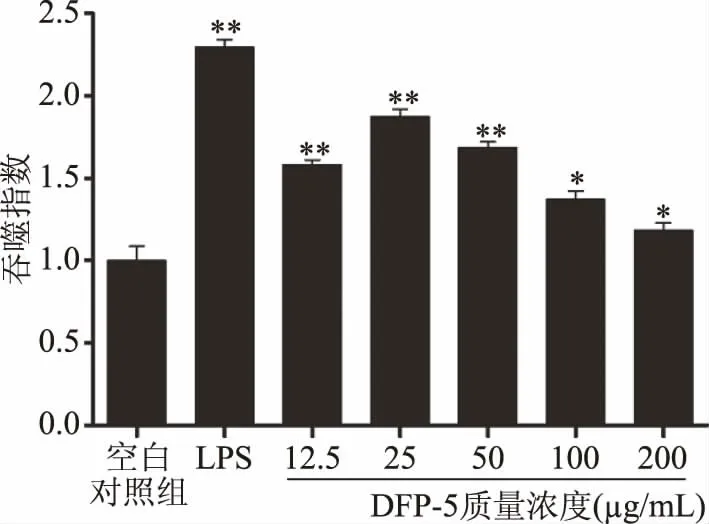
图4 不同质量浓度DFP-5对RAW264.7细胞吞噬能力的影响(n=5)Fig.4 Effects of different concentrations of DFP-5 on the phagocytosis of RAW264.7 cells(n=5)
2.6 DFP-5对RAW264.7细胞NO分泌量的影响
NO作为重要的作为一种重要的信号传导介质,参与多种生理活动和病理过程,其与免疫系统存在密切关系。NO在免疫调节方面具有双重作用,一方面NO是不可或缺的调节因子;另一方面,过量NO会诱导炎性因子的产生,引起炎症,导致组织损伤[21]。试验细胞分泌NO的变化由图5可知,DFP-5对RAW264.7细胞NO分泌量的刺激作用与剂量相关,随着质量浓度的不断增加,NO释放量呈先上升后下降的趋势,其中,DFP-5质量浓度为25μg/mL时,细胞NO的分泌量达最大值,为(21.57±1.80)μmol/L;DFP-5各质量浓度对细胞NO分泌量均具有极显著性差异(P<0.01),但弱于LPS组。试验中DFP-5极显著增加了巨噬细胞释放NO的能力(P<0.01),可以认定为DFP-5是巨噬细胞的免疫调节物质,具有免疫调节活性。

图5 不同质量浓度DFP-5对RAW264.7细胞NO分泌量的影响(n=5)Fig.5 Effects of different concentrations of DFP-5 on NO secretion in RAW264.7 cells(n=5)
2.7 DFP-5对RAW264.7细胞的细胞因子释放的影响
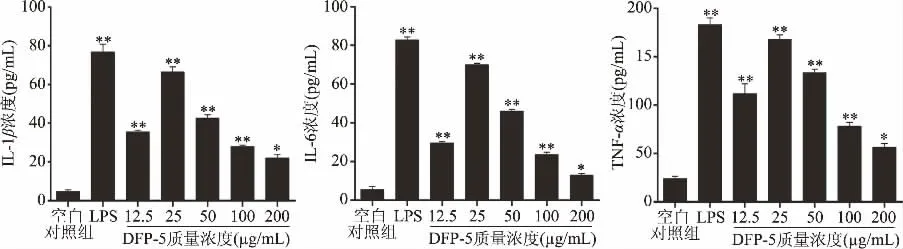
图6 不同质量浓度DFP-5对RAW264.7细胞IL-1β、IL-6、TNF-α分泌量的影响(n=5)Fig.6 Effect of different concentrations of DFP-5 on the secretion of in IL-1β、IL-6、TNF-αin RAW264.7 cells(n=5)

图7 RAW264.7细胞周期的变化Fig.7 Changes in cell cycle of RAW264.7 cells
免疫活性肽具有多方面的生理功能,不仅能增强机体的免疫能力,在动物体内起重要的免疫调节作用;而且还能刺激机体淋巴细胞的增殖和增强巨噬细胞的吞噬能力,提高机体对外界病原物质的抵抗能力[22]。IL-1β、IL-6和TNF-α是介导炎症发生的主要因子,这些炎症因子可以激活免疫细胞而起到免疫调节作用[23-24]。DFP-5对RAW264.7细胞分泌细胞因子的影响由图6所示,DFP-5对RAW264.7细胞中细胞因子分泌量的影响与剂量呈相关性。经25μg/mL DFP-5处理后,细胞因子IL-1β、IL-6和TNF-α的分泌量与空白组相比均有极显著性作用(P<0.01),且其各因子的分泌量最高,趋近于阳性对照组。表明DFP-5可极显著促进各细胞因子分泌(P<0.01),发挥免疫调节作用。
2.8 DFP-5对RAW264.7细胞周期的影响
由图7、图8可知,与空白对照组相比,经DFP-5处理24 h后,G0/G1期的细胞比例呈先上升后下降的趋势,处于S期及G2/M期的细胞与总细胞数中的占比呈先下降后上升的趋势,且比例呈剂量相关性。当DFP-5质量浓度达到25μg/mL时,各时期的变化趋势与LPS组最接近。
3 结论
本实验研究发现DFP-5在体外细胞实验中表现出较强的增殖活性,能够促进RAW264.7巨噬细胞释放NO、IL-1β、IL-6和TNF-α等细胞因子的释放。同时,本研究同时进行细胞周期检查,DFP-5能明显提高G0/G1细胞比例,G0/G1为RNA和蛋白质的合成期,因此相关蛋白的表达量增加,所以吞噬作用、NO及细胞因子的分泌能力在此时期分泌量达最大值。因此,DFP-5可以作为天然免疫调节剂应用到食品及保健品领域中。同时,该项研究也为进一步开发鹿胎生物活性成分提供了理论依据和参考价值。
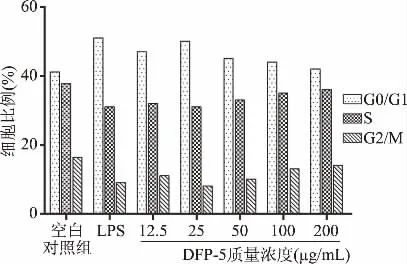
图8 DFP-5对RAW264.7细胞周期的影响Fig.8 Effects of different concentrations of DFP-5 on cell cycle of RAW264.7 cells
