三叶因子3对非小细胞肺癌A549细胞凋亡的影响
2021-06-22张文静宋佳悦赵晓蕊张辰露余鸿杰
张文静,宋佳悦,赵晓蕊,张辰露,余鸿杰,张 静
(河北北方学院形态学实验室,张家口市重点实验室,河北 张家口 075000)
-非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌主要类型,约85%的肺癌为NSCLC,约75%的患者发现时已处于中晚期,预后较差[1]。细胞凋亡是基因控制的程序性细胞死亡,能够有序清除DNA发生损伤的细胞,一旦凋亡减少,可导致不受控制的细胞生长进而发展为肿瘤和肿瘤对药物抵抗[2],凋亡失调被认为是肿瘤的标志之一[3]。有研究表明三叶因子3(trefoil factor 3,TFF3)在多种恶性肿瘤中高表达,过表达TFF3能通过抑制线粒体凋亡途径促进前列腺癌的发展[4],TFF3高表达可以促进宫颈癌细胞的恶性进展[5],敲除人垂体腺瘤HP75细胞中TFF3可以经由线粒体凋亡途径促进细胞凋亡,这些研究表明TFF3能够抑制细胞凋亡,促进细胞生长。通过慢病毒转染构建过表达及沉默TFF3基因A549细胞稳定细胞株,检测细胞凋亡情况及相应凋亡蛋白Bax、Bcl-2及信号通路分子Akt的表达变化,我们探讨了TFF3对人非小细胞肺癌A549细胞凋亡的影响。
1 材料与方法
1.1 材料
人肺癌组织芯片(LC483、LC721)购自西安艾丽娜生物科技有限公司,人非小细胞肺癌A549(SCSP-503)细胞购自中国科学院细胞库。293T细胞、TFF3增强及沉默基因质粒、TFF3 PCR引物由河北北方学院形态学实验室提供[6]。F12K培养基、DMEM培养基、胎牛血清(Gibco),Lenti-PacTM慢病毒包装试剂盒(广州复能基因有限公司),Trizol、FastQuant RT Kit(With gDNase)cDNA第一链合成试剂盒(天根生化科技有限公司),PowerUpTMSYBR®Green Master Mix(Thermo Fisher Scientific)。蛋白提取、BCA蛋白浓度测定试剂盒(北京普利莱基因技术有限公司),小鼠抗人β-actin抗体、羊抗小鼠IgG、羊抗兔IgG、兔抗山羊IgG(康为世纪生物科技有限公司),兔多抗Bcl-2、Bax(武汉博士德生物工程有限公司),羊多抗Akt1/2、兔多抗p-Akt1/2/3(Santa Cruz),兔抗人TFF3抗体(Abcam)。超敏ExPlus ECL化学发光检测试剂盒(北京庄盟国际生物基因科技有限公司)。Annexin V FITC细胞凋亡检测试剂盒(BD),通用型SP9000免疫组化检测试剂盒、DAB显色液(北京中杉金桥生物技术有限公司)。
1.2 方法
1.2.1 免疫组织化学检测肺癌组织芯片TFF3蛋白表达
石蜡切片常规脱蜡至水,枸橼酸盐缓冲液微波热修复,3%H2O2封闭10 min;滴加兔抗人TFF3抗体,4℃孵育过夜;PBS清洗后滴加羊抗兔IgG,37℃孵育30min;DAB显色,苏木精复染细胞核,树胶封片,显微镜(Image M2,ZEISS,德国)观察胞浆显示棕黄色为阳性细胞。染色结果按照染色强度和阳性细胞率采用半定量积分法计分[7]:①无着色:0分,浅黄色:1分,棕黄色:2分,黄褐色:3分;②阳性细胞率:阳性细胞<5%计0分,5%~25%计1分,>25%~50%计2分,>50%计3分。两者之和为该组织评分值,≤2分为阴性(-),3~4分为阳性(+),5~6分为强阳性(++)病例。各组阳性病例(+~++)与总病例数之比即该指标的表达阳性率。
1.2.2 慢病毒包装质粒转染A549细胞
293T细胞培养于含10%胎牛血清的DMEM培养基内,A549细胞培养于含10%胎牛血清的F12K培养基内,37 ℃,5%CO2细胞培养箱内培养。
慢病毒包装前一天,293T细胞按照1×105个/孔接种于24孔板内,达到70%~80%融合率时进行实验。细胞分4组:分别为A549-TFF3(过表达TFF3组,转染TFF3基因ORF序列)、A549-Vec(过表达对照组)、A549-shTFF3(沉默TFF3组,转染TFF3小发卡RNA质粒)、A549-shCK(沉默TFF3对照组)。将TFF3基因ORF(TFF3)及对照(Vec)、沉默TFF3(shTFF3)及对照(shCK)、eGFP阳性对照5组慢病毒表达载体的质粒分别与LentiPac混合包装质粒、EndoFectin Lenti转染试剂及培养基按照说明书制备DNA-EndoFectin转染复合物并加入孔板中,孵箱中培养12 h后,去除含有转染复合物的旧培养液,每孔添加500 μL含5%胎牛血清、青链霉素的DMEM培养液,并加入1 μL TiterBoost增强剂,继续培养36 h后收集细胞培养液,500×g离心10 min后吸取上清获得慢病毒液,以慢病毒液与培养基1∶3比例转染前一天于24孔板铺好的A549细胞(1×105个/孔)中过夜,第二天去除慢病毒液加入F12K全培养基,48 h后即可见eGFP阳性对照质粒转染细胞出现绿色荧光,再培养48 h后加入含2μg·mL-1嘌呤霉素的F12K培养基进行筛选,每隔两天换液,2周后获得稳转细胞株,并通过实时荧光PCR和Western blot验证TFF3 mRNA及蛋白的表达水平。
1.2.3 实时荧光定量PCR法检测TFF3基因的表达水平
胰酶消化A549-TFF3、A549-Vec、A549-shTFF3、A549-shCK 4组细胞,Trizol法提取总RNA,Nanodrop微量核酸蛋白浓度测定仪(Thermo Fisher,美国)测定RNA浓度,按照1 μg总RNA反转录为cDNA,而后进行实时荧光PCR反应(ABI7300实时荧光定量PCR仪,美国),总体系10 μL,含cDNA(原液1∶10稀释)1 μL,上下游引物各0.5 μL,PCR Mix:5 μL,ddH2O:3 μL。按试剂盒说明书设定程序,实验结果采用2-ΔΔCT方法计算mRNA相对表达量。
1.2.4 Western blot检测目的蛋白
按照说明书对4株细胞进行蛋白裂解和抽提,获得蛋白膜,视蛋白膜厚度加入200~500 μL 2% SDS,金属浴95℃溶解,BCA法测定蛋白浓度,计算含30μg蛋白的上样量,并与4×loading buffer、ddH2O制备10 μL上样混合液。配制12% SDS-PAGE凝胶,进行电泳和转膜。一抗β-actin(1∶3000)、TFF3(1∶1000)、Bcl-2(1∶200)、Bax(1∶200)、Akt(1∶1000)、p-Akt(1∶1000)4℃孵育过夜,第二天孵育二抗(1∶5000)室温下摇床1 h,膜上滴加ECL发光显色液,通过OmegaLum W(Aplegen,美国)化学发光凝胶成像系统进行观察和拍照。Image J分析蛋白条带灰度值,以目的蛋白/β-actin比值表示该蛋白的表达水平。
1.2.5 流式细胞术检测4组细胞凋亡率
用不含EDTA胰酶消化细胞后收集细胞,冷PBS清洗2次,1×Binding buffer重悬细胞(1×106个/mL),吸取100 μL溶液(1×105个/mL)至EP管,加5 μL FITC Annexin V和5 μL PI,轻轻涡悬,避光室温孵育15 min,加400 μL 1×Binding buffer,流式细胞仪(NovoCyte 2040R,ACEA/美国)检测分析。
1.3 统计学方法
2 结 果
2.1 组织芯片TFF3免疫组化结果
组织芯片中共含有31例肺腺癌、21例肺鳞癌、10例正常肺组织,TFF3阳性产物为棕黄色,主要表达于胞质。TFF3阳性肺腺癌细胞沿肺泡壁生长,异型性明显,呈乳头状、腺泡状生长(图1A);肺鳞癌中可见TFF3阳性蛋白强表达于癌巢细胞胞质中,细胞呈梭形,角化珠周边细胞阳性表达较强(图1B);正常肺组织的肺泡上皮细胞TFF3呈弱阳性反应(图1C)。TFF3在腺癌和鳞癌中的阳性表达率均高于正常组(P<0.05)(表1)。TFF3在III级腺癌表达阳性率高于Ⅰ~Ⅱ级(P<0.05),有淋巴结转移的肺腺癌组织中TFF3阳性表达率高于无淋巴结转移的肺腺癌组织(P<0.01)(表2);TFF3阳性表达率在III级鳞癌组织中高于Ⅰ~Ⅱ级(P<0.05),有淋巴结转移的鳞癌组织中高于无淋巴结转移组织,差异具有统计学意义(P<0.01)(表2)。

图1 TFF3在肺腺癌、肺鳞癌、正常肺组织中的表达(IHC,bar=100 μm)
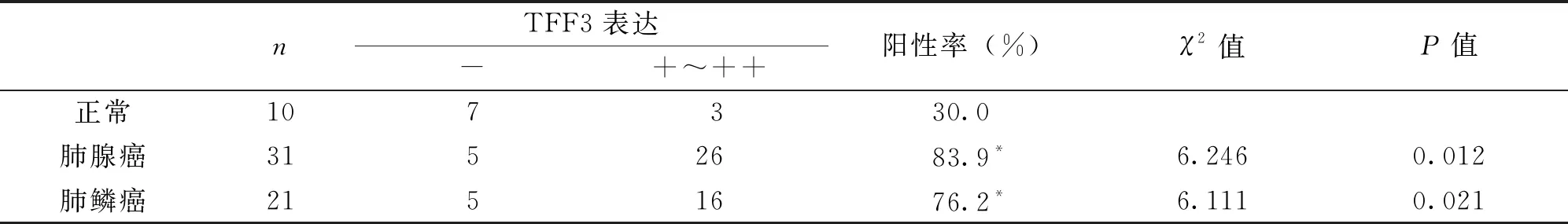
表1 TFF3在肺腺癌、鳞癌、正常肺组织中的阳性表达
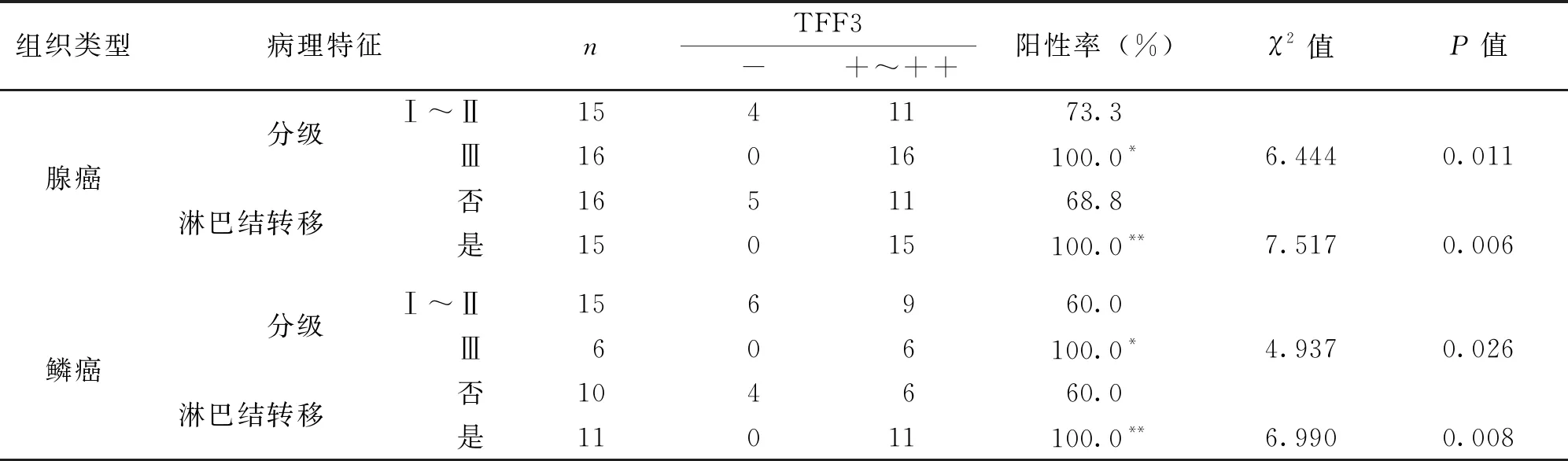
表2 TFF3阳性表达与肺腺癌、鳞癌病理特征关系
2.2 获得稳定转染过表达及沉默TFF3基因的A549细胞
实验组慢病毒表达载体均不表达荧光蛋白,因此通过eGFP阳性对照观察转染效果。所有质粒均含嘌呤霉素抗性基因,经含2μg·mL-1嘌呤霉素的培养基筛选7 d后eGFP对照组细胞90%以上为绿色荧光(图2),再培养7 d后对培养的4组细胞进行real-time PCR及Western blot实验检测TFF3基因及蛋白表达水平(图3、表3)。结果显示A549-TFF3细胞TFF3 mRNA和蛋白水平均较对照组显著增高(P<0.01),shTFF3细胞株中TFF3 mRNA沉默效率约为75%,TFF3基因及蛋白水平较对照组明显降低(P<0.01)。

图2 eGFP阳性对照组A549细胞白光视野(A)与荧光视野(B)bar=100 μm(圆圈为同一细胞)

图3 Western blot验证TFF3蛋白表达水平
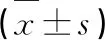
表3 慢病毒转染A549细胞后TFF3 mRNA 及蛋白表达水平
2.3 Bcl-2、Bax、Akt、p-Akt在过表达及沉默TFF3基因A549细胞中的表达变化
Western blot结果显示(图4、表4):TFF3过表达A549细胞(A549-TFF3)中Bcl-2/Bax、p-Akt、p-Akt/Akt表达水平显著高于对照组(P<0.01),Akt表达水平高于对照组(P<0.05);沉默TFF3表达的A549细胞(A549-shTFF3)中,Bcl-2/Bax、p-Akt表达水平显著低于对照组(P<0.01),p-Akt/Akt表达水平低于对照组(P<0.05),Akt表达水平与对照组相比差异无统计学意义(P>0.05)。

图4 TFF3对A549细胞Bcl-2、Bax、Akt、p-Akt表达水平的影响
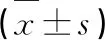
表4 Western blot检测目的蛋白相对表达量
3.4 流式细胞术检测细胞凋亡结果
以Q2-2(晚期凋亡)+Q2-4(早期凋亡)百分比之和为细胞总凋亡率(图5)。

图5 流式细胞术检测细胞凋亡结果
结果显示(表5):过表达TFF3慢转染组(A549-TFF3)细胞凋亡率显著低于对照组(A549-Vec)(P<0.01),沉默TFF3慢转染组A549细胞凋亡率显著高于对照组(A549-shCK)(P<0.01)。
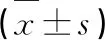
表5 流式细胞术检测细胞凋亡率比较
3 讨 论
非小细胞肺癌(85%)和小细胞肺癌(15%)是肺癌的两种主要形式,尽管早期诊断和标准化治疗取得了一定进展,但非小细胞肺癌确诊时常已处于晚期且预后较差[3]。
TFF3是由59个氨基酸残基组成的一种调节蛋白,研究表明TFF3在人多种恶性肿瘤的发生、增殖、分化、迁移、侵袭和凋亡中发挥重要作用[8],敲除TFF3除了能够抑制肿瘤细胞增殖、迁移和侵袭,还能明显提高肿瘤细胞对放、化疗的敏感性[9]。研究发现,TFF3在肺鳞癌、肺腺癌、小细胞肺癌患者血清、肺组织及肺癌细胞系中高表达,可作为肺癌血清学检测指标[10]。本研究通过免疫组化检测TFF3在肺癌组织芯片中的表达水平,结果提示TFF3在两种主要非小细胞肺癌(肺腺癌和肺鳞癌)组织中高表达,在Ⅲ级、有淋巴结转移的肺癌组织中阳性表达率高于Ⅰ~Ⅱ级、无淋巴结的肺癌组织。
本研究进一步通过慢病毒转染过表达及沉默TFF3基因的非小细胞肺癌A549细胞探究TFF3对肺癌细胞凋亡的影响。结果显示过表达TFF3的A549细胞Bcl-2/Bax明显高于对照组,提示A549-TFF3细胞凋亡能力减弱,更易于增殖,与细胞恶性增生密切相关;而沉默TFF3基因A549细胞Bcl-2/Bax比值降低,肿瘤细胞抗凋亡能力减弱。过表达TFF3具有抑制非小细胞肺癌细胞凋亡的能力在流式细胞检测结果中也有体现,过表达TFF3的A549细胞凋亡率较低(P<0.01),而沉默TFF3的A549细胞凋亡率明显增高(P<0.01)。磷脂酰肌3-激酶(PI3K)/Akt途径是癌细胞活化的重要细胞内途径。
Bcl-2和Bax是线粒体凋亡途径的重要蛋白,都属于Bcl-2家族,Bcl-2是抑制细胞凋亡的细胞内蛋白,过度表达可能诱发恶性肿瘤克隆性增殖[11],Bax可抑制肿瘤细胞增殖,并可易位至线粒体,破坏线粒体膜的完整性,使细胞易于凋亡,TFF3能够调节这些与细胞凋亡相关的关键因子的表达,上调Bcl-2抗凋亡效果,而抑制促凋亡蛋白Bax的活性[8]。Bcl-2和Bax的相对比率[12]决定了细胞的凋亡状态,慢性淋巴细胞性白血病中Bcl-2/Bax升高[13]。一些研究为TFF3激活Akt提供了依据,Akt激活存在于稳定表达TFF3细胞中[14-15],TFF3可以通过EGFR激活下游的Akt信号通路,Akt的Thr308和Ser473磷酸化后而完全激活,介导下游信号传导,引起细胞的抗凋亡等生物学效应[16]。研究表明Akt通过cAMP反应元件结合蛋白(CREB)转录上调Bcl-2表达[17],磷酸化(P-Akt)表达上调可促进Bcl-2表达,下调Bax表达,抑制阿霉素诱导的胃癌细胞凋亡[18]。本研究中Western blot结果显示总Akt表达水平变化不明显,而p-Akt、p-Akt/Akt在过表达TFF3的A549细胞表达水平较高,在A549-shTFF3中表达水平降低,与Bcl-2/Bax比值变化一致,提示TFF3在非小细胞肺癌细胞中可以通过Akt信号通路激活增强细胞的抗凋亡能力,促进细胞恶性增殖,TFF3有可能成为非小细胞肺癌的有效生物标记物。
