环境胁迫调控植物乳杆菌细菌素合成的研究进展
2021-06-21赵鹏昊孟祥晨
赵 乐,赵鹏昊,孟祥晨
(东北农业大学,乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
植物乳杆菌(Lactobacillus plantarum)是食品发酵技术中使用最为广泛的乳杆菌之一,已被证实有能力在人类和其他哺乳动物的肠道中定植[1],并具有良好的代谢和耐酸能力[2]。植物乳杆菌具有调节人体免疫[3]、抵制胃肠道致病菌感染的功效[4],同时其对肠上皮细胞具有较好的黏附能力,在强酸和高浓度胆盐下仍具有较高存活率[5],且其代谢过程中会产生细菌素等无毒副作用和耐药性的次级代谢产物[6]。细菌素是由核糖体合成并分泌至胞外介质的具备生物活性的多肽,当其达到一定浓度时可抑制亲缘关系相近的致病菌或腐败菌的生长[7],它们对热稳定且易被蛋白酶水解,因此细菌素作为生物防腐剂广泛应用于各种发酵食品[8]。
植物乳杆菌可以在食品基质中的热、冷、酸、盐等应激条件下存活,这表明它对于复杂恶劣环境已经形成了耐受性和抗性机制。国内外学者对植物乳杆菌在环境胁迫下的应激机制主要从分子机制和蛋白质组学角度进行研究,尽管一些应激基因已经在这个物种中被鉴定出来[9],但是对其转录调控机制仍然知之甚少。有研究表明环境胁迫可以正向调控细菌素的合成,Leroy 等[10]研究了不同环境胁迫对Enterococcus faeciumRZSC5 产生细菌素的调控作用,研究发现中等盐浓度能够促进细菌素的分泌。Hurtado 等[11]研究了Lactobacillus pentosusB96 在盐胁迫下细菌素编码基因表达的变化,研究表明4%和6%浓度的盐胁迫可以促进细菌素的生物合成,plnE和plnN基因的表达受胁迫影响显著上调,但其并未深入研究盐胁迫如何调控细菌素的合成。乳酸菌细菌素虽然具备无毒、高效抑菌等优点,但产量较低,在工业化批量生产中大大受限。
目前利用基因工程技术提高细菌素产量虽理论上可行,但普遍存在细菌素活性较低及安全问题。而环境胁迫对细菌素的调控是基于转录水平上的调节,并不涉及安全性问题。由于环境胁迫调控细菌素合成的机制较为复杂,调控因子及调控通路尚不明确,通过施加环境压力提升菌体细菌素合成量的方法依然难以投入到实际应用中。因此完善关于环境胁迫对细菌素合成的分子调控机制的研究,对促进生物保护发酵剂的发展有着重要意义。
1 植物乳杆菌细菌素合成的分子调控机制
1.1 Al-2 介导的群体感应系统
群体感应(quorum sensing,QS)是指细菌感应外界环境刺激,分泌自诱导物或自诱导多肽作为信号分子,当其浓度达到一定阈值时会启动菌体某些功能性基因的表达进而影响菌体生命活动,如调控细菌素的合成及分泌[12]。Saucier 等[13]在Carnobacterium piscicolaLV17 中首次发现乳酸菌存在群体感应现象。少数Ⅰ类和多数Ⅱ类细菌素的生物合成受QS 系统调控。调节Ⅱ类细菌素产生的QS 系统由自诱导肽(auto-inducing peptide,AIP)、监测环境的膜定位组氨酸蛋白激酶(histidine protein kinase,HPK)以及细胞质感应调节蛋白(response regulator,RR)等3 种调控蛋白组成,被称为三组分系统,其中HPK和RR 也被称为双组份系统(two component system,TCS)[14]。Al-2 以具备生物活性的信号分子身份参与QS 信息交流进程,从分子结构层面来看,Al-2 是一种呋喃酰硼酸二酯类化合物[15]。它由luxS基因编码的关键酶催化S-核糖高半胱氨酸(SRH)生成,其中SRH 是通过pfs基因编码合成酶催化S-腺苷高半胱氨酸(SAH)而形成的。植物乳杆菌与其他诱导菌共培养时细菌素也会被诱导进而杀死或抑制其它微生物。Di 等[16]研究发现共培养后L.plantarumDC400 细菌素的合成量显著上升,luxS基因表达量也较纯培养显著提升,由此推断luxS介导的群体感应系统间接调控植物乳杆菌细菌素的合成。Man等[17]研究发现L.plantarumKLDS1.0391 与瑞士乳杆菌KLDS1.9207 共培养时,编码细菌素的pln基因簇相关基因的表达显著上调。与此同时,Ruiz-Barba等[18]研究发现,L.plantarumNC8 与戊糖片球菌FBB63 等革兰氏阳性菌共培养时,L.plantarumNC8 细菌素调节基因转录效率有所上升。综上表明,细菌素产量的提高可能是微生物的存在刺激生产者生长的结果,也可能是自诱导物Al-2 产量增加的结果。
1.2 植物乳杆菌pln 基因簇
植物乳杆菌细菌素调控系统除上述提到的Al-2 介导的群体感应系统以外,还受基因组中pln基因簇的调控。Saenz 等[19]证实了L.plantarumC11、WCFS1、J51、YM-4-3 中均含有5 个诱导操纵子:分别是plnABCD、plnJKLR、plnEFI、plnGHSTUVW、plnMNOP。各诱导操纵子的具体功能如下:负责编码群体感应系统并可启动其他操纵子转录起始的调节操纵子plnABCD,其中plnA编码自诱导肽(AIP),plnB编码可跨膜的组氨酸激酶(HPK),plnC和plnD编码两种功能相反的反应调节因子[20],plnC编码的蛋白激活基因簇转录,plnD编码的蛋白则起抑制作用;编码细菌素结构基因的plnJKLR和plnEFI,其中PlnI 及PlnL 为abi基因编码免疫蛋白;编码ABC 转运系统并参与细菌素分泌运输的运输操纵子plnGHSTUVW;plnMNOP等功能还未可知。Diep等[21]认为plnEFI和plnJKLR操纵子编码双肽细菌素、PlnEF 和PlnJK 及其相应的免疫蛋白。plnGHSTUVWXY操纵子编码ABC 转运系统的蛋白质,该系统负责分泌并处理细菌素前体。2003 年,Diep 等[22]进一步验证了PlnA 肽诱导上述五个操纵子的转录的同时,自身也是一种抑菌物质。Maldonado-Barragan 等[23]通过基因敲除实验验证了L.plantarumWCFS1 中的plnABCD以及L.plantarumNC8 中的plnNC8IF-HK-D对细菌素的合成至关重要。Tai 等[24]对L.plantarumWCFS1、C11、V90、J23、J51、NC8、JDM1、UL4 的pln基因簇进行了总结(图1)。
2 植物乳杆菌抵御胁迫的反应机制
2.1 植物乳杆菌面临的环境胁迫
利用植物乳杆菌产细菌素的特性提高食品安全性是食品防腐保鲜的一种手段,但无论是在加工运输中还是摄入体内发挥其益生效应均会面临诸多胁迫(图2)。在菌体生长、存储保藏、经过人体肠胃道等过程中,菌体自身会受酸、冷冻、高温、盐、饥饿等胁迫作用而损伤甚至死亡。例如人体胃肠道的低pH 环境或食品加工基质中遇到的酸胁迫,会导致胞内质子积累同时降低跨膜推动力,进而降低对酸敏感的酶活性,也会损害蛋白质和DNA 等生物大分子;作为发酵剂在加工贮存中遇到的低温环境不仅会减弱细胞膜流动性,还会影响基因表达使菌体产生冷休克反应,相反,环境温度过高又会致使蛋白降解;细菌代谢过程产生的活性氧(ROS)、超氧阴离子(O2-)、过氧化氢(H2O2)以及过氧化自由基(O·)等物质会使菌体细胞受损[25];细菌繁殖过程中,若营养物质得不到及时补充,便会引发营养胁迫现象,导致代谢能力大大降低,如细菌素等代谢产物合成量降低。
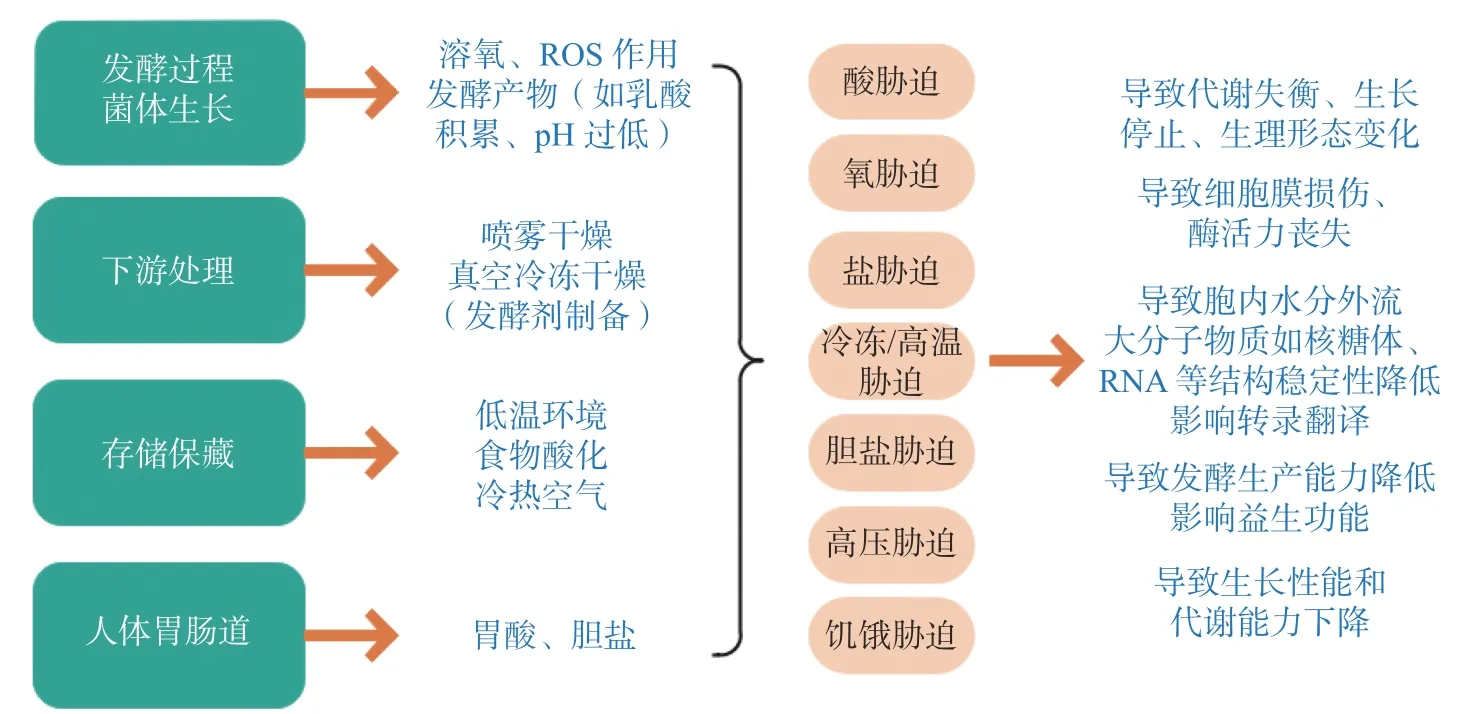
图2 植物乳杆菌面临的环境胁迫Fig.2 Environmental stress encountered by Lactobacillus Plantarum
2.2 植物乳杆菌抵御盐胁迫的调控机制
植物乳杆菌抵御盐胁迫通常依靠相容性溶质调控系统、胞内离子平衡、热休克蛋白调控系统及其他途径关键酶调控系统。在高渗透压条件下,植物乳杆菌主要通过从细胞外部吸收甘氨酸甜菜碱(glycine betaine,GB)等相容性溶质来抵御盐胁迫[26]。其中L.plantarum主要采取QacT 系统转运相似相容类物质[27],有研究指出L.plantarumATCC14917 依靠QacT 系统转运甜菜碱、肉碱和脯氨酸[28],而L.plantarumWCFS1 拥有两个相容性溶质转运系统,即ChoQS、OpuABCD[29]。植物乳杆菌还可以利用质膜上的Na+/H+逆向转运蛋白将胞内Na+外排,进而维持胞内离子平衡[30]。此外,有研究报道指出L.plantarumST-III 中存在编码Na+/H+逆向转运蛋白的基因[31]。近期还有学者发现,L.plantarumSTIII 的质粒上包含一个由kdpABCDE操纵子编码的K+转运基因簇[32]。另一方面,当菌体外部渗透压升高时,编码普遍应激蛋白(GSPs)、热激蛋白(HSPs)和盐胁迫蛋白(SSPs)的基因表达量会显著上升。HSPs 作为分子伴侣蛋白通常包括DnaK、GroEL、DnaJ 和GroES,在蛋白折叠修复和降解中起到关键作用[33]。也有研究发现,胞内蛋白FtsH 和细胞看家蛋白HtrA 在盐胁迫下表达上调。糖酵解途径是植物乳杆菌生成乳酸的重要途径,有学者指出糖酵解关键酶基因pfk、fba、pgk、ldh的表达也会随 着NaCl 浓度的升高而上调。盐胁迫也可以诱导腺苷酸琥珀酸合酶PurA 的合成,有研究发现参与嘌呤代谢的PurH 蛋白在5 mol/L NaCl 胁迫下表达上调。这些关键酶数量的增加可以使核苷酸积累用于DNA、RNA 和ATP 的合成,维持菌体正常生长代谢。
2.3 植物乳杆菌抵御酸胁迫的调控机制
植物乳杆菌可以通过调控胞内pH 动态平衡、改变细胞膜生理功能以及分泌抗胁迫应激蛋白等方式来应对发酵过程中所产有机酸带来的酸胁迫。胞内pH 的动态平衡对于L.plantarum抵御酸胁迫至关重要,乳酸菌能够通过H+-ATPase、谷氨酸脱氢酶体系,精氨酸脱羧酶途径等机制维持胞内pH 的动态平衡(图3)[34]。当胞内pH 处于菌体能耐受的范围外时,F0F1-ATPase 聚合体会消耗胞内ATP,将胞内水解产物H+泵出至胞外,以维持胞内pH 的稳定。此外,菌体的精氨酸脱氨酶体系可以通过催化精氨酸产生NH3,随后胞内H+与产物NH3结合,从而使pH 升高至正常范围,此过程产生的ATP 有助于F0F1-ATPase泵出质子。细胞膜的结构成分在抵御酸胁迫的过程中也起到关键作用,如调整膜脂肪酸中的长链脂肪酸和单不饱和脂肪酸的比例。有研究尝试阐明植物乳杆菌的耐酸机制,Liu 等[35]认为植物乳杆菌SA-680 包含一个耐酸基因mdt,其序列与多种植物乳杆菌膜转运蛋白基因编码区序列很接近,猜测基因mdt可能与质子流动有关。
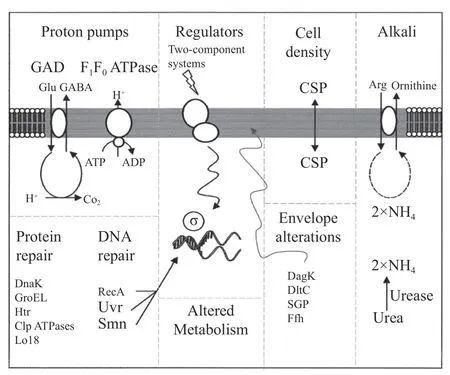
图3 革兰氏阳性细菌的耐酸机制[34]Fig.3 Acid resistance mechanism of gram-positive bacteria[34]
2.4 植物乳杆菌抵御冷热胁迫的调控机制
植物乳杆菌作为冷冻发酵剂在储存过程中、干酪成熟阶段及冷藏产品的低温发酵阶段会引发大量的冷诱导蛋白(Cold Induced Proteins,CIP)表达。Derzelle 等[36]从受到冷胁迫的植物乳杆菌Lp80 和C3.8 中分别克隆出cspL和cspP两种冷休克蛋白基因。此外,工业生产中喷雾干燥、巴斯德灭菌等高温过程带来的热应激会导致DnaK、DnaJ、HrcA、GroES、GroEL、Hsp84、Hsp85、Hsp100、C1p、HtrA 和FtsH 等热休克蛋白和蛋白酶表达上调。Castaldo 等[37]研究发现,L.plantarumLM3-2 含有以cis 启动的CIRCE 序列为特征的DnaK 和GroESL热激操纵子。刘倩颖[38]通过KEGG 通路富集结果分析出L.plantarumLIP-1 在冷胁迫下嘌呤代谢通路最显著,冷应激蛋白CspC 的表达显著上调。
2.5 植物乳杆菌抵御氧胁迫的调控机制
植物乳杆菌的呼吸代谢产物活性氧(ROS),包括超氧阴离子自由基(O2-),过氧化氢(H2O2)和羟自由基(OH-)等,这类物质会打破胞内的氧化还原平衡进而促使ROS 浓度升高进而造成氧胁迫。乳酸菌抵御氧胁迫多依赖于SOD、CAT 和GSH-PX 等ROS解毒酶类。Eric 等[39]发现在L.plantarum中,两个谷胱甘肽还原酶同源物可以有效降低由胆盐胁迫引起的氧化损伤。与此同时,过氧化物响应调控因子PerR、氧气响应转录调节子FNR 以及Rex 类转录因子在抵抗氧化胁迫和生物膜形成方面也有重要调控作用。另一方面,FlpA 和FlpB 通过上调Zn2+的摄取来增加菌体对胞内巯基蛋白的保护从而提高菌体氧化胁迫抗性。此外,有研究为阐明L.plantarumCAUH2 的抗氧化胁迫机制,采用转录组学进行分析,结果表明转录因子GopR 具有抗氧化功能。
3 环境胁迫对植物乳杆菌细菌素合成量的影响
不同植物乳杆菌菌株由于自身的差异性,面对不同胁迫时其细菌素的合成能力存在较大差异。食品基质中的低温、低pH 和高NaCl 等胁迫因素会影响乳酸菌的生长和细菌素的合成。Engelhardt 等[40]研究结果指出L.plantarumESB202 与P.acidilacticiHA6111-2 在7.5% NaCl 浓度下分别培养,二者细菌素抑菌活性均被显著抑制。而Lim 等[41]研究发现适宜的NaCl 浓度(1%或3%)使L.plantarumKC21细菌素的合成量翻倍,抑菌活性升至12800 BU/mL,当NaCl 浓度大于5%时会抑制菌株的生长和细菌素的合成。Leal-Sanchez 等[42]同样发现低浓度的NaCl 胁迫(2.3%~2.5%)也会促进L.plantarumLPCO10 细菌素的合成。此外,Vazquez 等[43]发现外源添加1.5 g/L 的半胱氨酸或色氨酸对Nisin 的合成有促进作用。Yi 等[44]以Glu、Gly、Cys、Tyr和Ala 为研究对象,其结果表明只有Cys 和Gly 对细菌素的合成有诱导作用,其余氨基酸作用不显著。但上述氨基酸是通过影响菌体生长进而影响细菌素的产量,还是作为前体物质直接参与细菌素的合成或是作为中间调控因子还有待深入研究。另一方面,Parlindungan 等[45]发现L.plantarumB21受到营养胁迫如葡萄糖胁迫时,生长速度明显降低,且不产生酸,但细菌素的活性仍能被检测。与此相反,受吐温80 的胁迫时,尽管生长速度快、产酸量大,但细菌素活性不明显。上述结果都仅为表观研究,没有针对内在机制进行深入探讨。
4 环境胁迫调控细菌素合成的分子机制
4.1 细胞分泌途径中重要调控基因及蛋白
生物体面对压力变化时通常会诱导大量基因表达并合成应激蛋白质,进而适应不良环境。也有报道指出,菌体面临环境胁迫会激活多种代谢途径[46]。细菌素作为一种分泌蛋白,在其运输分泌过程中ABC 转运蛋白作为一种载体起主要作用。同时,由于细菌素自身结构及底物信号序列的不同,其分泌转运途径可分为NisT 型、SunT 型、Sec 型、SRP 型途径以及其他转运蛋白途径[47](图4)。其中Sec 型分泌途径是细菌蛋白分泌到胞外的常见方式之一,有研究报道指出,SecY、SecE 和SecG 三种调控蛋白共同构成细菌蛋白异位复合体,形成蛋白转运通道,该分泌途径中SecA 蛋白是分泌蛋白跨内膜转运的关键蛋白。此外,有研究表明,当菌体面临氧化应激时,分泌调控蛋白SecA 的C 末端特异性结合一种胞质蛋白MrgA,据报道该蛋白与氧化应激有关[48]。除此之外,SRP 型蛋白分泌途径也较为常见,大多数膜蛋白和分泌蛋白在其靶向定位过程中都会受信号识别颗粒(signal recognition particle,SRP)的严格调控。目前针对乳酸菌SRP 途径的研究主要集中在信号识别颗粒Ffh、受体FtsY 的结构与功能。Froderberg 等[49]研究发现蛋白转运酶YidC 在细菌素分泌过程及Sec 易位过程中均起重要作用,信号识别颗粒Ffh 可与细菌素形成复合体,再与受体FtsY 结合并定位于细胞膜。另一方面,Neumann 等[50]认为信号识别颗粒SRP 和分泌调控蛋白SecA 在分泌蛋白跨内膜转运过程中起协同作用,二者可协助细菌蛋白的分泌。还有研究报道,当菌体面临盐胁迫时,busR基因编码的调控子会刺激BusA 转运蛋白的表达,进而影响细菌素的分泌[51]。综上所述,胁迫下细菌分泌系统相关基因的表达上调使得蛋白共翻译转运速率提升,分泌蛋白的数量增加,由此推测胁迫通过影响细胞膜分泌系统进而影响细菌素的合成。
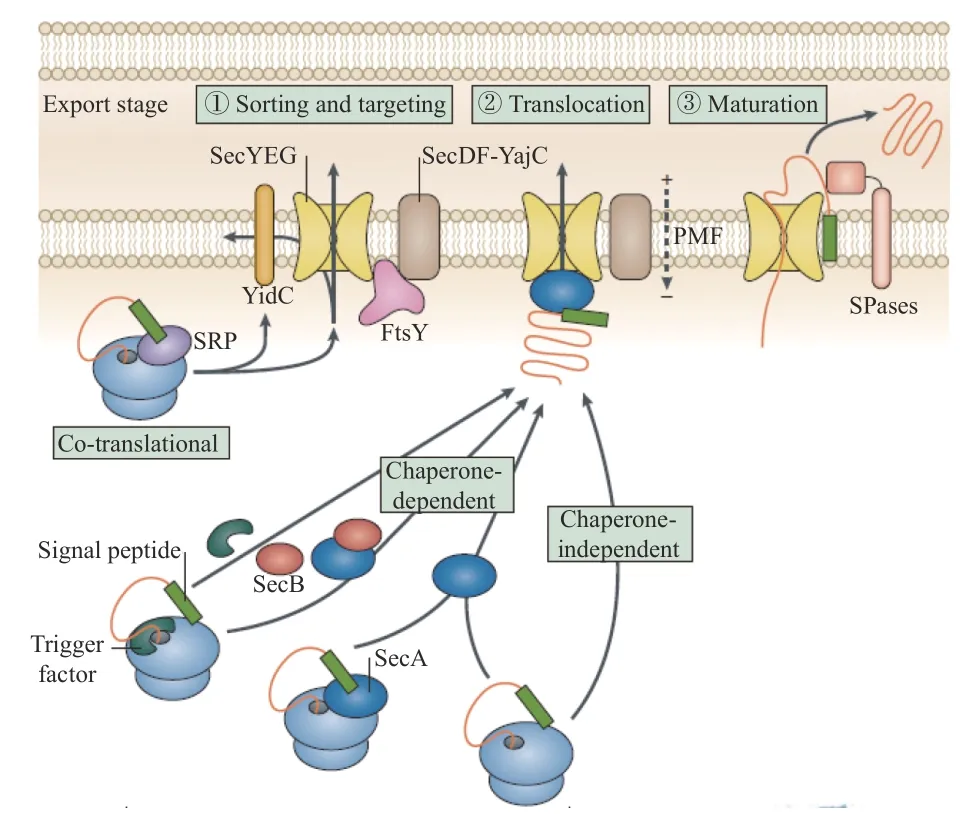
图4 细菌蛋白质分泌途径[52]Fig.4 Secretion pathway of bacterial protein[52]
4.2 氨基酸代谢途径中重要调控基因及蛋白
天冬氨酸及谷氨酸代谢途径是合成缬氨酸、组氨酸、脯氨酸、赖氨酸以及色氨酸等多种氨基酸的有效途径,这些氨基酸可以进一步被生物体利用合成细菌素等相关蛋白。宋雪飞等[53]的研究结果显示基因asnA、hisA、hisC、metE在15 g/L 浓度的NaCl胁迫下表达均显著下调,其中asnA、hisA、metE分别是参与天冬氨酸代谢、组氨酸代谢和半胱氨酸代谢的关键基因。同时,有研究报道指出,盐胁迫下L.plantarumWCFS1 中除了参与丝氨酸代谢途径的基因表达下调,编码氨基酸转运蛋白的基因表达也显著下调。细菌素本质也是一种多肽,其合成过程受上述氨基酸代谢的影响,这也在一定程度上解释了胁迫下细菌素合成量发生变化的原因。
另一方面,由argG和argH基因编码的ArgG和ArgH 蛋白在天冬氨酸转化为精氨酸过程中起到关键的催化作用,张明阳[54]发现酸胁迫环境下过量表达上述两种蛋白会提高氨基酸代谢基因如精氨酸代谢基因arcA、arcB和argR的转录效率。其中arcA、arcB、argR、argG和argH等基因编码的蛋白能够使精氨酸分解并产生氨和ATP,由此推测上述基因可间接为细菌素的合成提供原料及能量,利于菌体抵抗酸胁迫[55]。同时,有研究发现随着外界渗透压升高,编码氨基肽酶PepX 的基因pepX表达显著上调,该基因是调节蛋白质水解系统的关键基因,推断其与细菌素的水解及转运有关。
4.3 脂肪酸代谢途径中重要调控基因及蛋白
乳酸菌面临环境胁迫时,脂肪酸代谢途径中的酰基载体蛋白聚合物FabZ2、FabG2、FabH 作为主导酶发挥优势作用,菌体生长速率加快,进而导致细菌素合成量显著升高。相反,Heunis 等[56]发现酸胁迫条件下L.plantarum423 胞内FabD 蛋白质的表达呈下降趋势,推断由于脂肪酸生物合成量减少进而抑制菌体自身生长,最终细菌素合成量随菌体生长能力减弱而降低。此外,还有研究表明基因accA、accB、accC、fabD及fabZ也参与脂肪酸生物合成途径,其中基因accA、accB及accC负责编码乙酰辅酶A 羧化酶,基因fabD负责编码丙二酰辅酶A[57]。王茜茜等[58]基于iTRAQ 技术发现盐胁迫会导致细胞膜合成相关基因fabG和fabZ表达上调,促进支链脂肪酸的合成从而提高细胞膜的流动性,进而利于细菌素的翻译和分泌。
4.4 核苷酸代谢途径中重要调控基因及蛋白
嘌呤核苷酸不仅作为DNA 与RNA 分子合成的主要底物,同时也参与ATP 和GTP 等物质的合成代谢,为细菌素合成及运输供给能量。嘌呤代谢通路的上游基因purL调控肌苷一磷酸(IMP)与焦磷酸硫胺素(TPP)的生物合成,二者对于细菌素及毒力因子的合成有一定影响。此外,基因sat及编码RNA 聚合酶的基因rpoB过表达均会导致胞内ATP 产量增多,为机体的生长代谢提供了更多的能量,有助于细菌素的合成与分泌。有学者基于转录组测序技术发现盐胁迫下L.plantarumWCFS1 中编码嘌呤合成的基因purD、编码腺嘌呤琥珀酸合酶的基因purA、编码腺嘌呤脱氢酶的基因adeC、编码单磷酸鸟苷还原酶的基因guaC的表达均显著下调,直接导致嘌呤代谢过程中关键酶的活性减弱,间接导致细菌素产量下降[59]。Sun 等[60]的研究结果与上述结果相似,差异蛋白结果显示酸胁迫条件下菌体中基因adk与基因purA的表达也有所下调。此外,Pang 等[61]研究表明,胞内次黄嘌呤的浓度会随着基因purA转录水平的降低而增加,最终导致RNA 和DNA 合成量升高。由于细菌素作为一种分泌肽,RNA 和DNA 又作为其合成模板,因此推断出当菌体受胁迫时GuaC、PurH、PurA 和PurB 等蛋白质对细菌素有重要调控作用。综上所述,胁迫可以通过影响核苷酸代谢途径中能量的生成进而影响细菌素的合成。
4.5 其他重要调控基因及蛋白
核糖体蛋白、DNA 修复蛋白、分子伴侣以及热休克蛋白作为全局调控蛋白,在乳酸菌胁迫响应中也发挥着重要作用。其中,分子伴侣蛋白如GroEL、GrpE、DnaK、DnaJ、Hsp、CspC 等的主要作用是协助蛋白进行组装折叠、转运和降解,胁迫条件下这类蛋白质还能增加代谢相关蛋白如细菌素的稳定性[62]。1990 年,Vanbogelen 等[63]发现核糖体蛋白不仅具有促进蛋白质合成的功能,还能感受外界环境如热、冷、酸、渗透压等的变化并参与细菌素的翻译。2013 年,陈卫等[64]发现当乳酸菌受酸、胆盐等环境胁迫时,热休克蛋白、冷休克蛋白和通用应激蛋白等通常被诱导表达。还有研究显示,大肠杆菌应对环境压力所采用的修复系统由全局转录诱导因子RecA和转录抑制因子LexA 控制,自然状态下LexA 蛋白结合在大肠杆菌素结构基因的启动子处,因此显著抑制细菌素合成[65]。然而当菌体受到紫外线等胁迫诱导后,RecA 受到激活,促进阻遏蛋白LexA 自身发生裂解,解除对细菌素结构基因的抑制作用,最终导致细菌素合成量增大。
5 总结与展望
由于调控细菌素合成基因的多样性及其调控机制的复杂性,目前关于环境胁迫下植物乳杆菌细菌素合成机制的研究相对缺乏,仍有诸多问题有待解决,笔者认为主要集中在以下几个方面:第一,环境胁迫介导哪些基因的转录以及蛋白质的表达参与细菌素的合成;第二,是否存在相关调控蛋白与植物乳杆菌细菌素启动子调控区域有结合作用;第三,目前还没有找到通用的代谢通路用于解释环境胁迫下植物乳杆菌的应激机制;第四,应对不同环境胁迫时,群体感应系统相关的基因如luxS基因的转录水平、信号分子AI-2 的活性及LuxS 蛋白的稳定性如何变化还未可知。但随着深入研究,利用转录组和蛋白质组等多组学技术挖掘植物乳杆菌中重要功能基因,从转录水平、蛋白水平和代谢水平多层面研究不同胁迫下细菌素合成系统的表达差异是未来的研究方向。利用胁迫应答等外源压力提高植物乳杆菌细菌素产量的方法必将成为食品领域的研究热点,进而更好的发挥生物保护发酵剂的生防作用。
