二氢杨梅素和杨梅苷抑制HepG2 细胞的协同作用
2021-06-21陈秋平林心健李申兰刘合生戚向阳
陈秋平,林心健,李申兰,刘合生,戚向阳
(浙江万里学院食品系,浙江宁波 315100)
藤茶,是一种古老的药食两用植物,已被批准为新资源食品,它具有抗菌消炎、降血脂、抗氧化等多种功效[1-2]。近年研究发现其具有广谱的抗癌作用,对肝癌细胞、人胚肾细胞、前列腺癌细胞的增殖抑制作用显著[3-5]。龚金炎等[6]研究发现藤茶提取物及其主要活性单体二氢杨梅素对前列腺癌PC-3 细胞有明显的抑制作用,但其主要活性因子二氢杨梅素对PC-3 细胞的作用弱于藤茶提取物,表明藤茶中可能存在其他活性因子,其与DMY 有协同增效的作用。天然植物中的活性成分是混合存在的,许多纯化后的单体的活性弱于天然植物的粗提物,其活性可能是不同功能因子相互作用的结果。藤茶中的主要活性成分为二氢杨梅素(DMY)、杨梅苷(MYT)、杨梅素等[7-8],含量约为0.3%~34.19%、0.07%~1.71%、0.0007%~0.33%[9-11]。研究发现DMY 和MYT 能够诱导HepG2 细胞凋亡而抑制细胞的增殖[12-13],基于天然产物整体观,本试验主要探究藤茶中的主要黄酮DMY 和MYT 之间的联合作用,探索二者联用对HepG2 细胞增殖的协同作用,以期确定二者的最佳配比,为藤茶的后续研究以及开发利用提供依据。
1 材料与方法
1.1 材料与仪器
HepG2 细胞 上海细胞库;胎牛血清 北京全式金生物技术有限公司;RPMI 培养基、胰蛋白酶Hyclone 公司;Hoechst33342 染色液 碧云天生物技术公司;二氢杨梅素标准品、杨梅苷标准品、四甲基偶氮唑盐(MTT)北京索莱宝科技有限公司。
MCO-15AC 二氧化碳培养箱 日本三洋;MLS-3751L 高压蒸汽灭菌锅 日本松下;HFsafe-1500 生物安全柜 力康仪器有限公司;5804R 离心机 爱本德中国有限公司;DNP-9272A 恒温培养箱 上海贺德实验设备有限公司;酶标仪 瑞士TECAN;Ts2R 倒置荧光显微镜 日本尼康。
1.2 实验方法
1.2.1 细胞的培养 在无菌条件下,将HepG2 细胞接种于含10% FBS 的RPIM-1640 培养基中,于温度为37 ℃、5% CO2的培养箱中培养,隔天换液。当细胞生长密集时,使用0.25%胰蛋白酶消化传代后继续培养[14]。
1.2.2 MTT 法测定细胞增殖抑制率 细胞铺板及给药:将HepG2 细胞消化后,以3000 cell/孔的密度接种至96 孔板,细胞贴壁后给药。将DMY 和MYT用二甲基亚砜(DMSO)配制成100 mmol/L 的母液,使用时用培养基稀释,以获得所需的浓度,并保证DMSO 的最终浓度在培养基中小于0.5%。为了评价DMY 和MYT 的联合作用,使细胞抑制率能更合理分布将细胞用DMY(20、40、60、80 和100 μmol/L),MYT(20、50、100、200 和300 μmol/L),以及DMY和MYT 配伍组(以DMY 为固定浓度10、20、30、40、50 μmol/L,MYT 按DMY:MYT 分别为1:4、1:2、1:1、2:1、4:1、8:1 的比例加入;当DMY:MYT=1:4 时,若DMY 仍以10~50 μmol/L 的浓度,细胞抑制率偏高,因此调整DMY 浓度为5、10、15、20、25 μmol/L,MYT 按DMY:MYT 为1:4 的比例加入)处理72 h,每个样品5 个复孔。每孔加入5 mg/mL MTT 10 μL,将细胞继续于培养箱中培养4 h,离心后,小心吸弃培养基,每孔中加入150 μL的DMSO,避光振荡10 min 使晶体溶解,490 nm 处测定其吸光度,计算细胞增殖抑制率:抑制率(%)=1-OD样品/OD空白对照×100%[15]。
1.2.3 细胞Hoechst 荧光染色 HepG2 细胞悬液均以3×104cell/孔的密度接种于24 孔板中,24 h 后,待细胞在24 孔板中贴壁后,加入单体或合用单体的使其在培养基中的浓度为60 μmol/L,培养72 h 后,吸弃原培养基,用PBS 洗涤2~3 次,每孔加入Hoechst 33342 染色液400 μL,染色20~30 min 后,弃染色液,用PBS 洗涤3 次后进行荧光拍照[16]。
1.2.4 协同作用分析 合用指数(CI)可通过IC50值的计算进一步对两种样品的协同、拮抗或相加效应进行分析[17-18]。将单体或合用单体对细胞抑制率用Calcusyn2.0 软件进行分析,计算DMY 和MYT在单用和联用时各自的IC50值和样品的CI 值。
以DMY 和MYT 两种样品的IC50分别为X、Y 值,作直线连接DMY 和MYT 单用时的IC50值,此直线即为等效线,然后分别以DMY 和MYT 联用时细胞抑制率为50%时,两个单体的浓度为横纵坐标绘制不同的点,若此点在等效线下方则为协同作用,落在线上则为相加作用,在等效线上方则为拮抗作用[19-20]。
1.3 数据处理
采用Calcusyn2.0 软件对DMY 和MYT 的合用指数进行分析,并使用Origin 9.0 作图。
2 结果与分析
2.1 二氢杨梅素和杨梅苷对HepG2 肿瘤细胞增殖的抑制作用
由图1 可知,DMY 和MYT 单一作用下均可抑制HepG2 细胞的增殖,呈剂量依赖效应。DMY 对HepG2 细胞的IC50为56.46 μmol/L;MYT 对HepG2细胞的IC50为95.01 μmol/L,表明DMY 对HepG2细胞增殖的抑制作用强于MYT。
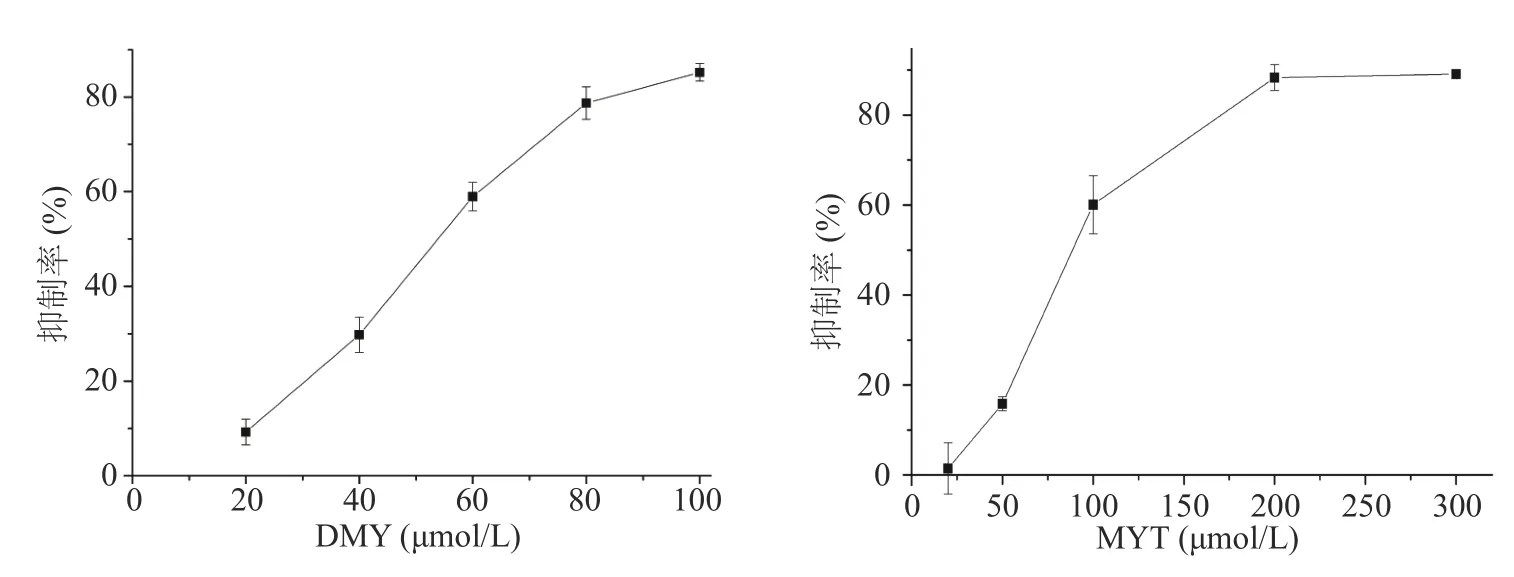
图1 二氢杨梅素和杨梅苷对HepG2 细胞的抑制作用Fig.1 Inhibitory effect of dihydromyricetin and myricetin on HepG2 cell proliferation
2.2 二氢杨梅素和杨梅苷联用对HepG2 肿瘤细胞增殖的抑制作用
如图2 所示,DMY 和MYT 分别以 1:4、1:2、1:1、2:1、4:1、8:1 的比例作用于HepG2 细胞时,随着混合单体浓度的提高,细胞的增殖抑制率也逐渐提高,呈剂量依赖效应,IC50如表1 所示,当混合单体DMY:MYT=1:4 时,IC50最高,为73.00 μmol/L,介于DMY 和MYT 之间;1:2~8:1 混合单体的IC50均低于DMY 和MYT,提示混合单体对HepG2的抑制作用强于单一单体,表现出明显协同作用,其中DMY:MYT=1:1 组的IC50最小,为40.90 μmol/L,分别是DMY 和MYT 单独作用时的72.4%和43.0%,这可能是由于DMY 和MYT 对HepG2 细胞的不同通路和靶点,实现了药效协同,二者联用能够在降低剂量的同时保证效果。

图2 不同配比的二氢杨梅素和杨梅苷对HepG2 细胞的抑制作用Fig.2 Inhibitory effect of different ratio of dihydromyricetin and myricetin on HepG2 cell proliferation

表1 不同样品对HepG2 作用的IC50Table 1 IC50 value of different sample on HepG2 cell
进一步的荧光染色结果显示(图3),HepG2 细胞给药72 h 后,与空白对照组相比,给药组细胞数量明显降低,细胞荧光强度增加,表明其能促进细胞的凋亡,其中联合用药组的细胞数与DMY 相近,MYT 对细胞的作用效果较其他组弱。
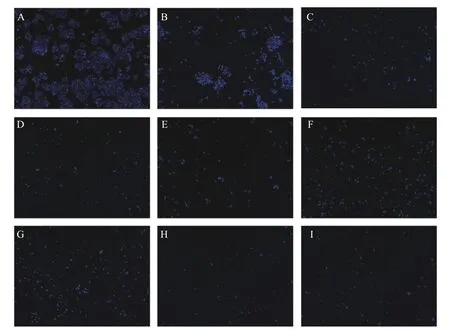
图3 荧光染色法评价混合单体对细胞增殖的协同作用Fig.3 Evaluation of mixeddrugs synergy on cell proliferation by fluorescence staining
2.3 二氢杨梅素和杨梅苷对HepG2 细胞增殖的协同作用分析
CI 值常用于评价单体协同的效果,其值为0.3~0.7 时为协同作用,0.7~0.85 为中等协同作用,0.85~0.90 为弱协同作用。根据单体和混合单体对HepG2 肿瘤细胞的作用,采用Calcusyn2.0 软件计算得到二者的在HepG2 肿瘤细胞IC50处的CI 值,如图4 所示,当二者按1:4~8:1 的配伍比例时,随着混合物中DMY 的比例增加,CI 值呈现先下降后上升的趋势,当二者比例为1:2~1:1 时呈现协同作用,2:1~8:1 时呈中等协同作用,1:4 时为弱协同作用。

图4 合用指数法评价混合单体抑制HepG2细胞增殖的协同作用Fig.4 Evaluation of mixed drugs synergy on HepG2 cell proliferation by Combination index
等效曲线法分析评价二者的协同作用,结果如图5 所示,1:4~8:1 的混合单体的点均落在等效曲线下方,提示二者呈现协同作用。
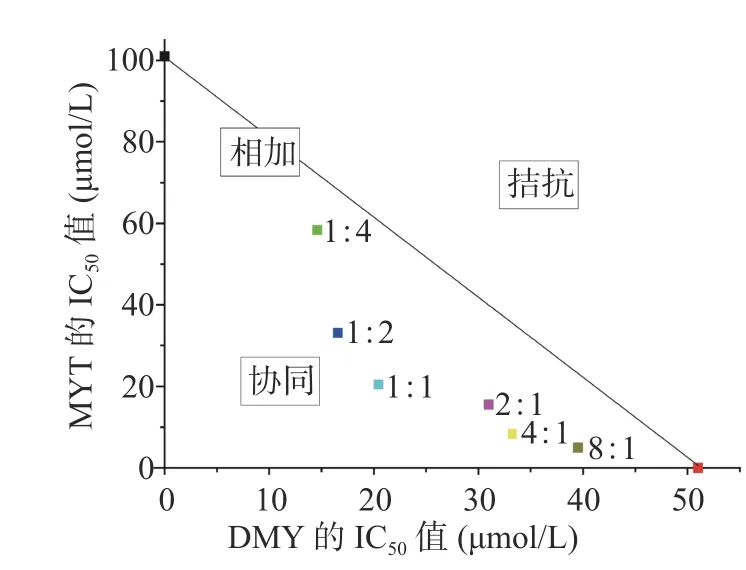
图5 等效线法评价混合单体抑制HepG2细胞增殖的协同作用Fig.5 Evaluation of mixed drugs synergy on HepG2 cell proliferation by isobole analyse
3 讨论与结论
近年对藤茶的研究,大多集中在其主要活性因子DMY,它具有多种生理活性,包括抗炎、降脂、抗癌等作用[21-22],尤其是对不同的肿瘤细胞,呈现出广谱抗癌特性[6,13,23-24]。由于机体代谢是非常复杂的过程,摄入的不同物质间存在相互影响,进而引起药效的改变。我国中医中药常将多种药材联合使用,组成复方,实现药效协同,从而达到对疾病有效治疗[25]。徐容容等[12]研究发现杨梅素和MYT 联用后对可以有效提升对人前列腺癌细胞系PC-3 的增殖抑制和诱导凋亡的作用。江湧等[26]研究发现β-细辛醚、丁香酸联用较单独的化合物更能有效地保护PC12 细胞免受淀粉样蛋白毒性损伤。Tomas-Hernández 等[14]研究发现白藜芦醇和槲皮素联用时,能够促进HepG2 细胞的自噬,并影响了促凋亡信号传导。但是这些研究只是对成分的作用效果进行简单的加减比较,并未进行科学的计算分析评价成分间的协同作用。CI 值近年常用于的评价药效协同作用,当其小于1 时,表明存在协同作用[27]。本试验为了更准确评价DMY 和MYT 间的协同作用,设置了1:2~8:1 梯度浓度,分析二者对HepG2 增殖的相互影响,结果表明该浓度范围内,CI 值均小于1,当二者比例为1:1 时,CI 最低为0.6,呈现协同作用。等效曲线法是另一种常用的药效协同评价方法,结果也进一步证实了DMY 和MYT 存在药效协同,二者联用,对HepG2 抑制达到相同效果时,混合单体的用量可以低于单一药物,可以达到减少剂量,降低成本的效果。肿瘤是机体多途径失调的复杂疾病,对于它的治疗也有很多不同靶点,不同的活性分子组合后,可实现多靶作用,提高药效,降低药量,但是组合物的协同机理较复杂,有关DMY 和MYT 的协同的机理仍需后续研究进一步探索。
二氢杨梅素及杨梅苷对HepG2 细胞的增殖具有抑制作用,二者联用时可明显提升对HepG2 细胞活力的抑制作用。CI 值法和等效曲线法均表明DMY:MYT 在1:4~8:1 呈现协同增效作用,其中当浓度比 DMY:MYT=1:1 时,协同作用最强。这为藤茶的功能的进一步探究和应用提供了新的思路。
