酵母β-葡聚糖加锌复合配方对免疫抑制幼龄小鼠的免疫调节作用
2021-06-21李俊颖崔绍华
陈 琼,陈 朋,李俊颖,崔绍华,乔 倩
(仙乐健康科技股份有限公司,广东汕头 515041)
儿童由于免疫系统不成熟,通常会比成年人更容易受到微生物的感染和引发更严重的疾病[1],据报道,呼吸道感染疾病常发于5 岁以下儿童[2-3]。因此提高儿童的免疫力,增强儿童对感染性疾病的抵抗能力,有助于儿童的健康成长。
β-葡聚糖是由葡萄糖分子构成的多糖类化合物,是真菌、酵母、一些细菌和燕麦、大麦等谷物细胞壁的主要结构成分[4]。其中酵母β-葡聚糖是首个被发现具有免疫增强作用的葡聚糖[5],被公认是一个潜在的免疫调节剂,同时对先天免疫和适应性免疫有加强作用。动物体内不存在β-葡聚糖,因此β-葡聚糖会触发人体的免疫响应,包括促进吞噬作用和细胞因子的产生,从而增强机体消除感染因子的能力[6];同时有研究表明β-葡聚糖可以增强T 细胞刺激能力,进而促进相关细胞因子的分泌,增强适应性免疫能力[7]。锌为儿童生长发育的必要营养素,对于免疫系统的发育及免疫功能有一定的促进作用。锌是中枢免疫器官发育,免疫细胞及免疫因子发挥正常免疫功能的保持所必须的必要元素之一,它通过干预胸腺的成熟发育,细胞因子的产生,调节细胞凋亡和基因转录来参与免疫过程[8],缺乏锌可能会导致巨噬细胞杀害胞内寄生物的能力以及Th 淋巴细胞和NK 细胞的活性降低,从而影响T 细胞免疫功能[9]。
目前,关于酵母β-葡聚糖和锌二者的复合配方研究主要为体外细胞实验或以鱼为研究模型[10-12],对于酵母β-葡聚糖或锌免疫调节功能的研究也多用成年鼠作为研究对象[13-14],随着小鼠周龄数增长,其免疫系统结构与功能会发生改变,例如出现结构退化、功能减退等[15],因此酵母β-葡聚糖加锌复合配方对成年鼠的研究结果无法客观反映其对幼年鼠免疫功能的影响。为了解二者组合对生长发育期免疫系统的影响,本试验拟用幼龄小鼠,并以环磷酰胺构建免疫低下模型,在此基础上以酵母β-葡聚糖加锌复合配方对其进行干预,旨在于探究酵母β-葡聚糖加锌复合配方是否可以逆转由环磷酰胺诱导的幼龄小鼠免疫抑制。
1 材料与方法
1.1 材料与仪器
SPF 级BALB/c 幼鼠(3 周龄)48 只,体重(13.52±2.06)g,实验动物生产许可证号SCXK(粤)2013-0002,实验动物质量合格证号No.44007200058759 广东省医学实验动物中心;酵母β-葡聚糖 湖北安琪酵母有限公司;柠檬酸锌 郑州瑞普生物工程有限公司;小鼠IL-2、TNF-α、IFN-γ、SIgA 酶联免疫检测试剂盒 天津安诺瑞康生物技术有限公司;无菌脱纤维羊血 南京茂捷微生物科技有限公司;水杨酸缓冲液 武汉百浩天生物科技有限公司。
JJ3000 型动物电子秤 美国G&G 公司;Cellometer Mini 型自动细胞计数仪 美国Nexcelom 公司;5424型小型高速离心机 德国Eppendorf 公司;Varioskan Flash 型全波长多功能酶标仪 美国Thermo 公司;Cytomics FC500MPL 流式细胞仪 美国Beckman Coulter 公司。
1.2 实验方法
1.2.1 动物分组及给药 分组:将所有小鼠适应性喂养一周后随机分成空白组、模型组及复合物组,每组各16 只,雌雄各半。复合物组剂量参考人群实验所用剂量进行设计,给予酵母β-葡聚糖和锌复合配方(相当于酵母β-葡聚糖:90 mg/kg/d、锌:2.8 mg/kg/d),酵母β-葡聚糖和锌(来源于柠檬酸锌)用等量递增法进行混合均匀,模型组与空白组给予等体积蒸馏水,每日灌胃1 次,实验周期为4 周(28 d)。实验期间,温度恒定、通风,所有小鼠自由饮食、饮水。在给药的第14、15 d 对模型组和复合物组小鼠腹腔注射环磷酰胺40 mg/kg 以造小鼠免疫抑制模型。试验第29 d,将各组小鼠再次分为两组(每组8 只,雌雄各半):第Ⅰ组小鼠用于体重与免疫器官质量测定、白细胞和淋巴细胞计数、细胞因子含量测定、脾淋巴细胞活性与NK 细胞活性测定、派氏结数目计数与SIgA 含量测定实验、小肠形态学观察;第Ⅱ组小鼠腹腔注射0.2 mL 2%(v/v)绵羊血红细胞(Sporeshaped Red Blood Cell,SRBC),并于4 d 后(即第33 d)用于溶血空斑试验与血清溶血素测定。
1.2.2 小鼠体重与免疫器官质量测定 实验前将第I 组小鼠进行称重并记录,最后一次给药24 h 后对每只小鼠称重并记录,进行取血,完整解剖摘取脾脏、胸腺,去除脂肪和筋膜组织后称重,根据脏器指数计算公式计算胸腺指数和脾脏指数。
脏器指数计算公式:脏器指数(g/g)=脏器质量(g)× 100/体重(g)
1.2.3 小鼠白细胞和淋巴细胞计数 取第Ⅰ组小鼠血液,用全自动血细胞分析仪检测白细胞数和淋巴细胞数。
1.2.4 细胞因子含量测定 取第I 组小鼠全血在4 ℃7500 r/min 离心15 min,收集上清液,按照试剂盒说明书方法检测血清IL-2、TNF-α 及IFN-γ 含量。
1.2.5 溶血空斑试验与血清溶血素测定 参照《保健食品检验与评价技术规范》[16]中方法取第II 组小鼠脾细胞进行溶血空斑试验,取第II 组小鼠血清进行血清溶血素半数溶血值HC50测定。
1.2.6 小鼠脾淋巴细胞活性与NK 细胞活性测定参考徐荣[17]实验方法,无菌取第I 组小组脾脏,制备脾细胞悬液;脾淋巴细胞活性应用ConA 刺激脾淋巴细胞分化增殖,采用四甲基偶氮唑盐(MTT)法测定;NK 细胞活性采用乳酸脱氢酶(LDH)法测定。
1.2.7 小鼠派氏结数目计数与SIgA 含量测定 取第Ⅰ组小鼠全段小肠,计数小肠派氏结的个数。再取出靠近十二指肠段的空肠约5 cm,刮取肠黏膜内容物,溶于PBS 溶液中,按试剂盒说明书方法测定SIgA含量。
1.2.8 小鼠小肠形态学观察 取第I 组小鼠小肠空肠段置于10%甲醛中固定,常规石蜡包埋后制作切片,进行HE 染色,光镜下观察并拍照,测量小肠绒毛高度、隐窝深度,并计算绒毛高度与隐窝深度的比值,计数每张切片每100 个肠黏膜柱状上皮细胞间的杯状细胞数量。
1.3 数据处理
试验结果以均值±标准差表示,并应用SPSS 20.0 进行统计学分析,总体均值的比较采用单因素方差分析(One-Way ANOVA),方差齐性时,组间比较采用LSD 法检验,方差不齐时需对原始数据做函数变换使各组达到方差齐性后再用LSD 法进行组间比较,P<0.05 表示有显著性差异,P<0.01 表示有极显著性差异。
2 结果与分析
2.1 酵母β-葡聚糖加锌复合配方对幼龄小鼠体重及免疫器官系数的影响
如图1 所示,三组间的初始体重没有差异,最终体重也没有差异(图1a )。与空白组相比(图1b、图1c),模型组经过腹腔注射环磷酰胺后,脾脏系数显著降低(P<0.05),胸腺系数极显著降低(P<0.01),说明环磷酰胺成功诱导了幼年小鼠的免疫器官发育缺陷。复合物组小鼠在被给予酵母β-葡聚糖加锌复合配方后,与模型组相比,脾脏系数和胸腺系数都显著升高(P<0.05),结果说明酵母β-葡聚糖加锌复合配方能够改善环磷酰胺诱导的幼龄小鼠免疫器官发育缺陷,这与汪岩等实验结果相一致[18]。

图1 酵母β-葡聚糖加锌复合配方对幼龄小鼠体重及脏器系数的影响(Mean±SD,n=8)Fig.1 Effects of yeast β-glucan and zinc compound formula on body weight and viscera coefficient in immature mice
2.2 酵母β-葡聚糖加锌复合配方对幼龄小鼠白细胞及淋巴细胞的影响
如图2 所示,与空白组相比,模型组小鼠白细胞数和淋巴细胞比例均下降,但二者均无统计学差异(P>0.05)。与模型组相比,复合物组小鼠在被给予酵母β-葡聚糖加锌复合配方后白细胞数极显著性提高(P<0.01),淋巴细胞比例显著提高(P<0.05)。结果表明酵母β-葡聚糖加锌复合配方能够有效提高由环磷酰胺诱导的免疫抑制幼龄小鼠白细胞数和淋巴细胞比例。

图2 酵母β-葡聚糖加锌复合配方对幼龄小鼠白细胞数及淋巴细胞比例的影响(Mean±SD,n=8)Fig.2 Effects of yeast β-glucan and zinc compound formula on number of white blood cells and lymphocyte ratio in immature mice
2.3 酵母β-葡聚糖加锌复合配方对幼龄小鼠血清细胞因子的影响
IL-2 浓度升高可激活Th2 细胞,提高机体的体液免疫应答[19];IFN-γ则可通过活化Th1 细胞,提高机体细胞免疫效能[20],TNF-α是由巨噬细胞被激活而产生的,其能提高巨噬细胞的吞噬活性[21]。如图3 所示,与空白组相比,模型组血清中IL-2、TNFα和IFN-γ含量均下降,其中TNF-α(图3b )、IFNγ(图3c )的含量极显著降低(P<0.01),IL-2(图3a )含量显著降低(P<0.05)。复合物组小鼠血清IL-2、TNF-α 和IFN-γ 含量有不同程度的提高,与模型组相比,IL-2 含量上升,但未见显著性,而 TNF-α和IFN-γ含量均极显著提高(P<0.01)。结果表明酵母β-葡聚糖加锌复合配方能够改善环磷酰胺导致的幼龄小鼠细胞因子分泌减少,其中对抑制TNF-α和IFN-γ的减少尤为显著(P<0.01)。

图3 酵母β-葡聚糖加锌复合配方对幼龄小鼠血清IL-2、TNF-α 和IFN-γ 的影响(Mean±SD,n=8)Fig.3 Effects of yeast β-glucan and zinc compound formula on contents of IL-2,TNF-α and IFN-γ in serum of immature mice
2.4 酵母β-葡聚糖加锌复合配方对幼龄小鼠血清溶血素HC50 及溶血空斑数的影响
血清溶血素HC50和溶血空斑数是常用于衡量生物体体液免疫功能的指标[16]。如图4 所示,与空白组相比,模型组小鼠血清溶血素HC50、溶血空斑数均极显著降低(P<0.01)。复合物组小鼠血清溶血素HC50及溶血空斑数与模型组相比均得到提高,且具极显著性(P<0.01),与空白组相比无显著性变化(P>0.05)。以上结果表明酵母β-葡聚糖加锌复合配方能够有效抑制环磷酰胺引起的免疫低下幼龄小鼠的血清溶血素水平和溶血空斑数的减少。

图4 酵母β-葡聚糖加锌复合配方对幼龄小鼠血清溶血素HC50 及溶血空斑数的影响(Mean±SD,n=8)Fig.4 Effects of yeast β-glucan and zinc compound formula on serum hemolysin HC50 and number of hemolytic plaques in immature mice
2.5 酵母β-葡聚糖加锌复合配方对幼龄小鼠脾淋巴细胞增殖能力及NK 细胞活性的影响
如图5 所示,与空白组相比,模型组脾淋巴细胞增殖活性(图5a )、NK 细胞活性(图5b )均极显著降低(P<0.01)。复合物组小鼠脾淋巴细胞增殖活性、NK 细胞活性与模型组相比均得到提升,其中淋巴细胞增殖活性显著提高(P<0.05),NK 细胞活性极显著提高(P<0.01)。以上结果表明酵母β-葡聚糖加锌复合配方能够逆转由环磷酰胺引起幼龄小鼠的脾淋巴细胞和NK 细胞的活性降低。

图5 酵母β-葡聚糖加锌复合配方对幼龄小鼠脾淋巴细胞增殖能力及NK 细胞活性的影响(Mean±SD,n=8)Fig.5 Effects of yeast β-glucan and zinc compound formula on proliferation ability of splenic lymphocytes and NK cell activity in immature mice
2.6 酵母β-葡聚糖加锌复合配方对幼龄小鼠小肠SIgA含量及小肠派氏结数量的影响
SIgA 是肠道黏膜免疫的功能指标,通过产生抗体与抗原特异性结合,抑制病原微生物的黏附功能。派式结是肠道B 细胞的生发中心,生成分泌型IgA(SIgA)[22]。如图6 所示,与空白组相比,模型组小鼠小肠SIgA(图6a)分泌的含量极显著降低(P<0.01),派氏结数目(图6b)显著减少(P<0.05),提示环磷酰胺成功诱导了肠道免疫功能障碍。与模型组相比,复合物组小鼠小肠SIgA 含量显著提高(P<0.05),派氏结数也极显著增多(P<0.01)。以上结果表明酵母β-葡聚糖加锌复合配方能够缓解环磷酰胺诱导的幼龄小鼠小肠SIgA 含量降低以及派氏结数量减少。

图6 酵母β-葡聚糖加锌复合配方对幼龄小鼠小肠SIgA 含量及小肠派氏结数量的影响(Mean±SD,n=8)Fig.6 Effects of yeast β-glucan and zinc compound formula on the content of SIgA and the number of PPs in small intestine of immature mice
2.7 酵母β-葡聚糖加锌复合配方对幼龄小鼠肠道黏膜形态的影响
杯状细胞分泌肠道中黏蛋白[23],隐窝深浅,可以侧面体现小肠上皮细胞成熟率,分泌、吸收等肠细胞功能[24]。如图7 所示,与空白组相比,模型组小肠绒毛高度(图7a)、隐窝深度(图7b)、绒毛高度/隐窝深度(图7c)、杯状细胞数量(图7d)的均无显著性差异(P>0.05)。与模型组相比,复合物组小鼠小肠绒毛高度、绒毛高度/隐窝深度比值无显著差异,而隐窝深度显著性降低(P<0.05)、杯状细胞数显著升高(P<0.05)。以上结果表明酵母β-葡聚糖加锌复合配方能够显著(P<0.05)增加幼龄小鼠小肠杯状细胞数量,并且有效(P<0.05)减少小鼠小肠隐窝深度。
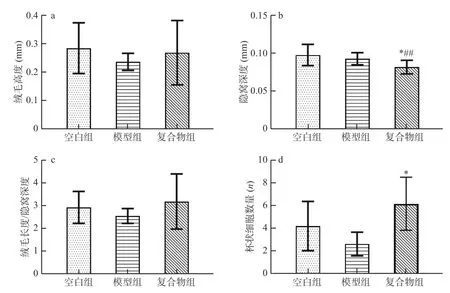
图7 酵母β-葡聚糖加锌复合配方对幼龄小鼠绒毛高度、隐窝深度、绒毛高度/隐窝深度及杯状细胞数的影响(M±SD,n=8)Fig.7 Effects of yeast β-glucan and zinc compound formula on villus height,crypt depth,villus height/crypt depth,and the number of goblet cells in small intestine of immature mice
3 讨论与结论
本研究中,模型组小鼠免疫器官指数、白细胞数、淋巴细胞数、NK 细胞活性和免疫相关细胞因子均显著(P<0.05)低于空白组,表明本研究成功地用环磷酰胺诱导了幼龄小鼠的免疫抑制。然而,摄取β-葡聚糖和锌复合配方的小鼠,经环磷酰胺处理后,免疫器官指数、外周血中白细胞和淋巴细胞比例,淋巴细胞增殖活性显示均显著(P<0.05)高于模型组小鼠,提示酵母β-葡聚糖加锌复合配方能够逆转环磷酰胺导致的小鼠免疫器官缺陷和免疫细胞减少。
T 细胞是一种重要的免疫细胞,分化成熟后经循环系统分布至外周免疫器官。其中辅助型T 细胞(Th1 和Th2)分泌的不同类型的细胞因子是决定细胞功能的重要因素,主要表现为Th1 细胞调节机体细胞免疫功能,Th2 细胞参与体液免疫应答。环磷酰胺可以通过使Th1/Th2 发生细胞偏倚,诱导免疫抑制[25]。本研究结果发现,Th1、Th2 分泌细胞因子(IL-2、IFN-γ)在摄取酵母β-葡聚糖加锌复合配方条件下获得显著(P<0.05)上调,此结果与Bakheet 的研究结果一致[26]。在后续研究中,建议将通过细胞流式技术检测Th1、Th2 细胞数量,确认Th1/Th2 细胞比值。
除了辅助型T 细胞以外,巨噬细胞和NK 细胞是参与杀伤肿瘤细胞的两种主要效应细胞,巨噬细胞和NK 细胞被细胞因子和趋化因子激活,在调节肿瘤生长和转移以及去除病毒中发挥核心作用[27-28]。本研究结果发现酵母β-葡聚糖加锌复合配方逆转环磷酰胺诱导NK 细胞活性下降以及巨噬细胞分泌细胞因子(TNF-α)浓度减少。
肠道黏膜免疫系统是机体最大,也是相对独立的免疫系统,是机体对抗病原体感染的第 一层屏障,同时,也在维护宿主与外环境间的黏膜稳态上发挥重要作用。有报道证明以成年小鼠为研究对象酵母β-葡聚糖可提高SIgA 含量[4],而锌通过调控小肠上皮细胞,宿主免疫细胞等来维持小肠内稳态,是保持适当肠黏膜厚度的基础[29],本研究结果首次证明了,以幼龄小鼠为实验对象,酵母β-葡聚糖加锌复合物可以通过调节肠道黏膜免疫缓解环磷酰胺诱导的免疫抑制。
综上所述,本研究发现酵母β-葡聚糖加锌复合配方可以通过逆转免疫器官缺陷,提高免疫细胞数量,同时增强特异性免疫和非特异性免疫,提高肠道黏膜免疫,来逆转环磷酰胺诱导的幼龄小鼠免疫抑制现象,证明β-葡聚糖加锌复合配方具有较好的调节幼龄小鼠免疫机能的作用。
