等离子体活化水对沙门氏菌的灭活作用及机制研究
2021-06-21相启森杜桂红王利敏蒋爱民
相启森,张 嵘,杜桂红,王利敏,蒋爱民
(1.华南农业大学食品学院,广东广州 510642;2.河南大用实业有限公司,河南鹤壁 456750;3.郑州轻工业大学食品与生物工程学院,河南郑州 450001;4.开封大用实业有限责任公司,河南开封 475000)
食源性致病菌污染是影响食品安全的重要因素,严重威胁人类健康[1]。我国每年都会发生由沙门氏菌、大肠杆菌、李斯特菌等引起的集体性食物中毒事件,严重威胁消费者健康[2]。近年来,非热杀菌技术由于操作温度低,能够较大程度保持食品品质而受到广泛关注[3]。目前,针对食品中微生物污染问题,常用的非热杀菌技术包括超高压、脉冲电场、紫外线杀菌等,这些杀菌方法具有一定的功效,但同时也有一些弊端[4-8]。例如紫外线的穿透能力较低,因此对待处理样品的类型、色泽等有一定要求,这也限制了紫外线杀菌技术的应用范围[9];而超高压杀菌技术成本较高[4,10]。
等离子体活化水(Plasma-activated water,PAW)是一种新型非热杀菌技术,主要通过低温等离子体在水表面或水下放电而产生,具有作用均匀、绿色环保等优点[11],近年来已被广泛应用于食品杀菌保鲜领域[12]。研究证实,PAW 的抗菌活性与等离子体放电过程中产生的一些活性成分(包括电离气体、分子、带电粒子、负离子/正离子、自由基等)紧密相关[13],但对于PAW 杀菌作用机理的研究尚不充分[14]。因此本研究拟以沙门氏菌(S.typhimurium)为研究对象,评价PAW 的杀灭效果,并通过评价细胞形态、细胞膜通透性和胞内活性氧水平等指标分析其作用机理,研究结果将为PAW 在食品保鲜领域中的应用提供科学理论依据。
1 材料与方法
1.1 材料与仪器
沙门氏菌(S.typhimurium,CICC 21484)中国工业微生物菌种保藏中心;营养琼脂和营养肉汤 北京奥博星生物技术有限责任公司;乙酸异戊酯、磷酸二氢钾 天津市科密欧化学试剂有限公司;碘化丙啶(Propidium iodide,PI)、50%戊二醛和N-苯基-1-萘胺(N-Phenyl-1-naphthylamine,NPN)上海阿拉丁生化科技股份有限公司;2′,7′-二氯荧光素二乙酸酯(DCFH-DA)上海源叶生物科技有限公司。
TS-PL200 型等离子表面处理机 深圳东信高科自动化设备有限公司;MJ-54A 型高压灭菌锅 施都凯仪器设备(上海)有限公司;TGL-16M 型台式高速冷冻离心机 上海卢湘仪离心机仪器有限公司;SW-CJ-1FD 型超净工作台 苏州净化设备有限公司;Tecan Spark 20 M 型多功能微孔板读数仪 瑞士Tecan 公司;JSM-6490LV 型扫描电子显微镜日本JEOL 公司;Nano Drop 2000 型超微量分光光度计 美国Thermo 公司。
1.2 实验方法
1.2.1 菌悬液制备 从-80 ℃冰箱中取出甘油管保存的菌种,挑取一环菌液在营养琼脂培养基上反复活化培养后,挑取活力旺盛的单菌落接种于营养肉汤液体培养基中,于37 ℃、120 r/min 恒温振荡培养12 h。取30 mL 培养物于50 mL 离心管,于4 ℃、4000×g离心10 min,弃上清液,所得菌体用0.85%无菌NaCl溶液洗涤2 次,离心同上述条件。将所得菌体重悬于0.85%无菌NaCl 溶液中并混匀,制成活菌数约为7~8 lg CFU/mL 的菌液备用。
1.2.2 PAW 的制备 采用大气压等离子体射流(Atmospheric pressure plasma jet,APPJ)装置制备PAW,其功率750 W,工作气体为压缩空气(0.18 MPa)。将300 mL 无菌去离子水(Sterile distilled water,SDW)经APPJ 装置处理30、60 和90 s 得到的PAW 分别记为PAW30、PAW60 和PAW90,备用。
1.2.3 PAW 对S.typhimurium杀菌效果评价 将100 μLS.typhimurium菌悬液加入装有900 μL PAW 的离心管中,混匀,于室温处理不同时间(0、2、4、6、8 和10 min)。取100 μL 处理后的样品,用0.85%无菌NaCl 溶液进行梯度稀释后,吸取100 μL稀释液加入到营养琼脂平板并涂布,于37 ℃培养箱中培养12 h,进行菌落计数并计算,结果表示为lg CFU/mL,每个稀释度均重复3 次。
1.2.4S.typhimurium细胞形态观察 参考Xiang 等[15]的方法,采用扫描电镜(Scanning electron microscope,SEM)观察PAW 处理对S.typhimurium细胞形态的影响。菌悬液经PAW60 处理10 min 后,于4 ℃、12000×g离心2 min,收集菌体,加入500 μL 预冷的2.5%戊二醛溶液,避光,并于4 ℃冰箱固定4 h;然后于4 ℃,8000×g 离心6 min,收集样品,弃固定液,后用0.1 mol/L 磷酸盐缓冲液(pH7.2)洗涤样品三次,离心同上;后分别用30%、50%、70%、80%、90%、100%(v/v)乙醇溶液对样品逐级洗脱10 min,其中100%乙醇溶液洗脱2 次;最后用乙酸异戊酯洗涤置换乙醇2 次,每次10 min,离心条件同上,弃上清,制备菌悬液,混匀之后滴加到洗净晾干的载玻片上,自然晾干,采用HVB-GB 型真空蒸镀仪喷金150 s,并通过扫描电子显微镜观察并拍照。
1.2.5 胞外蛋白及核酸含量测定S.typhimurium菌悬液经PAW60 处理不同时间后,于4 ℃,12000×g离心2 min,并收集上清液。采用Nano Drop 2000型超微量分光光度计测定上清液中蛋白及核酸含量,每组重复三次,结果均表示为μg/mL。
1.2.6 细胞质膜通透性测定 采用碘化丙啶(PI)探针评价细胞膜通透性的变化情况[16]。S.typhimurium菌悬液经PAW60 处理不同时间(2、4、6、8 和10 min)后,于4 ℃、12000×g 离心2 min,弃上清液,加入PI 储备液(终浓度为3.0 μmol/L)并于暗处(室温)孵育15 min,于4 ℃、8000×g 离心2 min,弃上清,菌体用0.85%无菌NaCl 溶液洗涤两次,重悬。后立即采用多功能微孔板读数仪测定荧光强度,激发波长为540 nm,发射光波长为630 nm,以未处理的样品为对照组。细胞膜相对通透率计算公式如下:
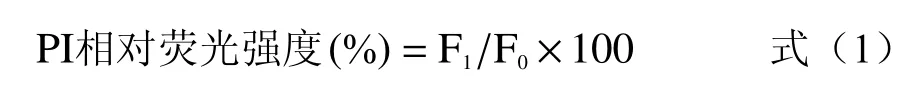
式中:F1为PAW 处理组细胞荧光强度,F0为对照组细胞荧光强度。
1.2.7 细胞外膜完整性测定 采用NPN 荧光探针检测PAW 处理对S.typhimurium细胞外膜的影响[17]。S.typhimurium菌悬液经PAW60 处理不同时间(2、4、6、8 和10 min)后,于4 ℃,12000×g 离心2 min,弃上清液,后加入适量0.1 mol/L 磷酸盐缓冲溶液(pH7.2)重悬,加入NPN 储备液(终浓度为10 μmol/L),置于室温暗处孵育10 min。采用多功能微孔板读数仪测定荧光强度,激发波长为350 nm,发射波长为401 nm。按式(2)计算相对荧光强度:

式中:F1为PAW 处理组细胞荧光强度,F0为对照组细胞荧光强度。
1.2.8 细胞内活性氧水平测定 参考马良军等[18]的方法并稍作改动。S.typhimurium菌悬液经PAW60处理不同时间(2、4、6 和8 min)后,于4 ℃,12000×g离心2 min,弃上清液,并重悬于磷酸盐溶液(0.1 mol/L、pH7.2),洗涤三次,离心同上,后加入适量DCFH-DA 染色液,于37 ℃暗处孵育1 h,后在激发光/发射光为488/525 nm 波长条件下测定样品荧光强度。按式(1)计算相对荧光强度。
1.3 数据处理
每次试验均重复3 次,试验结果表示为平均值±标准差。采用Prism 软件(Graphpad 7.0)绘图,采用SPSS 软件(Version24.0)进行ANOVA 单因素方差分析和最小显著差异法Ducan 检验(P<0.05)。
2 结果与分析
2.1 PAW 对S.typhimurium 的杀菌效果
由图1A 可知,经60、90 s 放电时间PAW 处理6 min后,S.typhimurium活菌数显著降低(P<0.05)。与对照组相比,经PAW30、PAW60 和PAW90 分别处理6 min 后,S.typhimurium活菌数分别降低0.63、1.78 和4.32 lg CFU/mL。结合前期研究结果,考虑到耗能因素且通过优化PAW60 处理时间也能达到良好的杀菌效果,因此采用PAW60 进行后续实验研究。如图1B 所示,随着PAW60 处理时间的延长(2~10 min),S.typhimurium活菌数显著降低(P<0.05)。与对照组相比,经PAW60 处理10 min 后,S.typhimurium活菌数由初始的7.91 lg CFU/mL 降低至3.69 lg CFU/mL,减少了4.22 lg CFU/mL。以上结果表明,PAW 能够有效灭活S.typhimurium,其杀菌效果受低温等离子体激活时间和处理时间影响较大。

图1 放电时间(A)和反应时间(B)对PAW 杀灭S.typhimurium 效果的影响Fig.1 Effects of discharge time (A) and treatment time (B) on inactivation efficacy of PAW against S.typhimurium cells
2.2 PAW 对S.typhimurium 细胞形态的影响
采用扫描电子显微镜观察PAW 处理对S.typhimurium细胞形态的影响。如图2 所示,对照组S.typhimurium细胞呈杆状,表面完整光滑;经PAW60 处理10 min 后,S.typhimurium菌体出现不规则锯齿形轮廓,并且菌体表面出现明显的褶皱和破裂,这与朱莉华等[19]的结果一致。以上结果表明,PAW 处理破坏了细菌细胞形态,可能进一步影响其正常生理代谢。

图2 PAW60 处理对S.typhimurium 细胞形态的影响Fig.2 Effect of PAW60 treatment on the morphology of S.typhimurium cells
2.3 PAW 对S.typhimurium 细胞膜通透性的影响
通过测定核酸、蛋白质等胞内物质的释放评价PAW 处理对S.typhimurium细胞膜通透性的影响。由图3A 可知,在处理时间为0 至10 min 时,S.typhimurium胞外核酸含量随着PAW60 处理时间的延长而显著增加(P<0.05)。PAW60 处理10 min后上清液中核酸含量为7.33 μg/mL,显著高于对照组(P<0.05)。如图3B 所示,随PAW60 处理时间延长,S.typhimurium胞外蛋白质释放量显著升高(P<0.05);经PAW60 处理10 min 后,胞外蛋白质浓度升高至72.00 μg/mL。以上结果表明PAW 处理可造成S.typhimurium细胞膜结构发生改变,从而显著增强其细胞膜通透性(P<0.05),造成核酸及蛋白质等胞内组分释放到胞外。

图3 PAW60 处理对S. typhimurium 核酸(A)和蛋白释放量(B)的影响Fig.3 Effects of PAW60 treatment on nucleic acids (A) and proteins (B) leakages of S.typhimurium
2.4 PAW 对S.typhimurium 细胞膜通透性的影响
碘化丙啶(PI)是一种疏水性核酸染料,当细胞膜受损或通透性改变时,PI 会进入细胞内并与核酸结合后发出红色荧光[20]。由图4 可知,与对照组相比,随着PAW60 处理时间延长,S.typhimurium细胞中PI 荧光强度显著增强(P<0.05),这与Xiang 等[21]的研究结果一致。当处理时间为10 min 时,S.typhimurium细胞PI 荧光强度相对于对照组升高了84.58%。以上结果表明PAW 处理显著增强了S.typhimurium细胞质膜的通透性(P<0.05),造成胞内核酸、蛋白质等物质释放到胞外,影响正常代谢而造成细胞死亡[22]。
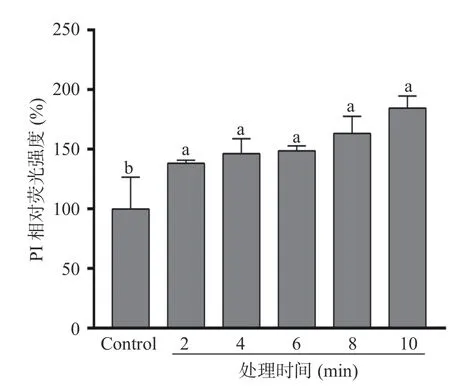
图4 PAW60 处理对S.typhimurium 细胞中PI 荧光强度的影响Fig.4 Effect of PAW60 treatment on PI fluorescence intensity of S.typhimurium cells
2.5 PAW 对S.typhimurium 细胞外膜完整性的影响
革兰氏阴性菌(如S.typhimurium)由内膜和外膜两层膜包被[23],完整的外膜作为渗透屏障可以保护细菌不受环境中有害化合物的损害[24]。NPN 是一种疏水性荧光探针,只能在亲水溶液中发出微弱荧光,不能有效穿过细菌细胞的外膜,但一旦细菌外膜受损,它就可以进入外膜的疏水性环境(膜内部磷脂层),其荧光强度显著增强[25]。因此,NPN 被广泛用于评价细菌外膜通透性变化[17]。
如图5 所示,与对照组相比,S.typhimurium细胞中NPN 荧光强度随PAW60 处理时间的延长而逐渐增强(P<0.05)。经PAW60 处理10 min 后,S.typhimurium细胞中NPN 荧光强度升高了316.81%。细胞外膜通透性的增强常伴随着膜的破坏和裂解。已有研究表明,经热和PAW 处理后,细菌细胞的NPN 荧光强度显著增强[26]。综上所述,PAW60 处理造成S.typhimurium细胞外膜渗透性增强,这可能是其死亡的重要原因[27]。

图5 PAW60 处理对S.typhimurium NPN 荧光强度的影响Fig.5 Effect of PAW60 treatment on NPN fluorescence intensity of S.typhimurium
2.6 PAW 对S.typhimurium 胞内活性氧水平的影响
在等离子体放电过程中会产生大量的活性氧(Reactive oxygen species,ROS)和活性氮(Reactive nitrogen species,RNS),如臭氧(O3)、一氧化氮(NO)、二氧化氮(NO2)和羟基自由基(·OH)等。这些活性物质转移到水中,可以诱导细菌细胞膜脂质发生氧化反应,同时活性物质还可以扩散到细胞内,进一步氧化蛋白质和核酸等物质,诱导细胞发生氧化应激反应,从而破坏细胞的正常生理功能[28]。采用DCFH-DA 探针检测PAW60 处理对S.typhimurium胞内ROS 含量的影响。如图6 所示,在处理时间为0~8 min 时,S.typhimurium胞内ROS 水平随PAW60处理时间的延长而逐渐升高。经PAW60 处理8 min后,S.typhimurium胞内活性氧水平相对于对照组升高了114.07%。ROS 过度积累会对胞内脂类、蛋白质和DNA 等生物分子造成氧化损伤,导致细菌的生物膜和细胞生理功能被破坏,最终造成细胞死亡[29]。
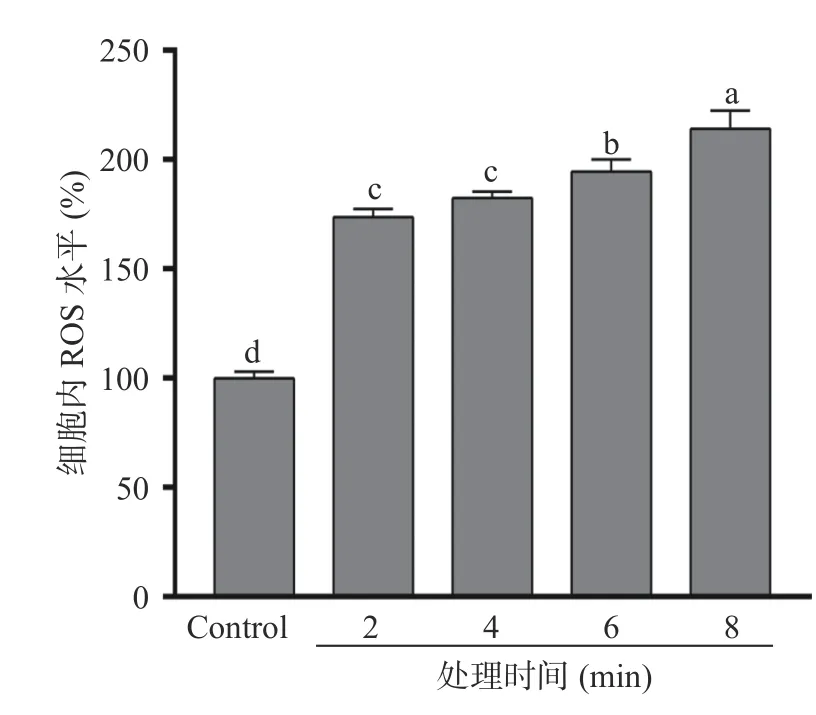
图6 PAW60 对S.typhimurium 胞内活性氧水平的影响Fig.6 Effect of PAW60 on the intracellular reactive oxygen levels of S.typhimurium cells
3 结论
本研究通过等离子体放电不同时间得到PAW30、PAW60 和PAW90,发现随着放电时间的延长,PAW 对S.typhimurium杀菌效果逐渐增强。经PAW60 处理10 min 后,S.typhimurium活菌数减少了4.22 lg CFU/mL;PAW60 处理后,S.typhimurium细胞形态发生明显变化,细胞膜通透性增强,并且胞内活性氧水平显著升高,这些可能是PAW 处理造成S.typhimurium失活的重要作用机制。在今后的研究中应综合运用代谢组学、转录组学、蛋白质组学等方法系统阐明PAW 失活微生物的分子机制;此外,还应系统评价PAW 对食品表面微生物的杀灭效果及对食品营养和感官品质的影响。
