一种葡萄酿酒活性干酵母简便制备法
2021-06-21李东歌刘红艳叶冬青许引虎刘延琳
李东歌,刘红艳,叶冬青,秦 义,3,孙 悦,许引虎,刘延琳,3,
(1.西北农林科技大学葡萄酒学院,陕西杨凌 712100;2.广西壮族自治区农业科学研究院农产品加工研究所,广西南宁 530007;3.中国葡萄酒产业技术研究院,宁夏银川 750021;4.宁夏大学葡萄酒学院/宁夏葡萄与葡萄酒研究院,宁夏银川 750021;5.湖北省酵母功能重点实验室,湖北宜昌 443003)
酿酒活性干酵母是现代高新技术融合发展的一种生物活性制品,具有发酵性能优良、细胞耐性强、絮凝性好、保存期长、运输方便等优点[1-2]。在葡萄酒生产中,酿酒活性干酵母是葡萄酒的关键辅料,优良的酿酒活性干酵母能使葡萄酒发酵的过程稳定易控,促进葡萄浆果优良品质在发酵过程中最大限度的表达,从而获得高品质的葡萄酒[2]。其性能的优劣不仅决定了葡萄酒发酵能否顺利进行,更会对葡萄酒的质量,特别是葡萄酒口感和风味产生显著影响[3-4]。近年来随着“微生物风土”概念的提出和被葡萄酒行业普遍接受,亟需一种设备投入要求低、简便的酿酒活性干酵母制备方法来进行特定酿酒活性干酵母的制备,以满足具有地域特色风格的葡萄酒产品开发需求[5]。
生产酿酒活性干酵母主要是对其培养基和培养条件进行优化,从而培养获得活性强且生物量高的酵母,再采用较为温和的方式进行干燥,以获得高活性的干酵母制品。酵母菌在生长过程中受到巴斯德效应(The Pasteur Effect)和克雷布特效应(The Crabtrec Effect)的双重调节,严格优化培养基成分和含量对高生物量的获得十分关键[6],流加培养的关键在于对培养条件和补料方式进行优化,以保证培养过程始终处在最佳的状态[7]。发酵罐是酵母培养重要的生物反应器,工业化活性干酵母的制备方法大多采用“发酵罐-流化床”体系进行制备。新型发酵罐基本上是围绕传氧效率、搅拌系统、使用材料三者的综合考虑[8],而摇瓶培养只需要控制转速、温度等简单条件。生产酿酒活性干酵母干燥过程是将酵母细胞脱水使之进入一个新陈代谢临时可逆、暂停的低湿休眠状态[9],其中热风干燥、真空干燥、喷雾干燥和流化床干燥等[10-11]是常用的方法。与其它干燥方法相比,热风干燥操作简单、成本低,对于中小微企业来说能够带来更好的经济收益。热风干燥是将物料置于连续流动的空气流中,使物料中的水分不断蒸发的过程[12]。发酵罐生产对于小微企业生产活性干酵母成本相对较高,所以“摇瓶-烘箱”体系更加简便、经济实惠。
为了满足实验室或大量中小型企业对小批量制备特定本土活性干酵母的需求,本研究以优选酿酒酵母菌株wh-2-8 为试验对象,进行基于“摇瓶-烘箱”平台的酿酒活性干酵母的制备研究,优化发酵工艺和干酵母制备工艺,得到最佳培养时间、酵母最佳鼓风干燥时间,保护剂最佳添加量等,以期为小批量简便制备活性干酵母提供技术方法和理论依据。
1 材料和方法
1.1 材料与仪器
赤霞珠葡萄 2018 年采于宁夏,成熟度良好,总糖232.52 g/L,总酸(以酒石酸计)5.32 g/L,pH 3.48;酿酒酵母(Saccharomyces cerevisiae)wh-2-8 保存于西北农林科技大学葡萄酒学院酿酒微生物种质资源室;摇瓶种子培养基、酵母浸出粉胨葡萄糖(Yeast Extract Peptone Dextros,YEPD)液体培养基、葡萄糖 天津市科密欧化学试剂有限公司;酵母浸粉、蛋白胨 北京奥博星生物技术有限责任公司;氢氧化钠 四川西陇科学有限公司;果胶酶 沃尔森公司;亚硫酸 天津市天力化学试剂有限公司;海藻糖 上海源叶生物科技有限公司;葡萄糖、氢氧化钠、果胶酶 均为分析纯。
BK1301 生物显微镜 南京庚辰科学仪器有限公司;Cary60 紫外可见分光光度计 安捷伦科技有限公司;ELX800 酶标仪 美国Bio-Tek 公司;NRY-2110 恒温摇床 上海南荣实验室设备有限公司;HDS-16-5 卤素电子水分仪 上海方瑞仪器有限公司;GNP-9080 隔水式恒温培养箱 上海精宏实验设备有限公司;TDL-40B 高速离心机 上海安亭科学仪器厂;CS1013 电热鼓风干燥箱 重庆试验设备厂。
1.2 试验方法
1.2.1 种子液培养菌种活化 将保存于-80 ℃冰箱的酿酒酵母wh-2-8 菌株于无菌状态下用接种环挑取一环在平板培养基上划线,用封口膜封口,置于28 ℃恒温培养箱培养48 h。
活化后接于装有200 mL 种子培养基的摇瓶,在转速250 r/min、温度30±1 ℃的恒温震荡培养箱中培养至稳定期,挑选稳定期前期至对数期后期的节点作为接种时间点。
1.2.2 摇瓶增殖培养 将培养至最佳时间的种子液在无菌状态下按摇瓶装液量体积的10%进行接种,在转速250 r/min、温度30±1 ℃的恒温震荡培养箱中培养,每隔4 h 取样监测,并及时加入400 g/L 葡萄糖溶液和1 mol/L NaOH 溶液进行补料,使葡萄糖含量维持在20 g/L 的水平,pH 维持在5~6 的水平。
1.2.2.1 摇瓶装液量优化试验 在500 mL 锥形瓶中加入培养基的量分别设定为100、150、200、250 mL,测定OD600nm,分析不同装液量对酿酒酵母生长的影响,并确定最佳摇瓶装液量。
1.2.2.2 补料方式优化试验 以最佳摇瓶装液量进行接种培养,设定3 组补料方式,A 组:进行碳源补加并调节pH 在5~6 的水平;B 组:只进行碳源补加;C 组:不进行补料。测定OD600nm,分析三种补料方式对酿酒酵母生长的影响,确定最佳补料方式。
1.2.3 菌体鼓风干燥 将增殖培养完成后干重达到最大时的酵母培养液进行离心,在得到的酵母菌体中加入保护剂,分置于90 mm 的玻璃皿,放入鼓风干燥箱进行干燥。将干燥完成的酵母活性干粉封藏于密封袋中,放于4 ℃冰箱贮存备用。
1.2.3.1 保护剂添加量优化试验 离心获得的酵母泥,以海藻糖为保护剂,添加量(以干重计)设定为5%、8%、10%,放置于36 ℃条件下进行干燥,每隔1 h 取样进行水分含量的测定,以水分含量≤5.5%来确定干燥时间。分析不同保护剂添加量对酵母菌体的活菌率影响,确定最佳保护剂添加量。
1.2.3.2 鼓风干燥温度优化试验 在选定的最佳保护剂添加量的基础上,设定干燥温度分别为30、33、36、40、45 ℃,每隔1 h 取样进行水分含量的测定,以水分含量≤5.5%来确定干燥时间。分析不同干燥温度对酵母菌体活菌率的影响,确定最佳干燥温度。
1.2.4 指标测定方法 采用3,5-二硝基水杨酸(DNS)法进行葡萄糖浓度的测定[13];光密度测定:于600 nm波长处测定适当稀释的发酵液光密度值OD600nm;细胞干重测定:离心所得菌体恒温烘干至质量恒定;酵母细胞数检测法:用显微镜血球计数法计数。复水活化活菌率按照公式(1)进行计算。

1.2.5 活性干酵母发酵性能检验 将赤霞珠葡萄进行除梗破碎,装入2.5 L 玻璃容器中(设置3 组平行:罐号1、2、3),按照1 mg/L 的添加量添加6%亚硫酸并混合均匀,后于葡萄醪中加入30 mg/L 果胶酶,24 h后加入已用葡萄汁活化好的wh-2-8 酿酒活性干酵母粉,接种量为6.80×106个/mL,进行浸渍发酵。
在发酵过程中,每12 h 进行一次压帽,每隔24 h进行一次残糖的测定。在发酵结束后,进行残糖、酒度、挥发酸、pH 及总酸的测定。
1.3 数据分析
采用Microsoft Office 2010 进行数据统计;Minitab 18 进行数据分析,多组间分析采用One-Way ANOVA 法;Origin 9.5 软件进行作图。
2 结果与分析
2.1 酿酒酵母wh-2-8 生长特征
酿酒酵母wh-2-8 的生长呈现典型的对数生长(图1),从培养开始至10 h 为生长延滞期,10~20 h为生长对数期,20 h 后处于酵母的生长稳定期。考虑到菌株的数量和活力,选择处于生长对数期后期至稳定期前期的22 h 作为酿酒酵母wh-2-8 种子液培养的最佳时间,此时的活细胞数为1.47 × 107个/mL。

图1 酿酒酵母种子液生长曲线Fig.1 Growth curve of S.cerevisiaeseed liquid
2.2 摇瓶装液量的选择
比较不同装液量对酿酒酵母wh-2-8 生长量的影响,其结果如图2 所示。24~48 h 酵母处于对数生长期,生长较快;而在52~96 h 酵母生长开始出现衰亡,因为调节pH 和糖导致摇瓶中溶氧越来越低,所以酵母生长量开始降低。通过对比可知:初始装液量越少,相同时间内菌体生长量越高。因此,综合考虑菌体总积累量以及培养时间,确定在500 mL 锥形瓶中装液量200 mL 作为摇瓶扩大培养的条件。

图2 不同装液量下酵母的生长曲线Fig.2 Growth curve of yeast with different liquid volume
2.3 补料方式与培养时间的选择
摇瓶培养条件下,进行碳源分批补加以及发酵pH 控制(图3)。进行碳源分批补料、pH 调节的(A 和B)生长量在48 h 达到稳定期,而不进行碳源和pH 调节的(C)在32 h 达到稳定期;200 mL 装液量条件下,补加碳源并调节pH 时(A)的菌体生长量高于其它两组补料方式(B、C),OD600nm最大可达到56.23;只补加碳源(B)的条件下,酵母生长低于补加碳源并调节pH 组(A),OD600nm最大值为52.22;不进行补料(C)组的菌体最大OD600nm仅为34.57。因此,有利于摇瓶扩大培养的补料方式为进行碳源补加并调节pH。

图3 不同补料方式酵母生长曲线Fig.3 Curves of feeding ways on biomass of S.cerevisiae
在选定的补料方式的基础上,以菌体浓度指标,选择摇瓶培养的时间,以获得在最佳生物活性状态下的最大菌体浓度。结果发现,酵母菌体干重在55 h达到最大值17.80 g/L,活菌数5.68×108个/mL,OD600nm达到54.95(图4)。因此综上所述,基于“摇瓶”的酿酒酵母较优的培养条件为:YEPD 为发酵培养基、摇床转速250 r/min、培养温度30±1 ℃、间歇补料维持葡萄糖在20 g/L 水平、pH 5~6 水平,发酵时长为55 h。

图4 摇瓶间歇补料培养生长曲线Fig.4 Growth curve of batch culture in shake flask
2.4 鼓风干燥保护剂添加量的确定
选择最常用的鼓风干燥箱作为探究活性干酵母的干燥设备。干燥条件对酵母菌体活性影响较大,而保护剂可以在制备酵母活性干细胞过程中能起到保护作用,有效地提高活菌率[14]。相关研究表明海藻糖对酵母具有较好的保护效果[15],本研究探究了三种浓度下海藻糖对干酵母的保护作用,结果如图5 所示。保护剂的含量从5%提高到8%时,活菌率显著提高(P<0.05),而8%的添加量与10%的添加量的活菌率分别为70.16%和71.02%,并无明显提高,考虑到生产中实际的经济效益,所以选择保护剂的添加量是8%。

图5 不同保护剂添加量的活菌率Fig.5 Livingcell rate of different protective agent additions
2.5 鼓风干燥温度和时间的确定
在确定保护剂用量为8%的基础上,设定一系列温度梯度,探究不同干燥温度和时间对活性干酵母活菌率的影响,结果如表1 所示。在30~36 ℃条件下,活菌率随着温度的升高而有所升高;而超过36 ℃,温度越高,活菌率反而越低。在36 ℃干燥12 h 的条件下,活菌率达到最大值71.05%,干粉水分含量在5.15%,符合国标GB/T 20886-2007[16]对活性干酵母含水量(≤5.5%)的要求。

表1 不同鼓风干燥温度下活菌率和含水量Table 1 Living cell rate and water content at different air drying temperatures
2.6 酿酒活性干酵母基本质量指标
对所制备的活性干酵母的基本质量指标进行检测(表2)。制备的酿酒活性干酵母指标中除了活细胞率略低于国标GB/T 20886-2007 的80%外[16],其它质量指标符合国家标准,可达到实验室阶段简便制备小批量活性干酵母的目的,具有实际使用价值。
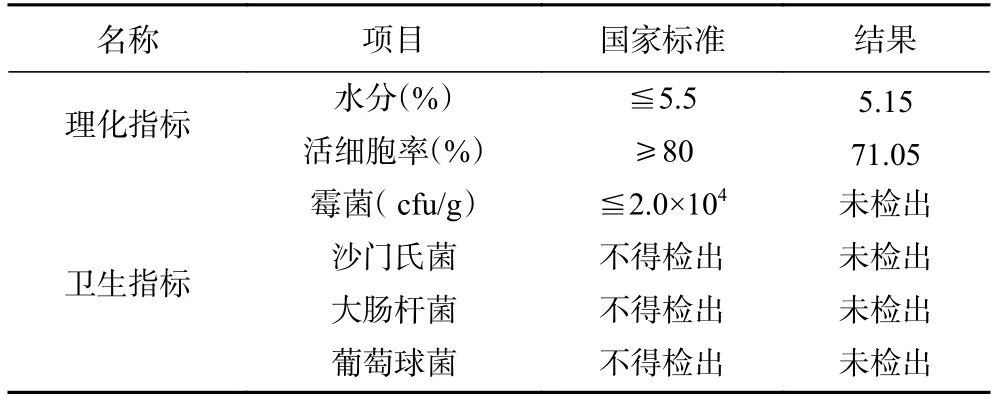
表2 酿酒活性干酵母基本质量指标Table 2 Quality indicators of active dry yeast
2.7 发酵性能检测
使用制备的酿酒活性干酵母进行干红葡萄酒的发酵试验(图6)。酿酒酵母wh-2-8 在启酵后的24~96 h 内能够迅速将糖代谢转化成酒精,启酵迅速,且发酵过程平稳,符合酿酒酵母发酵特性。发酵结束所得干红葡萄酒基本理化指标如表3 所示。3 个酒样之间理化指标稳定性较好,残糖均小于4 g/L,酒度达12%(V/V)以上,挥发酸远低于国家标准(1.2 g/L)[17],说明所制备的活性干酵母发酵性能良好,可用于实际葡萄酒的酿造生产。

图6 发酵过程中还原糖变化Fig.6 Change of reducing sugar content during fermentation

表3 干红葡萄酒基本理化指标Table 3 Basic physical and chemical indexes of dry red wine
3 结论与讨论
本研究通过酿酒活性干酵母工艺的优化,建立了对“摇瓶-烘箱”体系的酿酒活性干酵母简便制备方法,对比“发酵罐-流化床”体系,“摇瓶-烘箱”体系满足了试验研究和普通小微企业简便制备特色酿酒活性干酵母的需求。
在摇瓶增殖培养工艺上,通过补加碳源和控制发酵过程pH 的方式,使得酵母细胞干重最高可达17.80 g/L 的水平,明显优于前人摇瓶培养的结果[18-19]。赵小丽等[18]通过对酿酒酵母有氧发酵条件进行探究、优化实验室摇瓶发酵条件,优化后的菌体干重为9.63 g/L;南博[19]通过对摇瓶发酵培养基和培养条件的探究获得的最终菌体量为11 g/L。上述研究中,菌体量较低的原因可能是在培养过程中摇床转速为180 r/min,从而导致生产过程中溶氧较低,影响了酵母生长量[20],同时也没有进行补料,这也导致了后期酵母因营养缺失停止生长[21]。本文通过对转速的控制提高,采用补料的方式,最终提高了酿酒活性干酵母的生物量。
在干燥阶段工艺上,选择了最常见的鼓风干燥箱作为酵母菌体的干燥设备,所得到的较优结果条件下的酵母活菌率已达71.05%,相较于同样使用海藻糖做单一保护剂的研究结果[22-23],本试验虽略低于80%,但其发酵赤霞珠干红葡萄酒残糖小于4 g/L,酒度达12%(V/V)以上,挥发酸远低于国家标准(1.2 g/L)性能[24-25],具有良好的发酵性能。多数的研究表明,复合保护剂的添加更有利于提高活菌率[26-30],后续可进行不同保护剂的复配使用以进一步提高活菌率。综上,本研究通过对活性干酵母制备工艺的优化,为实验室条件下进行小批量酿酒活性干酵母的简便制备提供技术方法和理论依据。
