儿童Ⅰ型胸膜肺母细胞瘤与囊性先天性肺气道畸形影像诊断
2021-06-21田金生吴慧莹周成刘鸿圣徐文彪鹿连伟李建明刘玉涛
田金生, 吴慧莹, 周成, 刘鸿圣, 徐文彪, 鹿连伟, 李建明, 刘玉涛
胸膜肺母细胞瘤(pleuropulmonary blastoma,PPB)是儿童肺内最常见恶性肿瘤。PPB生物学行为独特[1],年龄较小患者主要表现为囊性(Ⅰ型),经过2~4年进展为囊实性(Ⅱ型),再发展成全部实性(Ⅲ型)肿瘤;随着恶性程度增高,肿瘤实性成分增多。先天性肺气道畸形(congenital pulmonary airway malformations,CPAMs)是儿童下呼吸道罕见发育畸形[2],同时也是儿童最常见先天性肺发育畸形[3]。Stocker[4]将CPAM分为5类(0~Ⅳ型)。0型具有致命性,胎儿多在宫内死亡[5];Ⅲ型为类似于细支气管和肺泡管的实性肿物,故0型、Ⅲ型不列入本文讨论范围。与0型、Ⅲ型不同,Ⅰ型、Ⅱ型及Ⅳ型CPAM均为囊性病灶。Ⅰ型PPB及囊性CPAM是儿童期常见肺内良恶性囊性病变,影像诊断及鉴别诊断困难。本文结合Stocker[4]分型,回顾性分析经手术病理学证实145例囊性CPAM及9例I型PPB临床及影像资料,与病理学结果相对照,总结儿童常见的肺内囊性病变临床及影像学特征,为临床治疗提供依据。
材料与方法
1.临床资料
回顾性分析2008年1月-2019年1月经手术病理证实154例(9例I型PPB及145例CPAM)儿童肺部囊肿临床及影像资料,其中男90例,女64例,年龄1个月~6.2岁,平均年龄(33.8±39.1)月,总结儿童常见肺部囊性病灶临床表现及影像特征,比较二者在临床及影像上的异同。
2.检查方法
154例患儿全部行胸部CT平扫加增强扫描检查。检查不合作患儿以0.5 mL/kg体质量10%水合氯醛口服镇静,熟睡后检查。检查采用Philips Brilliance 64 排或Toshiba Aquilion 64排螺旋CT机,层厚0.8 mm,电压120 kV,电流25~30 mAs,矩阵512×512。增强扫描采用非离子对比剂(优维显),剂量为1~3 mL/kg。扫描后原始数据传至后处理工作站,以标准算法重建,重建层厚1 mm,行MPR、VR等后处理。
3.结果分析
Pearson卡方检验;#年龄和囊最大径不符合正太分布,统计使用Kruskal-Wallis检验,表格内为中位数(四份位数);*各型囊性CPAM与I型PPB比较;a,b为两两比较结果,且a>b(差异有统计学差异)
临床资料包括年龄、性别、产前诊断史,临床症状及是否伴随其他畸形。由2位经验丰富的高年资医师对154例患儿的CT图像进行重新阅片,分析囊肿位置(左/右肺),囊肿最大径,重点观察囊壁结节,是否合并肺炎、纵膈移位、气胸等。
4.统计方法
计量资料(性别,产前诊断史,临床症状,合并畸形率,位置(左/右肺),合并炎症、气胸,纵隔移位等)采用Pearson卡方检验,Bonferroni校正因子(P<0.00833)校正事后多重比较后的显著性水平。年龄和囊肿最大径等计数资料采用均数±标准差表示。若年龄及囊肿最大径服从正态分布,采用ANOVA比较差异;不服从正态分布则采用Kruskal-Wallis检验(H检验)比较。若结果存在统计学差异,则进行事后多重比较(校正P)。以囊肿的最大径作为鉴别儿童良性(Ⅰ、Ⅱ及Ⅳ型CPAM)恶性(Ⅰ型PPB)囊性病变的指标,绘制ROC曲线并进一步计算曲线下面积和、截距及约登指数(Youden index)。
所有统计分析使用SPSS 23.0进行统计分析,以P<0.05为差异有统计学意义。
结 果
1.临床资料
154例肺部囊性病变患者CPAM(Ⅰ、Ⅱ、Ⅳ型)145例占94.2%,Ⅰ型PPB 9例占5.8%(图1)。 145例囊性CPAM54例(35.1%)为Ⅰ型CPAM(图2),72例(46.8%)为Ⅱ型CPAM(图3),19例(12.3%)为Ⅳ型CPAM(图4)。
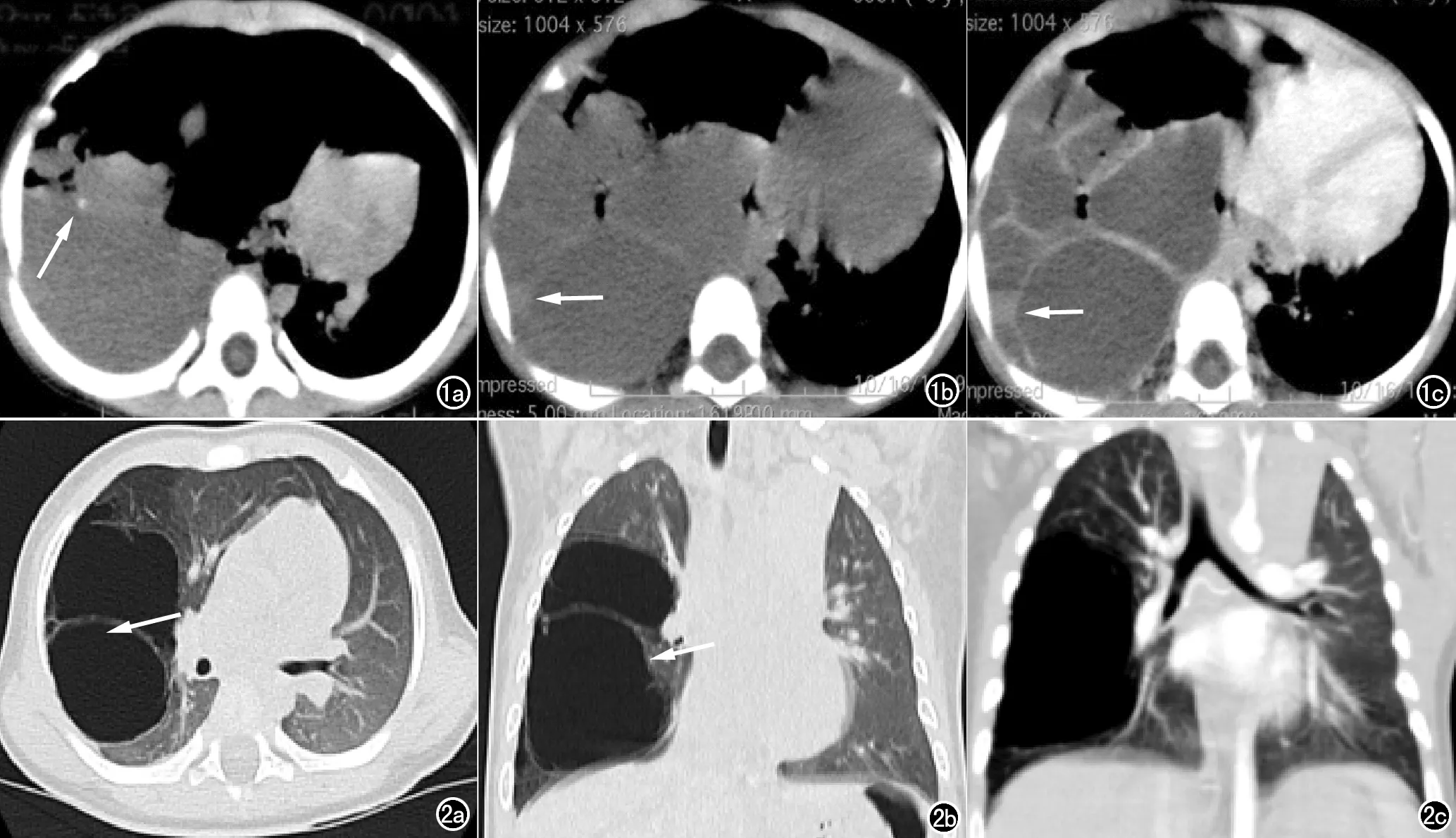
图1 女,1岁8个月,上呼吸道感染就诊。a) 右侧胸腔多房囊性占位(箭),其内充满液体,囊壁见钙化; b) 囊壁见覆壁稍高密度结节(箭); c) 增强扫描见间隔增厚、强化。病理诊断:右侧胸腔I型PPB。 图2 男,3个月,产前发现右肺囊腺瘤畸形,生后3个月出现发热、咳嗽。a) 右肺下叶巨大多房囊性病变; b) 囊壁菲薄,未见结节影; c) 增强扫描病灶未见强化。病理诊断:右肺下叶先天性肺气道畸形I型。
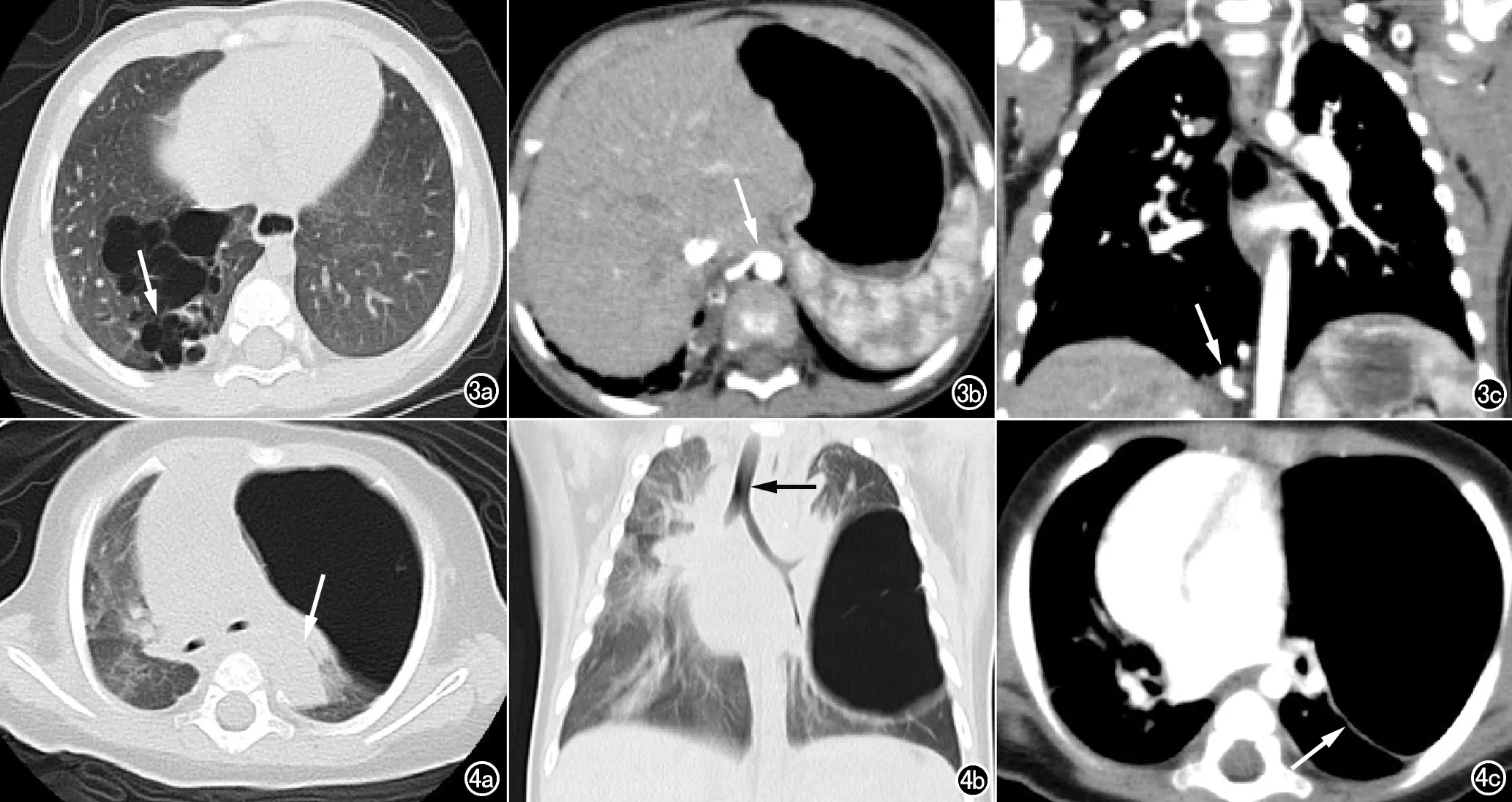
图3 女,10个月,孕24周发现右肺囊肿。a) 右肺下叶见多房小囊状结构; b) 增强扫描轴面见主动脉异常供血(箭); c) 增强冠状面示主动脉异常供血血管(箭)。病理诊断:右肺下叶隔离肺并先天性肺气道畸形Ⅱ型。 图4 女,4个月,上呼吸道感染就诊。a) 左肺上叶多房囊性占位; b) 囊壁及间隔菲薄,未见覆壁结节,占位效应显著,气管右移; c) 增强扫描囊壁可见轻度强化(箭)。病理诊断:先天性肺气道畸形Ⅳ型。
154例儿童肺部囊性病灶中Ⅰ型,Ⅱ型及Ⅳ型CPAM平均年龄分别为40.6±6.0月,32.7±4.2月,26.9±10.1月,I型PPB平均年龄18.3±18.6月。其中男(90例)占58.4%,女(64例)占41.6%。
126例(81.8%)儿童因出现症状而接受手术。临床症状包括上呼吸道感染(113/154,73.4%),气促(22/154,14.3%)和发绀(3/154,1.9%),1例(1/154,0.6%)出现腹痛呕吐。各型囊性CPAM与I型PPB在手术年龄(未遵循正态分布,采用H检验)、性别及临床症状(Pearson卡方检验)方面差异无统计学意义(表1)。

表1 Ⅰ型PPB与囊性CPAM临床与CT特征比较(n=154)
31.8%(49/154)病例有产前诊断肺内囊性病变史,其中11例(22.4%)为Ⅰ型CPAM,37例(75.6%)为Ⅱ型,1例(2.0%)为Ⅳ型,未见I型PPB病例。产前诊断史在儿童常见肺部良恶性囊肿比较中具有统计差异(P=0.000)。进一步多重比较(Bonferroni校正因子)提示Ⅱ型CPAM产前诊断率高于Ⅰ型PPB(P=0.003)。Ⅰ型(P=0.136)及Ⅳ型CPAM(P=1.000)在产前诊断率方面与I型PPB差异无统计学意义。
20.1%(31/154)的肺部囊性病灶儿童存在合并畸形。最常见的合并畸形是肺隔离症(bronchopulmonary sequestration,BPS)(17/154,11.0%),漏斗胸(10/154,6.5%)和先天性心脏病(5/154,3.2%),其次是支气管囊肿(2/154,1.3%)。儿童良、恶性囊性病变在合并畸形率上无统计学差异(P=0.000)。但进一步多重比较提示,Ⅰ型PPB与Ⅰ型(P=0.161)、Ⅱ型(P=0.453)及Ⅳ型(P=0.095)CPAM在合并畸形率方面差异有统计学差异。
1例PPB儿童具有家族史,哥哥为Ⅱ型PPB(本院手术确诊),姐姐为Ⅳ型CPAM(外院手术本院会诊病理确诊)。
154例儿童术后随访时间从2个月到11年,平均随访4.5年。所有儿童均存活,未见复发、转移病例。
2.CT表现
位置:左肺受累71例(46.1%),右肺受累83例(53.9%)。151例(151/154,98.1%)位于单个肺叶,4例(4/154,2.6%)累及一侧多个肺叶,未发现同时累及双肺病变。各型囊性CPAM与Ⅰ型PPB在病变位置之间差异无统计学差异(P=0.767)。
特征:9例I型PPB中1例(1/9,11.1%)囊壁出现钙化(图1a),2例(2/9,22.2%)出现囊壁结节(图1b)。145例囊性CPAM病例中未发现囊壁钙化及囊壁结节病例。
囊肿:囊肿存在于所有病例CT图像中。囊肿最大径范围从0.5~12.7cm,平均为(4.0±3.1)cm,中位数(四分位数)为3.1(5.9)cm。 其中,Ⅰ型,Ⅱ型和Ⅳ型CPAM及Ⅰ型PPB囊肿最大径分别为(4.7±2.0)cm,(1.6±0.8)cm,(7.9±2.8)cm和(9.2±2.9)cm。囊肿最大径值不服从正态分布,采用Kruskal-Wallis检验及事后多重比较。囊肿最大径在各型囊性CPAM及Ⅰ型PPB之间有统计学差异(P=0.000)。
Ⅱ型CPAM囊肿最大径最小;Ⅰ型CPAM,Ⅳ型CPAM与Ⅰ型PPB在囊肿最大径存在重叠。进一步多重比较显示,Ⅱ型CPAM囊肿直径较I型PPB小(P=0.000)。Ⅰ型(P=0.079)、Ⅳ型(P=1.000)CPAM与I型PPB在囊肿最大径之间差异无统计学意义(图5)。
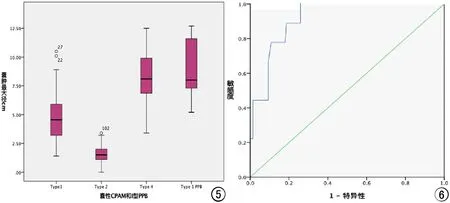
图5 囊肿最大径箱图。 图6 囊肿最大径鉴别良恶性病变ROC图。
以囊肿最大径为检验变量,绘制以囊肿最大径判断良性(Ⅰ、Ⅱ及Ⅳ型CPAM)及恶性(Ⅰ型PPB)囊肿的ROC曲线(图6)。ROC曲线下面积0.916,标准误0.033,具有较高诊断价值(曲线下面积>0.9),提示囊肿越大恶性可能性越大。当截距(囊肿最大径)为5.2cm时,约登指数(Youden index)为0.741,鉴别良、恶性囊肿敏感度100%,特异度74.1%。
感染:44.2%(68/154)儿童在CT图像上显示肺炎, 其中11例(29.6%)为Ⅰ型CPAM,39例(54.2%)为Ⅱ型,8例(42.1%)为Ⅳ型,5例(55.6%)为Ⅰ型PPB。儿童良恶性囊肿中合并肺炎发生率具有统计学差异(P=0.045)。进一步两两比较提示,Ⅰ型PPB与Ⅰ型(P=0.127)、Ⅱ型(P=0.937)及Ⅳ型CPAM(P=0.505)在合并感染频率方面之间差异无统计学意义。
纵隔移动及气胸:儿童肺部囊肿表现为纵隔移位和气胸的比例较小,发生率分别为20.1%及3.9%。
31例(20.1%)出现纵膈移动,其中7例(13.0%)为Ⅰ型CPAM,4例(5.6%)为Ⅱ型,14例(73.7%)为Ⅳ型,6例(66.7%)为Ⅰ型PPB。儿童肺部良恶性囊肿的比较中纵膈移动发生率差异具有统计学意义(P=0.000)。进一步两两比较提示,纵隔移动在Ⅰ型、Ⅱ型CPAM中发生率与Ⅰ型PPB差异有统计学差异(P=0.000,P=0.000),Ⅰ型PPB 纵膈移动的发生率高于Ⅰ及Ⅱ型CPAM;但Ⅳ型CPAM与Ⅰ型PPB之间差异无统计学意义(P=0.132)。
6例儿童出现气胸,其中5例(5/6,83.3%)为Ⅳ型CPAM,1例(1/6,16.7%)为Ⅰ型PPB。Ⅰ型、Ⅱ型CPAM未见合并气胸病例。儿童囊肿合并气胸频率差异具有统计学意义(P=0.000)。进一步两两比较发现,Ⅰ型PPB与Ⅰ、Ⅱ及Ⅳ型(P=0.143,P=0.111和P=0.144)之间差异无统计学意义。
讨 论
1.概述
PPB是一种罕见胚胎恶性肿瘤,占肺部原发性恶性肿瘤0.25%~0.5%,是10岁以前儿童最常见的肺部恶性肿瘤[6]。PPB与胚胎发育不良有关,由不同分化程度肿瘤性上皮管腔和胚胎性间叶成分构成,呈囊性或囊实性,容易累及胸膜。Dehner等[7]把PPB分为3型:Ⅰ型(多囊型)、Ⅱ型(多囊伴实性结节型)和Ⅲ型(实体型)。Ⅰ型PPB为单纯囊性肿物,是与先天性肺气道畸形(CPAM)相关的、最常见的儿童肺部恶性肿瘤。CPAM又称先天性囊腺瘤样畸形(congenital cystic adenomatoid malformations,CCAM),占胎儿期及儿童期全部肺部先天畸形的25%[8]。CPAM发病率为1/8300~35000活婴[5],近年来发病率有上升趋势[7]。Mut等[9]发现PPB可由先天性肺囊肿转化而来。Dosios等[10]报道1例CT诊断为“肺囊肿”患儿,8年后原有“囊肿”被肿块替代,术后证实为PPB。Nasr等[11]统计129例术前诊断为先天性囊性腺瘤样畸形(CCAM)的病例,其中2.3%术后证实为Ⅰ型PPB。Laberge等[12]报道肺囊性病变发展为恶性肿瘤发生率8.6%。尚不明确CPAM囊性病变从一开始就代表PPB,还是完全独立实体[13]。但可以确定的是Ⅰ型PPB处于从发育正常的肺囊肿演变成肿瘤过渡阶段。根据胎肺的起源,发育和病理学特征,Ⅳ型CPAM更被认为是Ⅰ型PPB相同病理实体。遗传学研究发现PPB患者常伴有双等位Dicer1胚系基因突变。Dicer1胚系基因突变及其导致的Dicer1蛋白缺失被认为是家族性PPB发生机制[14]25%患儿亲属有相同病症[15]。本研究1例PPB儿童具有阳性家族史(哥哥为Ⅱ型PPB,姐姐为Ⅳ型CPAM),与文献报道相似。为此,笔者建议所有具有CPAM家族史儿童应在条件许可条件下尽早手术。目前,我国尚未常规检测Dicer1胚系基因,影像学检查仍然是儿童肺部囊肿鉴别诊断首选且最为重要的手段。
CPAM平均发病年龄为7个月,男女发病率相当,主要表现为上呼吸道感染等症状[2]。Ⅰ型PPB的平均发病年龄为10个月,大部分在2岁以前被发现,临床上亦是以咳嗽、呼吸困难等上呼吸症状为主,与CPAM的临床表现非常相似。气胸被认为是Ⅰ型PPB一个相对特异的临床症状[16]。笔者资料中80%的气胸病例为Ⅳ型CPAM,20%为Ⅰ型PPB,暂未发现Ⅰ型及Ⅱ型CPAM儿童并发气胸病例。这可能与Ⅳ型CPAM和Ⅰ型PPB为外周肺泡组织/胸膜组织发生巨大囊性病变有关。病灶位于肺外周且体积较大的囊肿相对容易导致气胸。18% CPAM可合并其他先天异常[17]。合并的先天异常包括膈疝、肺隔离症(BPS)、肾发育不全以及心血管异常等且在Ⅱ型更为常见[18]。Priest等[19]发现12例PPB患者父母或年轻家属患有PPB或其他发育不良,瘤样变,恶性变如肺囊肿、肾囊肿、髓母细胞瘤、恶性生殖细胞瘤,霍奇金病非白血性白血病和朗格汉斯细胞组织细胞增生症等。虽然在合并畸形在Ⅱ型CPAM与Ⅰ型PPB之间差异无统计学差异,但Ⅱ型CPAM合并畸形(如膈疝,BPS等)与Ⅰ型PPB合并家族性疾病及发育不良的疾病谱不同,使得二者容易区分。本研究数据提示Ⅱ型CPAM的产前诊断率高于Ⅰ型PPB,推测可能是由于Ⅱ型CPAM的发病率较Ⅰ型PPB高的缘故;亦可能是由于Ⅰ型PPB还处于Ⅳ型CPAM发展的早期阶段的缘故。本资料表明在年龄、性别、临床症状等方面,囊性CPAM与Ⅰ型PPB均无统计学差异,即笔者无法从临床资料上对儿童肺部良恶性囊肿进行鉴别。
CPAM儿童接受手术切除病灶的年龄最具争议。普遍认为CPAM的手术年龄必须权衡肺的代偿性生长[20],合并感染[21],最为重要的是避免进一步发展为Ⅰ型PPB[2]的可能性。临床工作中Ⅰ型PPB与CPAM存在诸多重叠,极易误诊及漏诊。Ⅰ型PPB患儿临床治愈率高达80%~95%;若任其发展为囊实性(Ⅱ型)或实性(Ⅲ型),其治愈率降至45%~60%[22-23]。鉴于Ⅰ型PPB治愈率较高的特点,儿童肺部良恶性囊性病变的鉴别诊断的临床意义显得尤为重要。当儿童被确诊为Ⅰ型PPB或在病理上无法与Ⅳ型CPAM相鉴别时,鉴于其复杂的生物学行为,应术后的第3个月、6个月、1年复查1次胸部CT且持续时间至少为36个月。本院154例儿童肺部囊肿病例,术后随访时间从2个月到11年,未见恶变及复发病例。
2.Ⅰ型PPB与囊性CPAM的鉴别诊断
CT是儿童肺部性病变诊断及鉴别诊断首选的检查方法,在CPAM的阳性率及准确率高达100%及95.1%[24]。李航等[25]报道PPB有左侧好发的趋势,但本研究暂未发现CPAM及Ⅰ型PPB存在左侧优势。Hill等[21]发现对PPB具有诊断意义的原始胚瘤样细胞呈局限性分布且分布不均匀,认为局限性隔膜增厚对诊断很有帮助。为此,充分病理取材也是诊断Ⅰ型PPB的关键。由于Ⅰ型PPB与Ⅳ型CPAM在病理上存在重叠,不推荐穿刺活检。CT分隔增厚及囊壁结节被认为是恶性囊肿的特征,但阳性率低(22.2%)且如何量化分隔厚度亦存在困难。部分结节还可能由于密度过低而出现漏诊。笔者认为细致读片和多窗宽窗位观察对发现囊壁增厚及结节很重要。2006年,PPB国际研究组织病理学家发现PPB还有一种新的类型即Ⅰ型退化型[23]。Ⅰ型退化型具有无恶性细胞的纤细间隔,可有非原始的星状细胞及营养不良性钙化灶。但8%的退化型PPB可发展为Ⅱ型及Ⅲ型PPB[5]。笔者在1例PPB的囊壁中观察到钙化(11.1%)且145例囊性CPAM未见囊壁钙化病例,推测囊壁钙化可能提示为退化型PPB,是Ⅰ型PPB另外一个重要的CT特征。
Ⅱ型CPAM由大小较为一致的小囊肿组成,且当囊肿最大径<2.5 cm时[26],Ⅱ型CPAM的可能性最大;而Ⅰ型、Ⅳ型及Ⅰ型PPB均表现为肺内多房性大囊肿,鉴别诊断困难。考虑到囊肿大小、合并感染及恶变的几率均是儿童肺部囊肿手术的重要指征,而较大的囊肿理论上也更容易合并感染、气胸等并发症。若不能从影像征象(囊壁增厚、结节)中对儿童肺部良恶性囊肿进行鉴别,笔者可以以囊肿最大径为依据,同时考虑到临床症状发生率、合并症及恶性几率等,综合指导儿童肺部囊肿的手术时间,最大程度上减少并发症及降低恶变为PPB的几率。本研究81.8%的儿童出现临床症状而行CT检查;20.1%发现纵隔移位和3.9%出现气胸。若笔者以囊肿直径>5.2 cm作为手术切除囊肿的阈值,诊断Ⅰ型PPB的敏感度高达100%,特异度74.1%,同时亦具有较高的症状阳性率及较低的并发症发生率,可以作为临床儿童肺部囊性病灶手术切除的阈值。
鉴于放射剂量的考虑,大部分儿童胸部CT不建议增强扫描。但在儿童肺部良恶性囊肿的鉴别诊断中,增强扫描确具有十分重要的作用。首先,增强扫描可以更好地区分肺炎、实变肺组织和压迫性肺不张。合并感染是儿童肺部囊性病变常见的CT征象之一,发生率约44.2%。与Ⅳ型CPAM相似(平均值为7.9 cm),Ⅰ型PPB的囊肿最大径较大(平均值9.2 cm)且好发于周围肺泡组织或胸膜组织,较Ⅰ及Ⅱ型CPAM更容易出现压迫性肺不张、纵膈移位等继发征象。其次,增强扫描可以发现囊壁内是否存在强化的间隔或结节,这也是儿童肺部良恶性囊肿较为重要征象之一。当然,良性囊肿合并感染时囊壁亦可以增厚强化,但囊肿合并感染很少出现囊壁结节。此时,短期复查就显得尤为重要。最后,增强扫描可以更好地检测肺内并发畸形如BPS、支气管囊肿等。而肺内囊性病变合并相关畸形是Ⅱ型CPAM的可能性更大。为此,笔者建议在儿童肺部囊性病变CT诊断需要进行至少1次增强扫描。
Ⅰ型PPB及囊性CPAM是儿童期最常见的肺部囊肿。胸部CT是诊断儿童肺部囊肿最重要的方法。囊壁出现钙化及囊壁结节时应高度怀疑Ⅰ型PPB的可能。鉴于Ⅰ型PPB与囊性CPAM在临床症状、影像表现及病理诊断均很难鉴别,笔者建议当儿童肺内囊肿直径>5.3 cm时,应积极处理,降低囊性CPAM发展为Ⅰ型PPB可能性。
