基于18F-FDG PET影像组学区分结节/肿块性肺结核与非小细胞肺癌
2021-06-21周见远邹思娟汤明朱小华
周见远, 邹思娟, 汤明, 朱小华
肺癌是中国乃至世界范围内最为致命的肿瘤之一,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占比超过85%。NSCLC的生存期主要取决于初诊时的肿瘤分期,其晚期5年生存率低于5%[1]。因此,早期诊断和准确分期对于NSCLC治疗尤为重要。在诸多非侵入性检查方法中18F-FDG PET/CT是NSCLC诊断和分期的重要手段[2],然而,在NSCLC临床实践中仍存在诸多假阳性[3,4]。其中,结节性或肿块性肺结核(pulmonary tuberculosis,PTB)可能表现出类似NSCLC的形态学和FDG代谢特征,使二者鉴别诊断存在困难。据报道在结核流行地区PTB使得NSCLC的假阳性率高达57.1%~92%[5]。由于最大标准化摄取值(maximum standarduptakevalue,SUVmax)在结核和恶性病变之间存在重叠且难以反映肿瘤内部丰富的空间代谢信息,限制了18F-FDG PET/CT的诊断特异性。影像组学从医学图像中高通量提取信息,量化病灶特征,从而成为影像学标志物[6]。近期多篇基于CT影像组学的研究尝试区分良恶性肺结节[7,8],不过利用FDG PET影像组学鉴别PTB与NSCLC研究报道有限[9]。
本研究探讨PTB和NSCLC的FDG代谢差异的影像组学特征,以提高对PTB和NSCLC的鉴别助力临床治疗决策。
材料与方法
1.研究对象
回顾2017年7月至2020年8月本院行18F-FDG PET/CT的肺结节或肿块患者2854例。纳入标准:①首发症状为肺结节或肿块;②病历资料保留;③疾病诊断明确为NSCLC(腺癌和鳞癌)和PTB。初步筛选1304例患者,随后排除以下病例:①肺内多发结节或肿块(682例);②肺部病灶直径<1cm(156例);③纯磨玻璃结节(99例);④PET/CT前行抗肿瘤治疗(134例);⑤伴发其他系统肿瘤(13例);⑥肺癌合并肺结核(2例)。最终共218例NSCLC(n = 178)和PTB(n = 40)纳入研究。本研究符合《赫尔辛基宣言》原则。
2.18F-FDG PET/CT显像
以欧洲核医学协会(European Association of Nuclear Medicine,EANM)肿瘤成像程序2.0版指南作为标准图像采集协议[10]。使用GE Discovery Elite 690型 PET/CT行全身PET/CT 断层显像。检查前患者空腹6 h以上,血糖≤11.1 mmol/L。每位患者静脉注射3.7MBq/kg18F-FDG(由住友回旋加速器及FDG合成模块制备,放化纯>95%),注射药物无外渗,静息60 min后显像。扫描范围自颅底至股骨中段,5~7个床位,2 min/床位,重建矩阵128×128。PET图像行衰减校正及迭代法重建。CT扫描参数:管电压120 kV,管电流120 mA,层厚3.75 mm,重建矩阵512×512。两位有经验核医学医师行18F-FDG PET/CT图像处理。勾画出肺部病灶ROI,采用固定阈值法,以SUVmax 40%作为阈值,在横断面、矢状面及冠状面上对病灶进行容积分割得出原发病灶SUVmax。
3.影像组学特征提取
利用3D slicer软件(www.slicer.org)对18F-FDG PET图像实现半自动分割,勾画出原发病灶3D感兴趣区。两名研究者进行感兴趣区勾画和特征提取,检验感兴趣勾画和特征提取可靠性。随机选择50个病例进行感兴趣区勾画,其中第二名研究者在>2周的时间间隔内分别进行前后两次勾画。随后,通过组内相关系数(intraclass correlation coefficient,ICC)分别计算观察者间和观察者内一致性,评估其可靠性。
利用Python(www.radiomics.io)软件提取影像组学特征。首先,使用wavelet 和LoG(Laplacian of Gaussian)滤波器分别对原始图像进行处理,进一步从PET原始图像和衍生图像中分别提取影像组学特征。其中,形状特征仅能从原始图像中提取,而其他类型特征则可同时从原始图像和衍生图像中分别提取。特征包括一阶特征(first order statistics)、形状特征(shape)、灰度共生矩阵(gray level cooccurrence matrix,GLCM)、灰度游程长度矩阵(gray level run length matrix,GLRLM)、灰度区域大小矩阵(gray level size zone matrix,GLSZM)、灰度依赖矩阵(gray level dependece matrix,GLDM)。
4.影像组学特征选择和组学标签构建
先后通过最大相关性最小冗余算法(maximum relevance minimum redundancy,mRMR)和最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)进行数据降维,减少冗余特征,优化拟合模型。①利用mRMR算法对训练集中每个特征的相关性和冗余性进行综合排序,选取前50个最重要特征作为候选特征。②对上述50个特征进行LASSO回归运算,随着调节参数lambda(λ)的增加变量系数绝对值降低直至为零,选取变量随之减少。③基于训练集LASSO回归结果构建影像组学标签(radiomics signature score,Rad-score)。④利用多因素logistic回归筛选独立影响因素进一步构建复合模型。
利用受试者工作特征(receiver operator characteristics analysis,ROC)曲线评估和比较SUVmax、模型或变量辨别病理类型的能力。根据Rad-score和临床变量数据勾画列线图直观反映个体化预测模型并进一步使用校正曲线和Hosmer-Lemeshow test检验预测模型拟合优度。
5.统计分析
所有数据统计分析通过R语言(http://www.r-project.org)实现。使用“mRMRe”包进行mMRM分析;“glmnet”包实现LASSO回归分析;“pROC”包实现 ROC曲线分析。使用组内ICC评价观察者间和观察者内一致性;组间差异使用Mann-WhitneyU或卡方检验;多因素logistics回归分析各变量与病理类型的关系;ROC曲线计算模型曲线下面积(area under curve,AUC)、灵敏度、特异性。Delong test比较不同模型之间AUC值是否存在显著性差异。以P<0.05为差异有统计学意义。
结 果
1.研究人群基线特征(表1)

表1 纳入人群基线临床特征
共纳入PTB和NSCLC患者218例,其中男132(60.55%)例,女86(39.45%)例;年龄57(26~82)岁;
癌胚抗原(carcinoma embryonic antigen,CEA):2.8(0.5~1512) ng/mL(参考值范围0~5 ng/mL),其中PTB:2.07(0.8~6.84) ng/mL,NSCLC:3.02(0.5~1512) ng/mL;鳞状细胞癌抗原(squamous cell carcinoma antigen,SCCAg):0.9(0.2~18.8) g/mL(参考值范围≤1.5 g/mL),其中PTB:0.8(0.3~1.4) g/mL,NSCLC:0.9(0.2~18.8) g/mL;病理类型:PTB 40(18.35%)例,NSCLC 178(81.65%)例[腺癌126(57.80%)例,鳞癌52(23.85%)例]。按照1:1比例将数据随机分为训练集(总计109例;PTB 21例;NSCLC 88例)和验证集(总计109例;PTB 19例;NSCLC 90例)。
2.影像组学特征选择
总计提取1132个PET影像组学特征。对观察者间和观察者内特征提取的一致性进行评估,结果显示ICC值范围分别0.951~0.999和0.976~0.999,表明具有较强可靠性和可重复性。mRMR算法综合排序并保留前50个特征作为候选特征。在LASSO回归算法中笔者通过10折交叉验证选择lambda(λ), 随着log(λ)从-10减小至0,进入模型的变量数减少。
当λ=0.0759、log(λ)为-2.578时,LASSO回归模型表现出最佳的预测性能(图1),选择具有非零系数的两个特征log.sigma.2.0.mm.3D_glcm_Correlation、wavelet.HLL_glcm_Correlation。二者均为为灰度共生矩阵中的纹理特征。NSCLC的上述两个组学特征值均显著高于PTB(P<0.05,表2)。

表2 基于LASSO回归选择影像组学特征在PTB和NSCLC之间的差异

图1 使用LASSO回归进行影像组学特征选择。a) 通过10折交叉验证来选择lambda(λ)。随着log(λ)从-10变为0,进入模型的变量数减少,变量系数的绝对值向零下降。当λ等于0.0759、log(λ)为-2.578时,LASSO回归模型表现出最佳的预测性能, 此时2个影像组学特征被选择; b) 50个候选影像组学特征的LASSO系数纳入路径图。 图2 数据集中每位患者影像组学标签评分。总体而言,非小细胞肺癌患者标签评分显著高于肺结核患者(P<0.001)。
3.组学标签构建与模型评价
基于上述选择的两个影像组学特征,计算每位患者Rad-score,其公式如下:
Rad-score=-2.667698+wavelet.HLL_glcm_Correlation×1.055339+log.sigma.2.0.mm.3D_glcm_Correlation×8.918025
总体而言,PTB比NSCLC具有较低的Rad-score值(训练集:Z=-5.878,P<0.001;验证集:Z=-5.711,P<0.001;图2、表2)。图3~5显示典型的PTB和NSCLC(鳞癌和腺癌)患者PET/CT图像和灰度直方图。其中,图3为肺结核患者图像,具有较低的影像组学评分和欠均匀的灰度分布。图4为肺鳞癌患者图像,具有较高的影像组学评分和较为均匀的灰度分布。图5为肺腺癌患者图像,同样具有较高的影像组学评分和均匀的灰度分布。ROC曲线分析显示Rad-score在训练集和验证集的AUC分别为0.914 (95%CI,0.845~0.959)和0.918 (95%CI,0.850~0.962)。与此相比,年龄的AUC值鉴别能力较低,分别为0.811(训练集)、0.740(验证集),其余临床变量的AUC值低于年龄,分别为[训练集:AUC(性别、吸烟、SCCag、CEA)=0.487、0.525、0.554、0.704;验证集:AUC(性别、吸烟、SCCag、CEA)=0.428、0.494、0.594、0.637]。
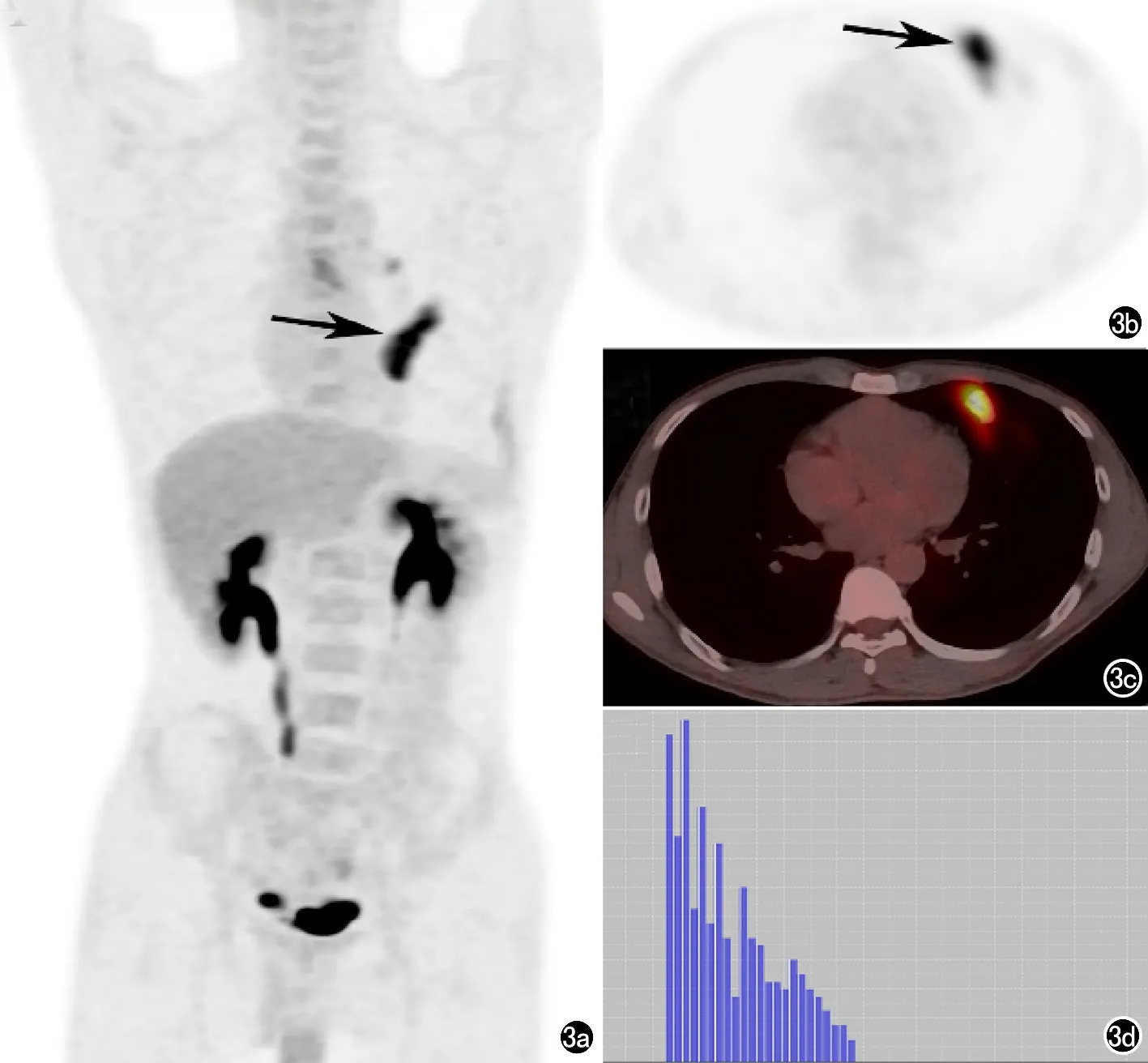
图3 肺结核患者18F-FDG PET/CT显像及对应灰度直方图。患者,男,38岁,病理诊断为肺结核,18F-FDG PET/CT显像左肺上叶肿块(箭),放射性摄取增高,SUVmax 9.7,Rad-score 0.603,灰度直方图分布不均匀。a) E & I MIP图; b) F & J PET图; c) G & K 融合图; d) H & L 病灶灰度直方图。
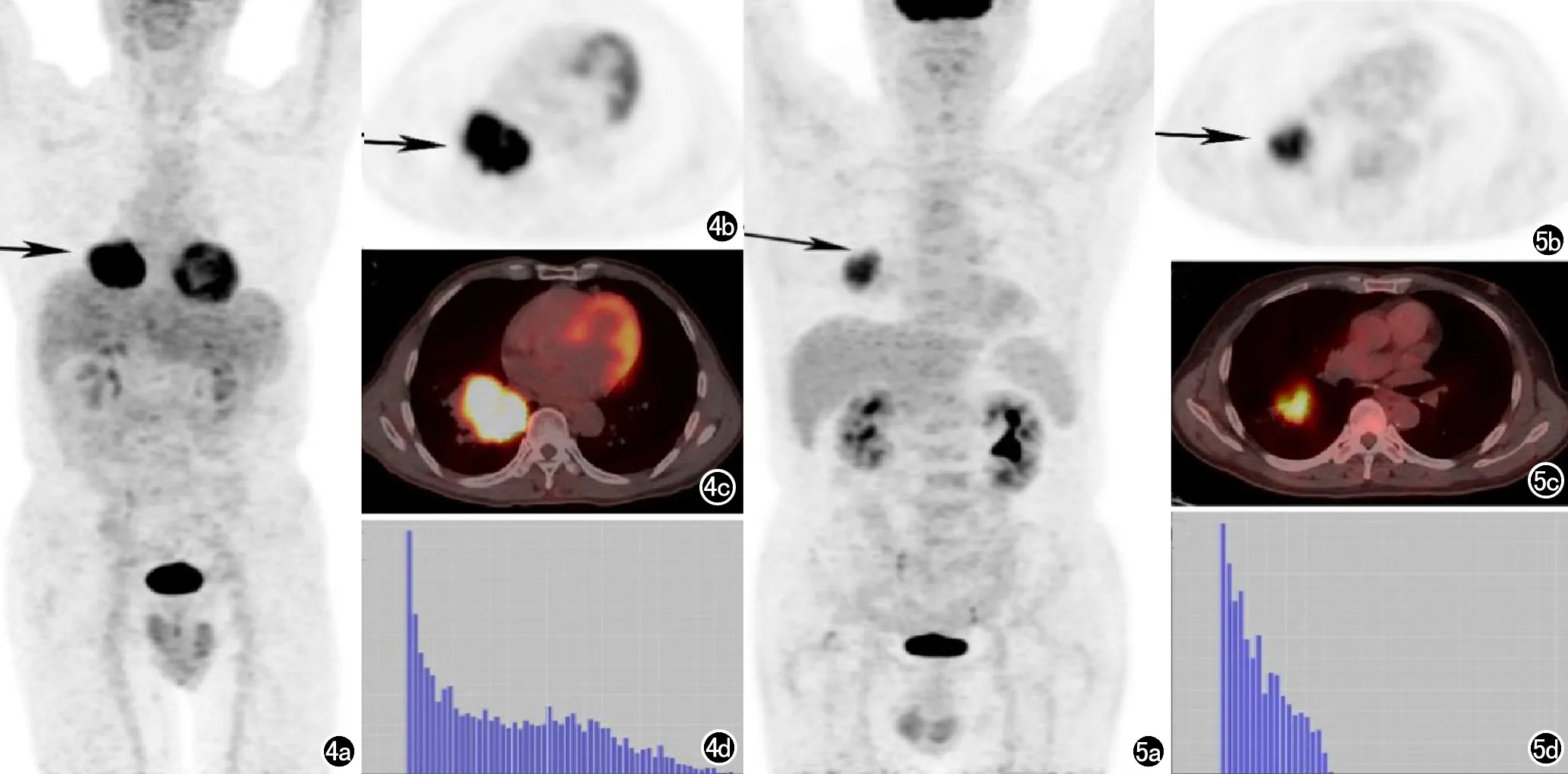
图4 肺鳞癌患者18F-FDG PET/CT显像及对应灰度直方图。患者,男,71岁,病理诊断为肺鳞癌,18F-FDG PET/CT显像右肺下叶软组织肿块(箭),SUVmax:20.3,Rad-score:3.210,灰度直方图分布较为均匀。a) MIP图; b) PET图;c) 融合图;d) 病灶灰度直方图。 图5 肺腺癌患者18F-FDG PET/CT显像及对应灰度直方图。患者,男,68岁,病理诊断为肺腺癌,18F-FDG PET/CT显像右肺下叶软组织肿块(箭),SUVmax 8.1,Rad-score 2.867,灰度分布较为均匀。a) MIP图; b) PET图; c) 融合图; d) 病灶灰度直方图。
利用ROC曲线计算SUVmax区分NSCLC和PTB的最佳临界值为4.4,灵敏度85.39%,特异度57.5%。与之相比,影像组学诊断效能高于SUVmax(Z=3.953,P<0.001)。
将训练集Rad-score和临床变量纳入多因素logistic回归研究病理类型影响因素,结果表明仅Rad-score(P<0.001)和年龄(P=0.006)是病理类型的独立影响因素(表3),而性别(P=0.588)、吸烟史(P=0.659)等因素均不是独立影响因素。
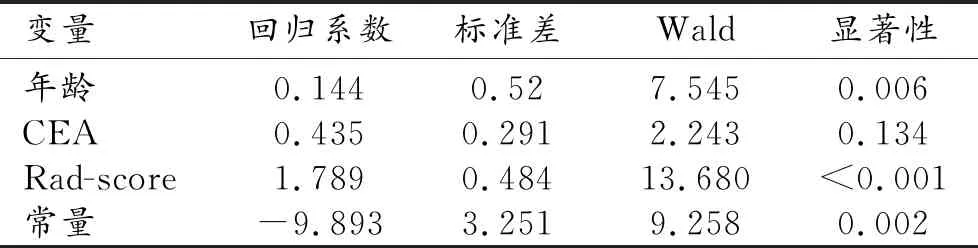
表3 预测病理类型多因素logistic回归
综合影像组学标签和临床变量(年龄、CEA)构建复合模型。复合模型区分PTB和NSCLC的AUC值分别为[训练集:AUC=0.955 (95%CI,0.897~0.985);验证集:AUC=0.928 (95%CI,0.862~0.969)],其余模型或变量诊断效能见表4。根据Delong检验结果,训练集和验证集复合模型AUC值均显著高于SUVmax(训练集:Z=3.930,P<0.001;验证集:Z=2.512,P=0.012)、临床变量(训练集:Z=3.528,P<0.001;验证集:Z=2.926,P<0.003)。进一步勾画列线图和校正曲线,直观反映个体化预测模型;图6绘制了训练集和验证集组学列线图的校正曲线。Hosmer-Lemeshow检验模型的拟合优度为训练集χ2=3.478,P=0.901;验证集χ2=4.093,P=0.849。

表4 不同变量和模型辨别PTB和NSCLC的能力

图6 a) 通过训练集构建的影像组学列线图,经统计分析得出列线图由组学标签、年龄、CEA组成,可以预测肺病灶病理类型; b、c) 训练集和验证集影像组学列线图预测非小细胞肺癌的校正曲线。
讨 论
18F-FDG PET/CT被公认为是NSCLC诊断和分期的重要工具[11]。然而,感染与非感染性炎症也往往表现出18F-FDG高摄取[12]。尤其在结核病流行地区,PTB是NSCLC假阳性诊断的重要原因。Li等[13]应用FDG PET诊断肺结节良恶性发现超过一半的假阳性源于PTB。Sathekge等[14]认为肺癌的代谢特征难以与PTB进行区分,使用SUVmax 2.5阈值诊断特异度仅为25%。古等[15]证实无论使用定性指标(是否高于纵隔血池)或定量指标(SUVmax 2.5)均难以区分结节/肿块型PTB和肺癌。本研究中利用ROC曲线获得SUVmax的最佳临界值4.4,灵敏度85.39%,特异性57.5%。与此相比,影像组学诊断效能优于SUVmax(Z=4.026,P=0.0001)。另外,SUVmax难以反映肿瘤内空间代谢状况,通过肉眼也很难准确识别结核和肺癌的代谢异质性,而本研究影像组学特征能够有效捕捉这些表型差异,并进行量化。
目前,多个基于CT图像的影像组学研究能够有效鉴别良恶性肺结节[7,8],Du等[9]运用FDG PET/CT影像组学能有效区分孤立性PTB和腺癌(AUC=0.861、 0.889)。但是,单独运用PET影像组学诊断效能如何,腺癌和鳞癌一并是否可以取得类似的鉴别效能仍不明确。本研究组学标签由wavelet.HLL_glcm_Correlation和log.sigma.2.0.mm.3D_glcm_Correlation两个特征组成。glcm_Correlation通过计算图像中一定距离和方向灰度之间相关性,度量局部灰度相似程度,值越大同质性程度越高。本研究中PTB的glcm_Correlation显著低于NSCLC, 表明NSCLC局部灰度相似程度更高,而PTB具有较高的代谢异质性。PTB的异质性特征可能与其病理形成机制和细胞组成有关[16]。研究表明阳性显像的PTB是以增殖性病变为主,且巨噬细胞和淋巴细胞是结核肉芽肿18F-FDG高摄取的主要原因[5]。随着疾病发展病灶中央出现干酪样物质,边缘有炎症细胞浸润及包膜形成。干酪样坏死和病灶边缘肉芽组织的比例和空间分布将影响FDG代谢模式,干酪样坏死呈现低代谢特征,而周围上皮样细胞、炎性细胞等边缘肉芽组织则为显著高代谢,从而可能造成PET图像上PTB局部灰度异质性增高。本研究纳入的40例PTB病例中36例病理表现为典型的慢性肉芽肿性炎,其中, 26/36出现了明显的干酪样坏死、纤维化、玻璃样变性等组织改变,这将引起结核肉芽肿局部高、低代谢不同的异质性表现,而这些异质性表现则可能造成glcm_Correlation特征值的降低。虽然肺癌病灶内也可因肿瘤中心缺血、缺氧和坏死而形成FDG代谢异质性,但更多出现在大体积鳞癌,而本研究中仅2/52鳞癌病理出现大量坏死。
本研究中影像组学标签在训练集和验证集均有良好的鉴别诊断能力,AUC值超过0.9,初步表明影像组学标签在单中心研究中取得了优异的辨别能力。另外,复合模型进一步提高了诊断效能(AUC=0.954、0.928),其较高的特异度(95.24%、100.00%)有望降低结核引起的PET/CT诊断NSCLC高假阳性率的限制。总之,影像组学标签和复合模型能提升影像鉴别的准确性,有效区分结节性或肿块性PTB和NSCLC且具有较好的模型泛化能力。
本研究为单中心回顾性分析,有限的PTB样本量可能造成统计学偏倚,难以进行不同大小病灶分层分析,且尚需要进行外部验证。今后将利用深度学习、卷积神经网络、随机森林等算法,进一步挖掘和利用病历、影像学资料,优化诊断模型。
