阿胶蛋白质组学研究
2021-06-18樊雨梅
廖 峰,樊雨梅,帖 航,苏 宁,
(1.国家胶类中药工程技术研究中心,东阿阿胶股份有限公司,山东聊城 252201;2.中国检验检疫科学研究院,北京 100176)
阿胶(Colla Corii Asini,CCA)为马科动物驴(Equus asinusL.)的干燥皮或鲜皮经煎煮、浓缩制成的固体胶[1],已有2000多年的使用历史。阿胶内含丰富的生物活性物质,其中包括硫酸皮肤素、胶原蛋白和多肽等,且蛋白质是阿胶的主要成分,含量70%~90%[2]。经现代药理研究证明,阿胶具有治疗贫血[3]、辅助治疗肿瘤[4]、提高免疫力[5-6]、抑菌[7]、抗炎[8]、抗衰老[9]和抗疲劳[10]等功效。但目前对阿胶的功效研究都是基于全阿胶的药理药效学研究,对阿胶发挥作用的分子机制、功效物质基础研究较少。阿胶因生物利用度较低易存在“滋腻碍胃”的现象,对一些适应症人群的疗效并不显著。因此,识别阿胶发挥功效的物质基础对阿胶的二次开发就显得尤为重要。
近年来,阿胶功效物质的分离与识别引起了广泛的关注。李辉等[10]利用动物实验证实药效氨基酸和胶原蛋白肽是阿胶发挥抗疲劳和提高运动耐力作用的物质基础。李笑尘等[11]通过色谱和质谱技术识别出阿胶抗氧化肽。吴宏忠教授团队[12-13]经过研究发现,阿胶经体外模拟消化后的活性产物A和B是阿胶有效补血的活性成分。肖黎等[14-15]证实阿胶酶解产物有助于预防和治疗阿尔茨海默症、促进伤口愈合、防止UVA造成的胶原蛋白合成减少和皱纹产生。可见,胶原蛋白及其水解产物是阿胶发挥功效的主要物质。利用阿胶胶原蛋白开发生物活性肽是改善阿胶“滋腻碍胃”与提升阿胶功效的途径之一。利用在线数据工具平台虚拟筛选阿胶生物活性肽能够解决传统筛选方法周期长且成本高等不足,但需明确阿胶蛋白的氨基酸序列。目前,关于阿胶所含的功能蛋白报道较少。应用蛋白组学技术对阿胶的研究主要是集中在阿胶特征分子离子峰的识别,用于阿胶质量控制和掺伪识别[16-17],而采用蛋白质组学对阿胶蛋白成分的分析研究,相关报道较少。王若光等[18]利用激光解析/离子化-飞行时间质谱技术对阿胶蛋白进行了初步分析,建立了阿胶蛋白质量指纹图。房芳等[19]采用鸟枪蛋白质组学方法,发现阿胶含有胶原蛋白、肌球蛋白、血红蛋白、血影蛋白等7种具有代表性的蛋白质,李雪[20]发现阿胶含有角蛋白、白蛋白和纤维蛋白等非胶原蛋白。但是,并没有全面分析阿胶蛋白的组成。因此,为全面了解阿胶的蛋白质组成,明确阿胶发挥功效作用的物质基础,利用高分辨质谱分析阿胶蛋白质组成,并通过基因本体论(Gene Ontology,GO)分类法对检测到的蛋白质进行归类,揭示阿胶蛋白生物学功能,为今后阿胶的二次开发、功效作用机制和功效作用物质基础的研究提供一定的试验基础。
1 材料与方法
1.1 材料与仪器
阿胶(批号:1707038) 东阿阿胶股份有限公司;乙腈、甲醇、甲酸 均为质谱纯,百灵威科技有限公司;尿素、考马斯亮蓝R-250(生物级)、二硫苏糖醇、十二烷基硫酸钠 北京索莱宝科技有限公司;Trisbase 美国阿拉丁公司;SDS-PAGE电泳Marker、Modified Trypsin(Sequencing Grade,Promega) 美国Bio-Rad公司。
三合一高分辨质谱仪(Orbitrap Fusion Lumos Tribrid) 美国Thermo公司;SDS-PAGE电泳仪(Mini Protean 3 Cell) 美国Bio-Rad公司。
1.2 实验方法
1.2.1 阿胶前处理 精密称取粉碎后的阿胶粉末10.0000 g,加入80 mL超纯水,于60 ℃水浴震荡30 min,使样品充分溶解,待样品冷却至室温后转移至100 mL容量瓶中,并用超纯水稀释至刻度线,10000 r/min 离心30 min,取中间层澄清溶液,即为10%(w/v)阿胶溶液。
1.2.2 SDS-PAGE电泳 根据郑洁[21]的方法稍作修改。10%(w/v)阿胶溶液稀释10倍后,加入等量的含二硫苏糖醇的 2×Loading Buffer缓冲液,充分混匀,沸水浴5 min。浓缩胶质量分数为5%,分离胶12%。上样量为10 μL,将凝胶扫描电子图谱保存,电泳所用的marker分子量范围在10~250 kDa。
1.2.3 蛋白质组成分析 阿胶溶液经SDS-PAGE分离后,用考马斯亮蓝R-250染色,将条带对半切开,转移至 EP 管中。随后进行胶条的脱色与酶切,方法参考文献[21]。浓缩液与基质混合后,采用高分辨质谱仪进行质谱检测与数据采集。
液相条件:Dr.Maisch C18-AQ色谱柱(1.9 μm,120 Å;ID 150 μm,length 15 cm);流速3 μL/min;上样体积15 μL;流动相A为0.1%甲酸水溶液;流动相B为0.1%甲酸/90%乙腈溶液;分离梯度:7%B(0 min),15% B(11 min),25% B(48 min),40%B(68 min),100% B(69 min),100% B(75 min)。
质谱参数:离子源类型为纳喷电离源(NSI),正离子扫描模式,喷雾电压为2000 V,毛细管温度为320 ℃;扫描模式:全扫描/数据依赖二级扫描(Full MS/dd-MS2);一级质谱参数设置:分析器为静电场轨道阱,扫描范围300~1400 m/z,分辨率为12000,最大喷射时间50 ms,自动增益控制目标(AGC target)500000;二级质谱参数设置:分析器为离子阱,最大喷射时间35 ms,AGC target为5000。
利用Mascot软件的SwissPort数据库进行搜索。检索分类(Taxonomy)为Equus caballus,酶解过程采用的酶为胰蛋白酶,最大允许错切位点为1,固定修饰设置为Carbamidomethyl(半胱氨酸),可变修饰设置为Oxidation(甲硫氨酸),质谱容差为0.2 Da。Mascot检索P<0.05的结果被认为鉴定成功。
1.2.4 利用GO法对蛋白进行归类 通过GO法对已检测蛋白质分别以其分子功能(Molecular Function,MF)、生物学过程(Biological Process,BP)和细胞组成(Cell Component,CC)三种方式进行归类,揭示阿胶蛋白生物学功能。再对阿胶蛋白进行KEGG通路分析,寻找阿胶蛋白集中的生物学信号通路。
2 结果与分析
2.1 SDS-PAGE电泳
阿胶的SDS-PAGE电泳分析结果如图1所示,阿胶中的蛋白质分子量在10~250 kDa之间呈弥散性分布。郑洁[21]、董芯锌[22]也报道阿胶蛋白在10~250 kDa区域内呈弥散分布。这可能是由于加工过程中蛋白质降解程度偏低、且降解不均一,没有形成清晰的条带导致的。因阿胶加工过程中一般使用高温蒸煮,导致蛋白质水解不彻底,使蛋白质分子呈弥散型。

图1 阿胶蛋白SDS-PAGE电泳图Fig.1 SDS-PAGE of CCA
2.2 质谱检测结果
利用SDS-PAGE分离得到的阿胶蛋白胶条,经胰蛋白酶酶解消化后,用高分辨质谱进行蛋白质组成鉴定,将得到的多肽片段指纹图谱(见图2)导入MASCOT数据库中,阿胶总共查到370种蛋白质,其中有54种未命名蛋白,316种已命名蛋白。316种已命名蛋白包括已被报道的36种组蛋白、29种角蛋白、23种肌球蛋白、13种胶原蛋白(6种胶原蛋白α1(I)和7种胶原蛋白α2(I))、4种磷脂结合蛋白、2种血清白蛋白、2种血红蛋白、2种脂肪酸结合蛋白、1种核(纤)层蛋白[14,19]。有204 种(约占总识别蛋白的64.56%)蛋白首次在阿胶中报道出来,其中包括67种免疫λ轻链可变区片段和13种α1-抗胰蛋白酶,其余的124种首次报道的阿胶蛋白见表1。但是,并没有识别出房芳等[19]报道的血影蛋白,后续需进一步改善阿胶蛋白组成的检测条件。
本文利用三合一高分辨质谱技术分析阿胶蛋白的组成,研究发现阿胶富含多种活性蛋白,反应了阿胶的多靶点作用。核心蛋白聚糖、双糖链蛋白聚糖、Lumican和纤调蛋白是阿胶含有的富含亮氨酸小分子蛋白聚糖的家族成员,在细胞增殖、迁移、凋亡,肿瘤的生长、黏附等方面具有关键作用[23]。核心蛋白聚糖和双糖链蛋白聚糖不仅可作为细胞外基质成分参与肾脏纤维化,而且还能通过与生长因子TGF-β、I型胶原等相关作用调节纤维化的进展[24]。这可能与加味黄连阿胶汤延缓顺铂化疗导致的肾损害向纤维化发展进程的机制有关[25]。Lumican可能与阿胶作为癌症放化疗时辅助应用延长带瘤生存的功效有关[26-27]。皮肤桥蛋白可与胶原纤维、核心糖蛋白、TGF-β等信号因子相互作用调节骨形成与骨损伤修复[28]。Osteoglycin可促进骨前体细胞向成骨细胞分化与促进成骨细胞成熟及骨形成[29]。这两种蛋白可能是阿胶在骨愈合早期、中期促进软骨细胞、成骨细胞的增殖及合成活性,促进骨愈合的物质基础[30]。
图2 阿胶酶解肽段的总离子流图Fig.2 Total ion chromatogram of CCA
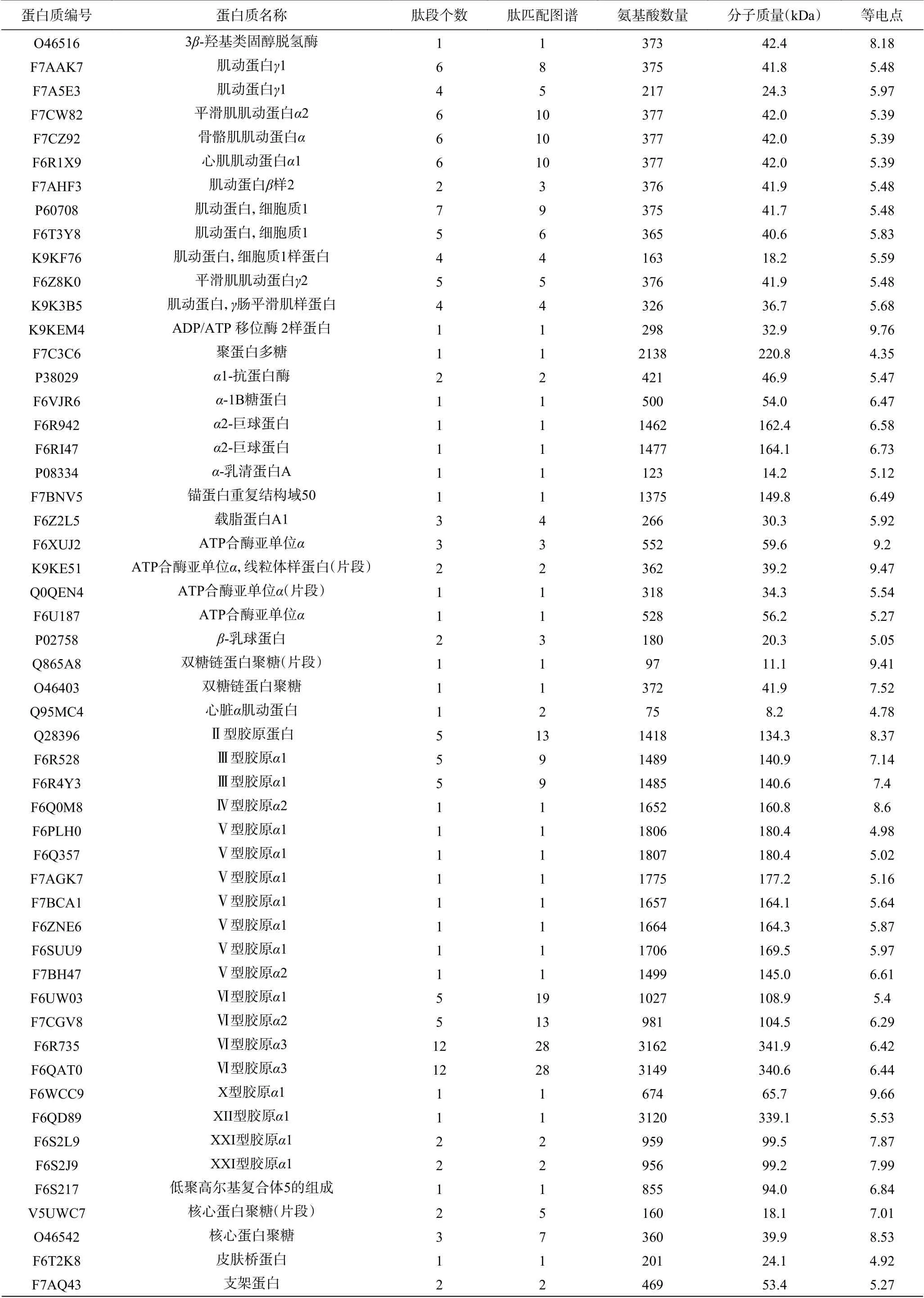
表1 阿胶首次鉴定蛋白组分分析结果Table 1 Analysis of CCA protein components by first identification

续表 1
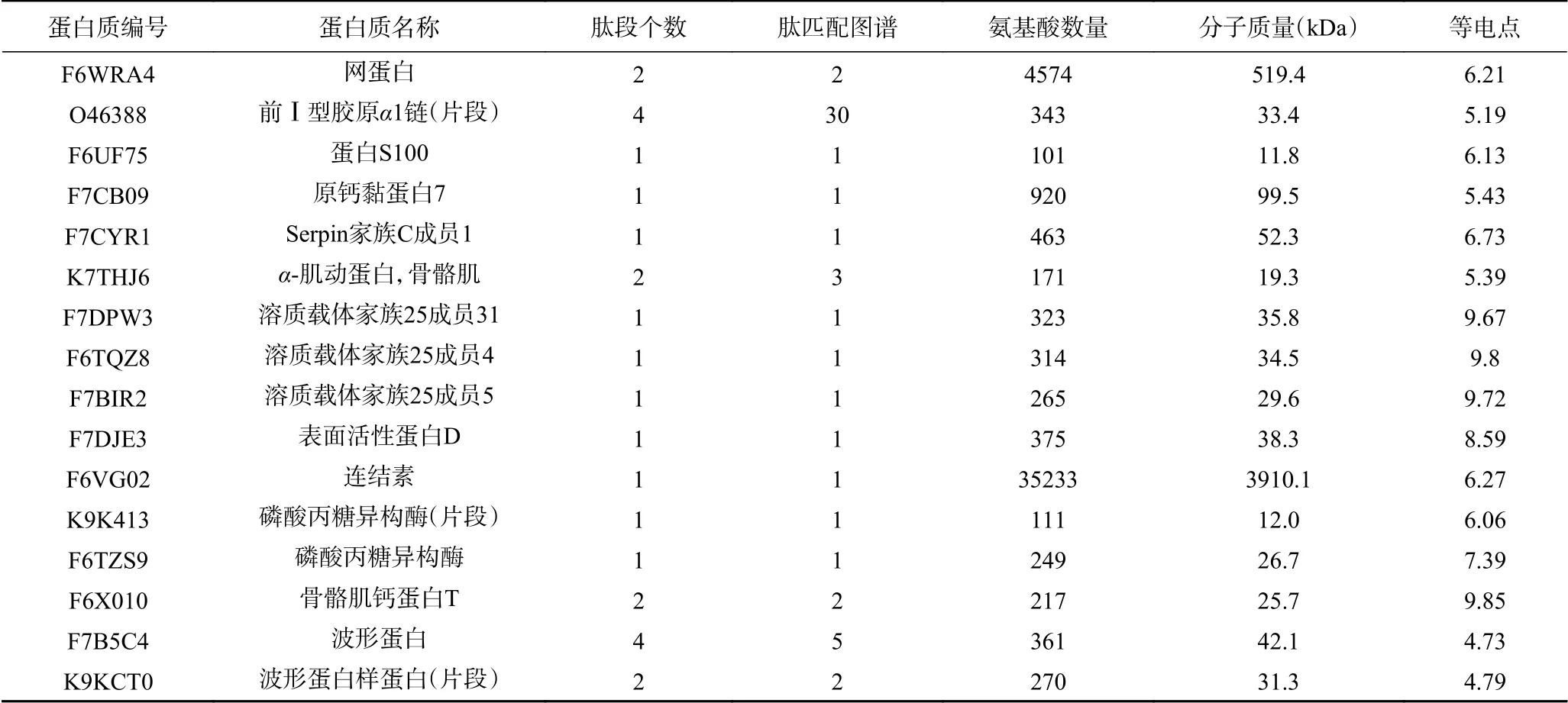
续表 1
2.3 蛋白质GO分类结果
通过基因本体论(Gene Ontology,GO)法对阿胶蛋白分别以其分子功能(Molecular Function,MF)、生物学过程(Biological Process,BP)和细胞组成(Cell Component,CC)三种方式进行归类,结果见图3。根据生物学过程分析,阿胶蛋白参与最多的生物学过程是核小体组装、胶原原纤维形成、染色质沉默、中间丝组织、对革兰氏阳性细菌的防御反应和间充质迁移,所占蛋白的比值分别为10.6%、6.1%、6.1%、3.9%、3.9%和2.2%。阿胶蛋白参与形成的细胞组成有角蛋白丝、中间丝、细胞外泌体、核小体、细胞外隙、蛋白质性细胞外基质、血液微粒、肌原纤维、髓鞘、胶原三聚体、核染色质、肌球蛋白丝、肌纤维膜等,其中占比最高的细胞组成是细胞外泌体和细胞外间隙的蛋白组成,分别占50.0%和21.1%。阿胶蛋白参与蛋白质种类最丰富的分子功能为结构分子活性、DNA结合、细胞外基质结构成分、氧结合、氧转运蛋白活性等。
为进一步了解阿胶蛋白发挥作用的生物学途径,对阿胶蛋白进行KEGG通路分析,以期了解阿胶蛋白主要参与的生物信号通路,为后续阿胶蛋白功效研究提供依据。阿胶蛋白参与的KEGG信号通路主要有系统性红斑狼疮、酒精中毒、蛋白质消化吸收、ECM受体相互作用、病毒致癌、肥厚型心肌病、扩张型心肌病、黏着斑等,见图4。阿胶蛋白信号通路的富集结果为进一步深入了解阿胶蛋白的生物学意义,阐明阿胶发挥提高免疫、改善肺部损伤、补血等药理活性的机制提供新的途径和线索。
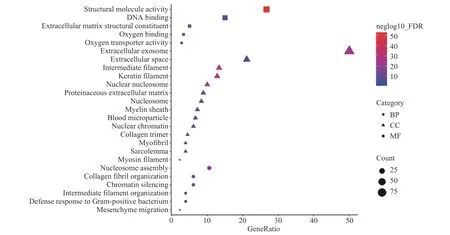
图3 识别出的阿胶蛋白的GO分类Fig.3 Gene ontology of the protein groups identified from CCA
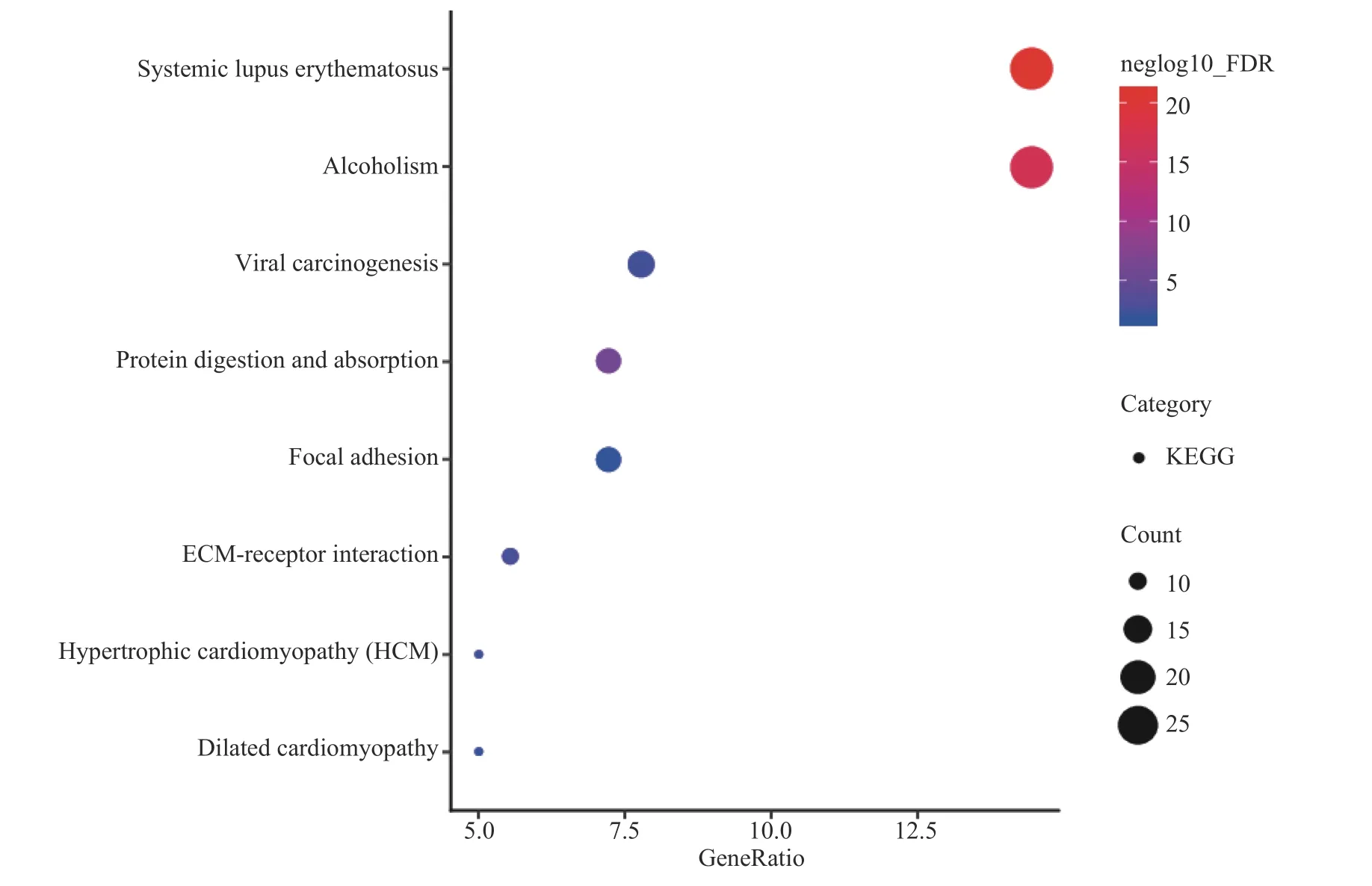
图4 识别出的驴胎盘蛋白的KEGG分类Fig.4 KEGG of the protein groups identified from CCA
阿胶蛋白参与的KEGG通路揭示,阿胶蛋白参与ECM受体相互作用信号通路的基因为ECM中的collagen、THBS等和细胞膜上的整合素、CD44、syndecan,从另一角度证实了复方阿胶浆通过上调αvβ3表达,改善子宫内膜容受性[31]。已有研究表明,黏着斑、ECM受体相互作用等信号通路中的调控因子在骨骼肌生长发育过程中发挥着重要的作用[32],为阿胶促进骨愈合、改善骨密度及预防和治疗骨质疏松症的作用机制和机理提供了新的途径和线索[33-35]。阿胶参与肥厚型心肌病、扩张型心肌病信号通路在一定程度上解释了黄连阿胶汤可防治积累使用蒽环类药物化疗患者的心脏毒性、抑制心肌损伤的作用机制[36]。
3 结论
本文主要旨在研究阿胶蛋白的组成,为明确阿胶功效物质基础和二次开发提供依据。采用SDSPAGE凝胶电泳和三合一高分辨质谱等手段揭示阿胶蛋白组成。研究表明,通过与马科蛋白图库进行对比,检索出316种可识别的蛋白,阿胶含有多种活性蛋白,比如核心蛋白聚糖、双糖链蛋白聚糖、Lumican和纤调蛋白等富含亮氨酸的小分子蛋白聚糖、角蛋白、皮肤桥蛋白、免疫球蛋白和胶原蛋白等。GO分类和KEGG通路分析显示,阿胶蛋白主要富集在胶原原纤维形成、细胞外基质结构成分、系统性红斑狼疮、蛋白质消化吸收、ECM受体相互作用、病毒致癌、肥厚型心肌病、扩张型心肌病等。该研究为进一步探究与阿胶药理活性相关蛋白质组分、阿胶二次开发提供数据支撑,明确阿胶蛋白成分发挥药理活性的机制提供了新的途径和线索。
