沙棘多糖抗运动性疲劳及抗氧化作用的研究
2021-06-18刘雅娜包晓玮魏晨业白羽嘉
刘雅娜,包晓玮,王 娟,魏晨业,白羽嘉
(新疆农业大学食品科学与药学学院,新疆果品采后科学与技术重点实验室,新疆乌鲁木齐 830052)
沙棘(Hippophae rhamnoides L.)又名醋柳、黑刺等,属于胡颓子科(Elaeagnaceae)沙棘属(Hippophae)的一类多年生落叶灌木或小乔木。我国沙棘资源非常丰富,占世界沙棘资源的90%以上,生长地主要分布在青海、甘肃、宁夏、西藏、新疆、陕西等地区[1]。我国古书中就有记载,沙棘被用于中医治疗各种疾病,具有很强的药用价值。近年来研究表明沙棘果富含很多生物活性成分,具有良好的抗氧化、抑制肿瘤、降低血糖、降低血脂、免疫调节、缓解炎症、韧带损伤等功能[2]。
活性多糖是一类主要由葡萄糖、甘露糖、果糖、阿拉伯糖、木糖以及半乳糖等10个或10个以上单糖聚合而成的,具有一定生理功能的多聚糖。作为功能性食品开发使用的活性多糖主要是从一些植物、食用真菌、动物及海洋生物中提取得到,种类繁多[3-4]。我国陆地资源丰富,对于植物多糖功能作用的研究较多。有研究表明,枸杞多糖能够增加运动小鼠体内糖原储备量,加快清除体内乳酸等代谢废物,对缓解脂质过氧化和体力疲劳有一定作用[5]。用不同剂量的桔梗多糖灌胃小鼠,发现持续浮水时间增长、血清尿素氮和乳酸含量显著降低、肝糖原含量有所增加,研究认为桔梗多糖对小鼠具有明显的抗疲劳作用[6]。同样,在蒲公英多糖的研究中也得到了有效延长了小鼠力竭游泳时间,抑制血清尿素氮的产生,促进肝糖原储备的结论[7]。目前,我国对沙棘的研究主要集中在沙棘中黄酮类和多酚类化合物的提取及功能性研究。如王苗苗[8]对2种新疆沙棘中黄酮、多酚及其抗氧化活性分析,得出2种沙棘的黄酮、多酚、槲皮素、山奈酚及异鼠李素含量与其抗氧化活性具有一定相关性。王玉[9]研究了沙棘黄酮的分离纯化及其抗运动性疲劳作用,明确了纯化后的沙棘多糖能显著的增强机体的运动耐力,有效降低乳酸水平,提高肝、肌糖原的储备,体现出较好的抗运动性疲劳作用。对于沙棘多糖在抗氧化和抗疲劳方面的功效研究较少。并且,运动性疲劳同时会使机体产生大量的自由基和过氧化物,抗氧化能力同样也会影响抗疲劳的效果。
因此,本研究通过建立小鼠游泳训练模型,检测血液中肝糖原的储备量、血乳酸含量(LA),及体外DPPH自由基清除率等反映运动疲劳程度和抗氧化活性的相关指标。评价沙棘多糖的抗运动疲劳和体外抗氧化作用,以期为沙棘果功能性产品的开发和沙棘功效作用的研究提供参考依据。
1 材料与方法
1.1 材料与仪器
沙棘 来自新疆阿勒泰地区;100只雄性KM小鼠 (20±2) g,清洁级,购于新疆医科大学实验动物中心(批号:SCXK(新)2018003);尿素氮(blood urea nitrogen,BUN)、乳酸(lactic acid,LA)、肝糖元(hepaticr glycogen,HG)试剂盒 南京建成生物工程研究所;1.1-二苯基-2-三硝基苯肼(DPPH)、2,2'-联氮基双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS) 美国 Sigma 公司;石油醚、无水乙醇、丙酮、乙醚 均为分析纯,天津永晟精细化工有限公司。
XH-B涡旋混合器 无锡沃信仪器制造有限公司;YCL-400T超声波药品处理器 济宁金百特电子有限责任公司;T6紫外-可见分光光度计 北京普析通用仪器有限责任公司;小鼠游泳箱(100 cm×50 cm×70 cm) 北京智鼠多宝生物科技有限公司。
1.2 实验方法
1.2.1 沙棘多糖的提取 沙棘干果40 ℃烘干粉碎后过40目筛,石油醚脱脂两次用80%乙醇回流提取后抽滤,滤渣烘干备用。烘干后的滤渣加入蒸馏水超声辅助提取后浓缩,采用Sevage法进行脱蛋白五次,用80%乙醇醇沉,沉淀经乙醇、丙酮、乙醚依次顺序洗涤后,抽滤烘干即得沙棘粗多糖[10]。沙棘粗多糖的提取率可达8.834%。
1.2.2 分组及给药方法 将100只雄性小鼠适应性喂养5 d,在第3 d对100只小鼠进行游泳测试,从100只小鼠中筛选出70只身体健康、体重均匀且具有游泳能力的小鼠。在第5 d随机抽取40只小鼠分为空白组、沙棘多糖低(100 mg/kg)、中(200 mg/kg)、高(400 mg/kg)剂量组,每组10只,每日上午,每日一次,沙棘多糖低剂量组、沙棘多糖中剂量组和沙棘多糖高剂量组予沙棘多糖0.2 mL/10 g灌胃,空白组予0.9% NaCl注射液等量灌胃,连续15 d。
1.2.3 负重游泳试验 各组小鼠末次灌胃30 min后,尾部系上7.5%体重量的铁丝,放入水深60 cm,水温(25±0.5) ℃的游泳箱里游泳。用秒表记录小鼠自入水时开始至头部沉入水中10 s不能浮出的时间,即负重力竭游泳时间。
1.2.4 肝糖原含量测定 处死各组小鼠,剖腹取肝脏80 mg,分别加入 0.9% NaCl注射液漂洗后用滤纸吸干,称取60 mg样本与3倍体积碱液(pH8.0)一起加入试管中,沸水浴煮20 min,流水冷却。将糖原水解液进一步制备成糖原检测液,检测液加入1:4的氯仿漩涡混匀,3500 r/min离心10 min除脂,取上清液0.1 mL用于测定,其他试剂量取严格按照试剂盒说明书进行,最终混匀后置沸水中煮5 min,冷却后于波长620 nm,光径1 cm,空白管调零,测定各管吸光度值,计算肝糖原含量。
1.2.5 血尿素氮含量的测定 负重游泳试验结束后,断头采血,血液在肝素抗凝管中经3000 r/min离心10 min。血BUN含量测定时,取血浆0.02 mL,其他试剂量取严格按照试剂盒说明书进行,最终充分混匀,37 ℃水浴10min,波长640 nm,光径1 cm,双蒸水调零,测定各管吸光度值,计算血BUN含量。
1.2.6 血乳酸(LA)含量的测定 取血清0.02 mL,其他试剂量取严格按照试剂盒说明书进行,最终混匀,波长530 nm,光径1 cm,双蒸水调零,测定各管吸光度值,计算血LD含量。
1.2.7 DPPH自由基清除率测定 具体操作步骤参照熊芳琪[11]方法进行,以无水乙醇作空白对照,Vc为阳性对照。
1.2.8 ABTS+自由基清除率测定 参照马晓等[12]方法并改进。配制不同浓度的沙棘多糖溶液各1 mL,分别加入 4 mL ABTS 工作液,混匀后避光反应6 min,在734 nm 处测定吸光度,以Vc为阳性对照,按以下公式计算其清除率。
ABTS 自由基清除率(%)=[1-(A1-A)/A0]×100
式中,A1:与 ABTS 溶液混合的试样的吸光度;A:不含 ABTS 溶液的样品的吸光度;A0:取代样品溶液的蒸馏水的吸光度。
1.2.9 沙棘多糖还原能力测定 参照付爱叶等[13]的方法并改进。分别将PBS(0.2 mol/L,pH6.6)、1%的铁氰化钾改为2 mL。取离心后上层液 50 μL,加 2 mL蒸馏水和 1%六水氯化铁0.2 mL,反应后测吸光度。
1.3 统计方法
使用SPSS 19.0软件进行统计分析,采用单因素方差分析对各组数据的差异性进行比较,P<0.05表示差异显著,P<0.01表示差异极显著,所得数据以平均数±标准偏差表示,每个指标重复测定3次。
2 结果及分析
2.1 沙棘多糖对小鼠力竭游泳时间的影响
疲劳即是主观上一种疲乏无力的不适,伴随着头昏头疼、眼花、心率加快等不良反应。小鼠负重强迫游泳耐力试验是用来评价药物或食物抗疲劳作用的常用试验模型[14]。其中游泳持续时间的长短能够反映沙棘多糖的抗疲劳程度。由表1可知,沙棘多糖低、中、高剂量组负重游泳时间比空白组分别延长了33.51%、58.89%、55.35%,表明沙棘多糖可以在一定程度上缓解小鼠疲劳状态,使得小鼠负重游泳时间增加。其中,沙棘多糖中剂量组的负重游泳时间增加极显著(P<0.01),高剂量组负重游泳时间显著增加(P<0.05)。表明了不同剂量的沙棘多糖对小鼠的抗疲劳效果也有所不同,中剂量组具有更好的效果。刘兴龙等[15]研究了黑参多糖对小鼠抗疲劳作用,也得出黑参多糖中剂量组比高剂量组更能有效提高小鼠力竭游泳时间。
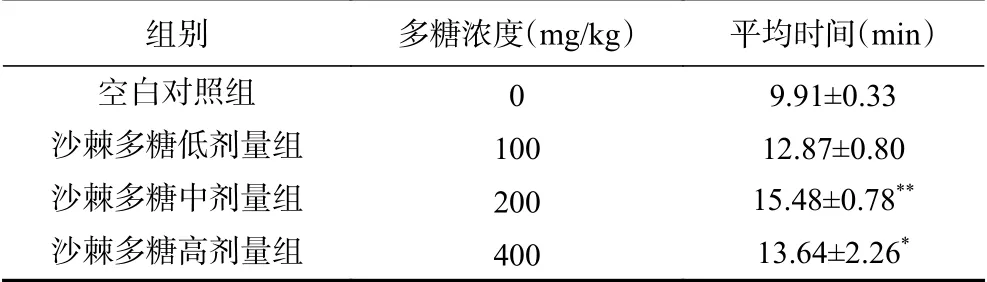
表1 沙棘多糖对小鼠力竭游泳时间的影响Table 1 Effect of PBP on exhaustive swimming time of mice
2.2 沙棘多糖对疲劳小鼠肝糖原含量的影响
糖类是机体运动过程中重要的供能物质之一,机体内糖储量是否充足与运动疲劳的发生有密切的关系。人体长时间剧烈运动会消耗大量血糖,影响中枢神经提供能量,因此人体会感觉疲劳[16]。运动强度和持续时间关系着机体内肝糖原的分解速度。尤其是长时间运动后,机体为维持正常血糖水平,肝糖原分解速度增加,因此测定肝糖原含量是反映抗疲劳作用的重要指标之一[17]。由表2可知,沙棘多糖低(100 mg/kg)、中(200 mg/kg)、高(400 mg/kg)剂量组肝糖原含量比空白对照组分别增加12.41%、30.75%、15.34%。该结果表明沙棘多糖中剂量肝糖原含量相对低、高剂量组有明显提升,差异极显著(P<0.01)。说明沙棘多糖可以通过提高小鼠体内肝糖原储备,从而延缓体内疲劳的产生。向超宗等[18]研究了杏鲍菇多糖对小鼠抗疲劳作用得出:同样给药浓度为200 mg/kg,杏鲍菇多糖增加肝糖原储备量为36.92 mg/g明显低于本实验沙棘多糖的作用效果。同样的给药剂量浓度,杨占群等[19]研究了黑糯玉米多糖对小鼠抗运动疲劳的影响,最高剂量组(400 mg/kg)提高小鼠肝糖原含量为6.68 mg/g,也远低于沙棘多糖的作用效果。丁玉松等[20]研究了同属胡颓子科的另一种药用植物沙枣多糖对小鼠抗疲劳的影响,1000 mg/kg的高剂量组可以提高小鼠体内肝糖原的量30.90 mg/g,说明低浓度的沙棘多糖比高浓度的沙枣多糖抗疲劳效果更好。

表2 沙棘多糖对疲劳小鼠肝糖原的影响Table 2 Effect of PBP on the levels of HG infatigued mice
2.3 沙棘多糖对疲劳小鼠血清BUN的影响
机体在正常情况下,血清中BUN含量比较稳定。但当机体剧烈运动或长时间持续运动时,糖原和脂肪代谢已不能满足机体能量所需之时,机体就需要靠蛋白质分解进行供能[21]。BUN是由NH3和CO2在肝脏中合成,并通过血液运输到肾脏排出体外的除蛋白质以外的一种含氮化合物。血清BUN水平升高,可以表明机体有氧代谢的能力降低,运动疲劳程度增加[22]。由表3可知,与空白组相比,低、中、高剂量沙棘多糖组的BUN含量分别下降了22.06%,25.89%和23.72%。其中,沙棘多糖中、高剂量组BUN含量极显著降低(P<0.01),沙棘多糖低剂量组BUN含量显著下降(P<0.05),表明了沙棘多糖可以有效减少血清中BUN含量,加速其排出体外,有助于提高小鼠的运动能力。朱一闻等[23]研究了黄秋葵多糖抗疲劳作用,在空白对照组BUN含量相似的前提下,低和高剂量组也得到了相近结论,分别是4.47、4.84 mmol/L,略低于本实验沙棘多糖效果,可能原因是朱一闻等采取小鼠负重6%的训练方法。秦汝兰等[24]研究了山刺玫果多糖对小鼠抗疲劳的影响,其中高剂量组对血清BUN的清除量与沙棘多糖中剂量组相近5.89 mmol/L。说明在小鼠持续运动中,植物多糖具有明显清除血清中BUN的作用,但不同种类的植物多糖效果存在一定的差异。

表3 沙棘多糖对疲劳小鼠血清BUN的影响Table 3 Effect of PBP on the levels of BUN in fatigued mice
2.4 沙棘多糖对疲劳小鼠血清LA的影响
血乳酸是机体在运动产热过程中酸性代谢产物之一。正常情况下,运动产生的乳酸在肝脏中会被分解为H2O、CO2及热量,疲劳就会被消除。如果运动过于剧烈或持久,导致体内的乳酸来不及被处理,越来越多的乳酸就会抑制参与糖原分解及糖酵解反应的磷酸化酶和磷酸果糖激酶的活性,导致能量供应的不足[25]。结果造成肌肉酸痛、发冷、头痛等疲劳症状。因此,血乳酸水平是评价抗运动疲劳的常见指标[26]。由表4可知,沙棘多糖低、中、高剂量组血清LA分别比空白组低4.4%、21.90%、22.41%,中、高剂量组LA含量极显著降低(P<0.01),沙棘多糖低剂量LA含量相比空白组相差较小,结果表明:沙棘多糖低剂量抗疲劳作用弱于中剂量和高剂量。在相同给药剂量的前提下,沙爱龙等[27]研究了阿里红多糖对小鼠抗疲劳作用的影响,得出空白组及不同剂量组血乳酸含量均比本实验数据低,这可能与小鼠负重率较低有关系,但低、中、高剂量组与空白组相比下降率分别为16.5%、20.76%、23.90%,与本实验所得趋势一致。

表4 沙棘多糖对疲劳小鼠血清LA的影响Table 4 Effect of PBP on the levels of LA infatigued mice
2.5 沙棘多糖体外抗氧化活性研究
由图1可知,沙棘多糖对DPPH自由基清除能力与多糖浓度呈正相关趋势。多糖浓度在0.2~0.6 mg/mL和0.8~1 mg/mL时清除率增长较快,在0.6~0.8 mg/mL时增长较慢。沙棘多糖浓度在0.2~1.0 mg/mL对DPPH自由基清除能力均低于Vc的效果,但在多糖浓度1 mg/mL时Vc清除率为97.45%,沙棘多糖清除率接近Vc清除率为83.43%。陈佳等[28]研究了大连刺参多糖对DPPH自由基清除能力,得出刺参多糖浓度达到1.5 mg /mL时清除率为72.6%,IC50值为0.3 mg /mL。陈红惠[29]等人研究了底圩茶多糖抗氧化效果,得出多糖浓度在2 mg/mL时,对DPPH自由基清除率为66.48%,IC50值为0.61 mg/mL。高洁等[30]研究了皂荚多糖的抗氧化能力,得出当多糖浓度为4 mg/mL时达到最大清除率为40.2%,IC50值为6.9 mg/mL。陈晓白等[31]研究发现山银花多糖对DPPH清除的IC50值为0.941mg/mL。本实验中沙棘多糖IC50值为0.81 mg/mL,并且浓度在1 mg/mL时清除率最大为83.43%。说明沙棘多糖对DPPH自由基的清除效果比大连刺参多糖、底圩茶多糖弱,比皂荚多糖和山银花多糖强,具有一定自由基清除活性。

图1 沙棘多糖对DPPH自由基清除率影响Fig.1 Effect of polysaccharide from Hippophae rhamnoides on DPPH radical

图2 沙棘多糖对ABTS+自由基清除率影响Fig.2 Effect of polysaccharide from Hippophae rhamnoides on ABTS+ radical
由图2可知,沙棘多糖在浓度0.2~1.0 mg/mL范围内,对ABTS+的清除能力逐渐增强。尤其浓度在0.4~0.8 mg/mL范围内清除率快速增长,从27.75%升到94.44%。而0.2~0.4 mg/mL和0.8~1.0 mg/mL的浓度范围内,清除率缓慢增长。沙棘多糖浓度在0.8和1.0 mg/mL时,对ABTS+的清除率分别为94.44%和95.83%,接近同浓度下Vc清除率,分别为99.06%和99.53%,IC50值为2.00 mg/mL。董玉玮等[32]研究了牛蒡多糖的体外抗氧化效果,得出:多糖浓度在5 mg/mL时,清除率最大为65.78%,IC50值为1.556 mg/mL。DPPH自由基相对比较稳定,能与有供氢能力的抗氧化剂反应[33]。ABTS+自由基也比较稳定,是一种含氮自由基,一般用作反映物质总抗氧化能力的测定指标。可见,沙棘多糖对DPPH的清除能力要比ABTS+强。
由图3可知,沙棘多糖的还原能力与浓度呈现良好的量效关系。随着浓度的增加,吸光值增大,还原能力逐渐增强。多糖分子中因为含有的醛羰基,通过电子给予能力,阻止自由基链形成,从而具有一定还原作用[10,34]。在0.2~1.0 mg/mL浓度范围内,多糖的还原能力持续增强,最大吸光值为0.727,但总还原力均明显低于相同浓度Vc的还原力。李珊等[34]研究了桂七青芒果皮多糖浓度在4.3 mg /mL时,总还原力为0.455。李珊等[35]研究了番石榴多糖浓度在20 mg /mL时,总还原力为0.625。本实验沙棘多糖在浓度为1 mg/mL时,吸光度值为0.727。可以看出,沙棘多糖的还原能力要高于桂七青芒果皮多糖和番石榴多糖。
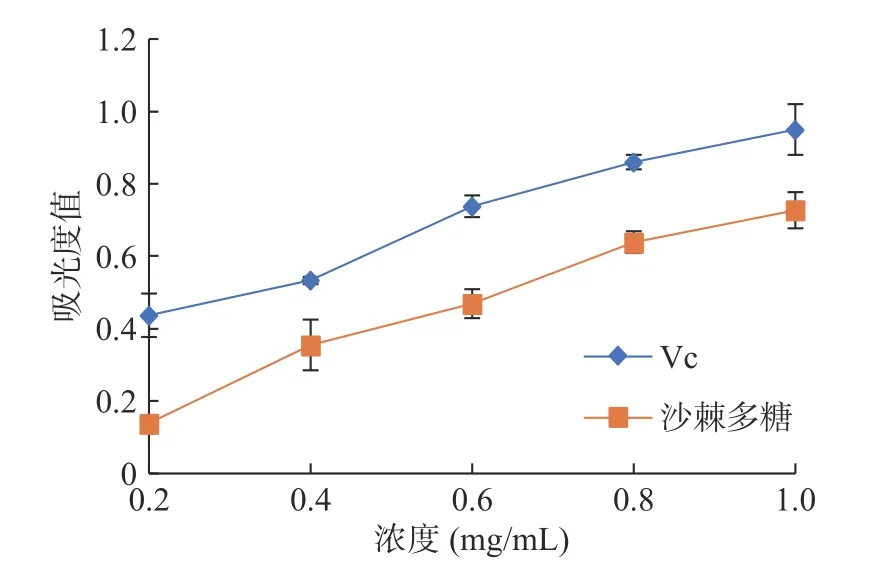
图3 沙棘多糖的还原能力Fig.3 Total reducing power of polysaccharide from Hippophae rhamnoides
3 结论与讨论
本实验结果表明PBP对自由基具有一定清除率,其中对DPPH自由基清除能力较强,对ABTS+自由基的清除能力较弱,其 IC50值分别为0.81、2 mg/mL。PBP的还原能力也随着浓度的增加逐渐增强。表明PBP具有良好的抗氧化活性。通过建立小鼠负重游泳模型,发现PBP能够有效延长小鼠负重游泳时间,增加肝脏中HG的储存量的同时降低血清中BUN、LA含量,实验结果证实PBP具有缓解体力疲劳、增强运动能力的作用。该实验结论与任薇[10]、包晓伟[36]及魏晨业[37]等得出的结论一致,虽然PBP浓度范围不同,但随着浓度的增加,都呈现上升的抗氧化趋势,尤其是对DPPH自由基和ABTS+自由基清除效果较好。由于本实验抗氧化活性测定主要采用的是体外研究,具有操作简便、高效便于重复及实验周期短等特点,今后的研究可以采用细胞模型或动物实验,通过测定血浆、肝脏、心脏及脑组织超氧化物歧化酶、谷胱甘肽过氧化物酶和丙二醛等抗氧化指标的变化对PBP的抗氧化活性进行深入分析。为今后进一步发挥沙棘的资源优势,利用沙棘多糖开发保健食品和治疗药物等深加工产品提供理论基础。
