高粱乌米对小鼠肠道菌群结构的调控作用
2021-06-18李菁菁韩姣姣石秋月苏秀榕
李菁菁,韩姣姣,石秋月,陈 菊,苏秀榕
(1.宁波大学海洋学院,浙江宁波 315832;2.宁波大学食品与药学学院,浙江宁波 315832)
高粱乌米又称高粱黑粉菌(Sphacelotheca sorghiLink),是一种真菌,是高粱感染了黑穗病菌的发病穗体,具有良好的营养价值和药用价值[1]。高粱乌米含有多种营养成分,如蛋白质、维生素、多糖、矿物质等,是一种天然的营养、保健和药用食品。欧美国家把高粱乌米作为可食用菌类[2]。古人早已发现了乌米的高效药用价值,东北人民有食用高粱乌米的习惯,甚至有养猪的农民发现给猪喂食高粱乌米可有效地缓解猪的肠道疾病[3]。目前,国内对高粱乌米的功能性方面研究还较少,仅有少量的种植、保鲜以及贮藏等方面的研究。
在人类进化过程中,肠道微生物一直发挥着很重要的作用,它们和人体的营养吸收、物质代谢以及健康免疫等具有直接关系,跟随着人类不断进化[4]。研究发现,肠道微生物与人类是互利共生的关系,宿主为其提供营养物质和繁殖场所,而它们影响着宿主的物质吸收与代谢,对宿主保持健康、抵御疾病发挥着重要的作用[5]。目前高通量测序技术已经是研究菌群多样性的新手段[6-7]。16S rDNA为编码原核生物核糖体小亚基rRNA的DNA序列,具有10个保守区域和9个高变区域(V1-V9),其中保守区在细菌间差异不大,高变区具有属或种的特异性[8]。鉴于此,本研究采用高通量测序技术系统性研究高粱乌米对小鼠肠道菌群的作用,为预防疾病、增强体质、合理规划饮食提供理论依据。
1 材料与方法
1.1 材料与仪器
高粱乌米粉 购自吉林省梨树县乌米农民专业合作社;ICR雄性小鼠 购自浙江省实验动物中心(浙江杭州,动物编号:1605200003);常规饲料 购于宁波大学实验动物中心;总胆固醇(Total Cholesterol,TC)、甘油三酯(Triglyceride,TG)、高密度脂蛋白(High-density Lipoprotein Cholesterol,HDL-C)和低密度脂蛋白(Low-density Lipoprotein Cholesterol,LDL-C)测定试剂盒 购于南京建成生物工程研究所;E.Z.N.A.® Soil试剂盒 购自上海玉博生物科技有限公司。乌米饲料(基础饲料与乌米以1:1比例混合) 为实验室自制。
天平和水浴锅 宁波江南仪器厂;酶标仪 上海闪谱生物科技有限公司。
1.2 实验方法
1.2.1 动物实验 24只10周龄的ICR雄性小鼠适应两周后,随机分为2组,每组12只:对照组,喂食普通饲料;乌米组,喂食乌米饲料;所有小鼠均为自由饮食。所有的动物实验均在宁波大学实验动物中心[SYXK(ZHE 2008-0110)]完成。动物实验及护理程序都严格遵循宁波大学实验动物中心(隶属于浙江实验动物共同服务平台)制定的指导方针。控制室内温度(23±1 ℃)和湿度(55%±10%),循环12 h光照/黑暗(灯光)。每周测量一次小鼠体重,8周后处死小鼠。
1.2.2 样品处理 在处死小鼠之前,收集每只小鼠的粪便并将其保存在-80 ℃,用于之后的16S rRNA基因测序。实验结束时,各组小鼠禁食、禁水24 h,对小鼠麻醉。眼球取血液存于离心管内,37 ℃水浴10 min,3000 r/min离心后取上层血清,分装后冻存于-80 ℃冰箱备用。采血结束,脱颈处死小鼠,解剖取出肝脏,需称重。
1.2.3 脏器指数和血清生理生化指标检测 肝脏系数计算:肝脏重量/体重(g/g)。取出存放于-80 ℃的血清样品,按照试剂盒说明书测定血清中 TC、TG、HDL-C、LDL-C,并计算其浓度。
1.2.4 肠道微生物的检测
1.2.4.1 总DNA提取 按照E.Z.N.A.® Soil试剂盒说明书从小鼠粪便样品中提取出总基因组DNA,其浓度经NanoDrop 2000测定[9]。
1.2.4.2 16s rRNA基因V3-V4区PCR扩增及高通量测序 基因组样品由DNA Qubit 2.0进行精确定量后,使用细菌16S rRNA基因的V3-V4区设计引物(正向引物为5’- ACTCCTACGGGAGGCAGCAG-3’,反向引物为5’-GGACTCGTGGGTCTCTAAT-3’)进行扩增。扩增结束后,利用1%琼脂糖凝胶电泳将得到的PCR产物进行检测并切胶回收,精确定量后由Illumina MiSeq进行测序。
1.3 数据处理
利用FLASH软件根据PE reads之间的overlap关系将成对的reads拼接成一条序列[10],并去除barcode序列,通过Prinseq软件去除短于50 bp的片段和reads尾部质量值在20以下的碱基,过滤低复杂度序列,去除非扩增区域[11]。最后,利用Mothur软件中的pre.cluster算法进行测序错误校正,同时利用chimeras.uchime算法去除序列中的嵌合体[12]。
利用Uclust软件对OTU进行聚类分析(属的序列相似性阈值为0.97,种的序列相似性阈值为0.99),并选择OTU数目变化与Uclust参数之间最佳similarity值[13],通过Mothur对α-多样性包括Chao1指数、Observed_species指数、Shannon指数以及 Simpson指数进行分析[12],同时基于Unifrac metric计算方法对其β-多样性指数进行分析[14]。最后采用RDP classifier软件对处理后的序列进行物种分类、群落变化的分析[15]。
实验数据采用平均值±标准差的方式表示,符合正态分布的根据单因素方差(ANOVA)进行分析,不符合正态分布的根据图基事后检验法(Tukey’ post hoc test)进行分析。P<0.05代表具有统计学差异。采用GraphPad Prism7和联川生物云平台绘制柱状图、Alpha多样性图、群落结构图以及PCoA图。
2 结果与分析
2.1 表型变化
图1a显示了对照组和乌米组的体重,在第8周末,对照组小鼠体重达到34.3±3.23 g,乌米组小鼠体重达到21.65±2.38 g。与对照组相比,乌米组体重和增重量显著降低(P<0.01,图1b)。图1c为小鼠的肝脏系数变化,对照组的肝脏系数为4.768±0.56 g,乌米组的肝脏系数为5.486±0.79 g,乌米组与对照组之间无显著性差异(P>0.05)。肝脏系数是肝脏重量与体重之比。肝脏重量越大,与体重之比就会增大,则表明肝脏可能水肿或增生肥大。结果表明,乌米的膳食补充可以缓解小鼠体重的增加,并且对肝脏没有造成影响。
2.2 生理生化指标
总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL)和低密度脂蛋白(LDL)是检查血脂的重要指标。血脂水平过高,将引发脂肪代谢异常的高脂血症,间接引发其他相关疾病。如图2所示,与对照组相比,乌米组小鼠TC(2.89±0.89 mmol/L)、TG(1.27±0.39 mmol/L)、LDL-C(6.02±0.47 mmol/L)极显著降低(P<0.01),HDL-C水平极显著升高(0.30±0.06 mmol/L,P<0.01),高血脂的发生常常反应着肥胖问题,这些结果表明食用乌米具有缓解高脂血症和预防肥胖的功效。
2.3 乌米对小鼠肠道菌群多样性及结构的作用
为了探究乌米处理对肠道菌群的作用,本研究收集了24只小鼠喂养8周后的粪便样本,对其V3-V4区进行了高通量测序分析。用observed_species指数表示肠道菌群的丰富度,用shannon指数表示肠道菌群的多样性。如图所示,相比于对照组,乌米处理降低了肠道菌群的丰富度(P<0.01),提高了肠道菌群的多样性(图3a、3b)。基于加权主坐标分析(Weighted UniFracPCoA)两组小鼠肠道菌群的总体组成。结果显示,乌米可以使肠道菌群的整体组成发生变化,偏离对照组(图3c)。
2.4 肠道菌群的组成特点
桑基图(Sankeyplots)用来展示数据的“流动”变化,分支的宽度表示丰度的大小。图4显示了不同组别(左侧)对应的门水平(中间)和科水平(右侧)的菌群相对丰度。基于选择科水平丰度前十的原则,从对照组和乌米组中筛选出拟杆菌科(Bacteroidaceae)、芽孢杆菌科(Bacillaceae)、棒状杆菌科(Corynebacterium)、毛螺菌科(Lachnospiraceae)、乳杆菌科(Lactobacillaceae)、Muribaculaceae、消化链球菌科(Peptostreptococcaceae)、理研菌科(Rikenellaceae)、瘤胃菌科(Ruminococcaceae)和葡萄球菌科(Staphylococcaceae),其中棒状杆菌科属于放线菌门(Actinobacteria),拟杆菌科、Muribaculaceae和理研菌科属于拟杆菌门(Bacteroidetes),其余6个均属于厚壁菌门(Firmicutes)。在门水平上(表1),与对照组相比,乌米组中放线菌门(7.44%±0.50%)和厚壁菌门(55.95%±1.59%)极显著增加,拟杆菌门(16.90%±0.20%)极显著降低(P<0.01)。在科水平上,与对照组相比,乌米组中的乳杆菌科(0.45%±0.05%)和Muribaculaceae(9.39%±0.79%)的丰度极显著降低(P<0.01),其余菌科丰度均为明显增加。
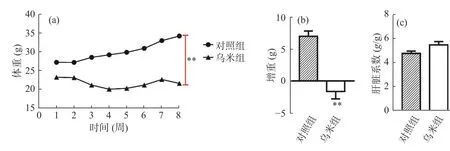
图1 小鼠体重及脏器指数变化Fig.1 Changes of body weight and organ indexs in mice

图2 小鼠血脂生理生化指标变化Fig.2 Changes of physiological and biochemical index
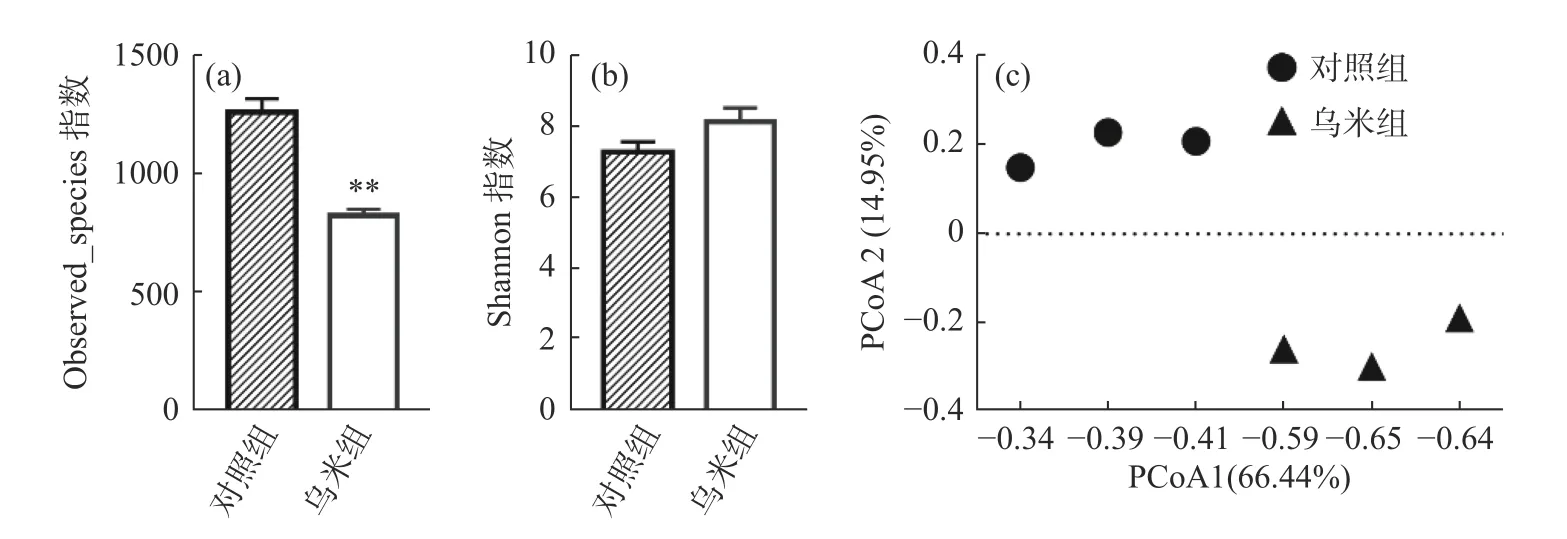
图3 各组肠道菌群Alpha多样性和PCoA分析Fig.3 Gut microbiota Alpha diversity and PCoA analysis
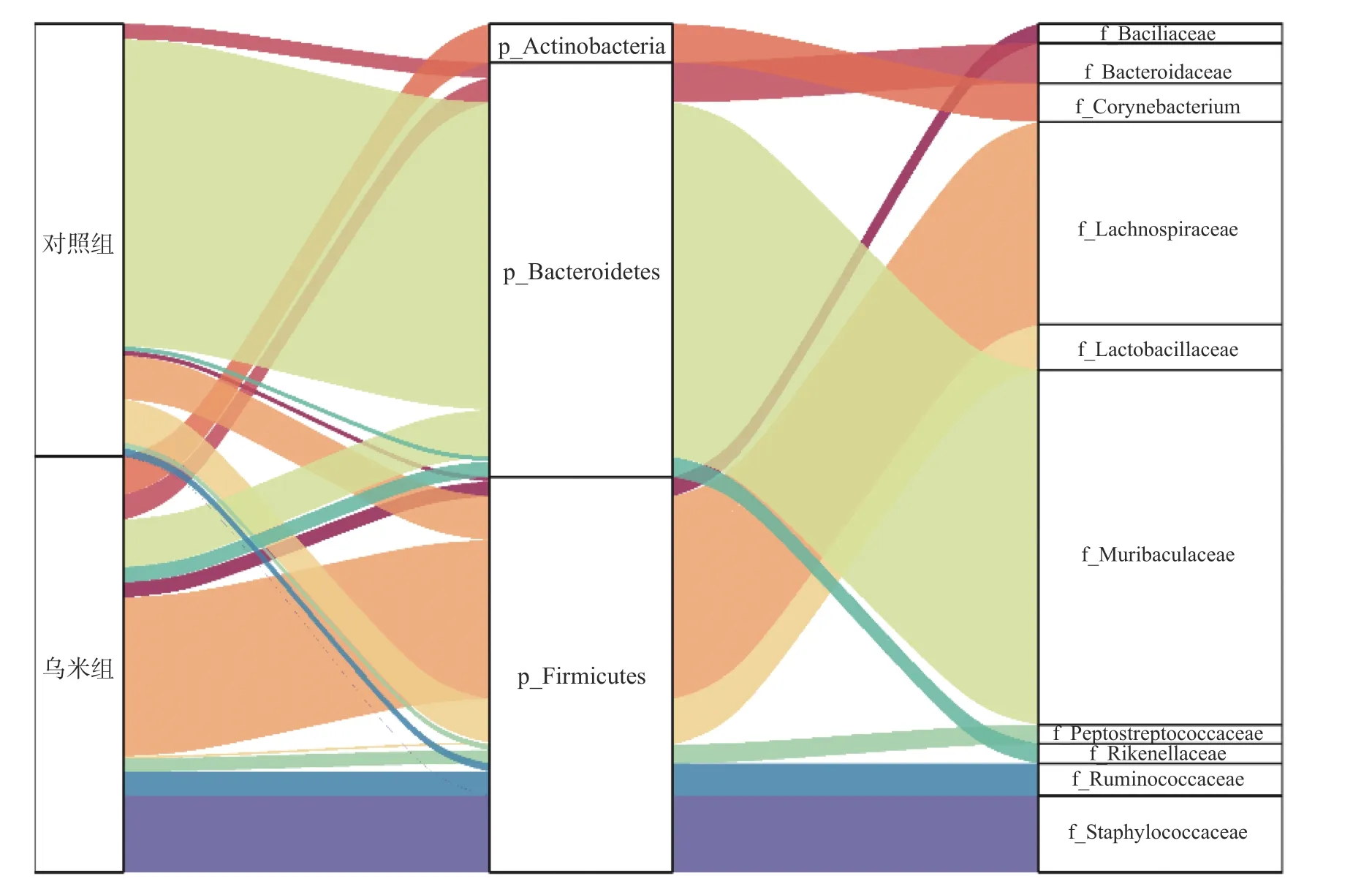
图4 小鼠肠道菌群门水平和科水平变化趋势Fig.4 Variation trend on the phylum and family levels of gut microbiota
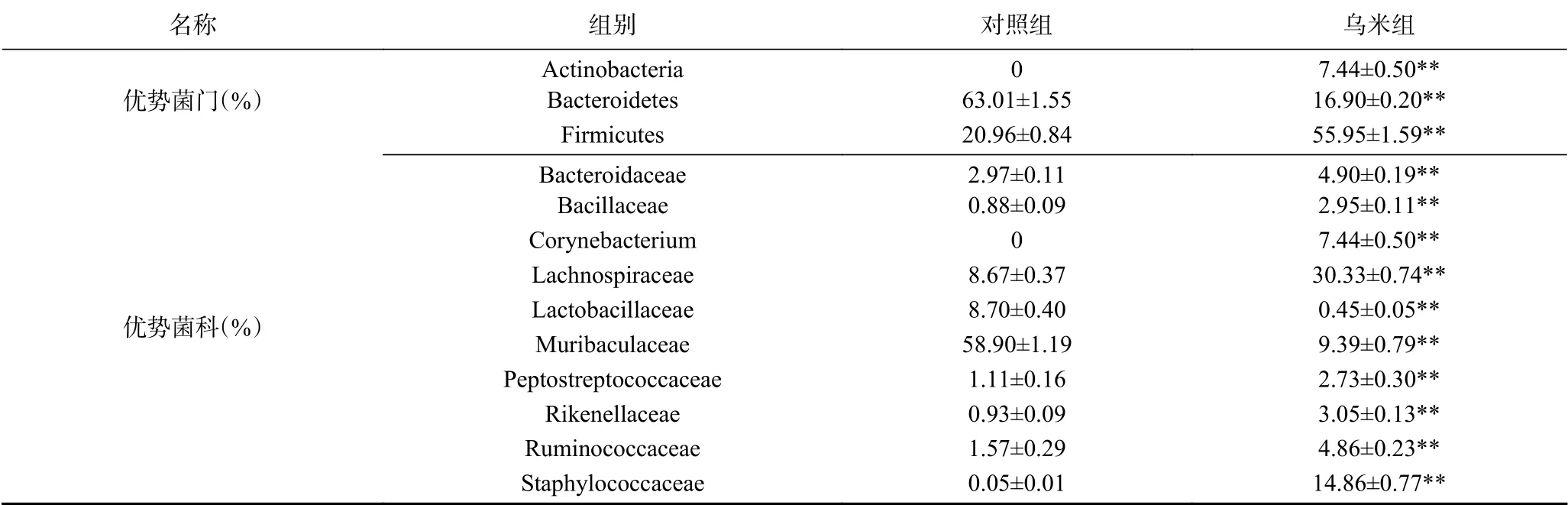
表1 小鼠肠道菌群在门和科水平上的丰度Table 1 Abundance of gut microbiota at the level of phylum and family in mice
在属水平上,我们对11个常见细菌属的丰度进行了分析比较,得到属水平的气泡图如图5所示。结果显示,与对照组相比,乌米组中的不动杆菌属(Acinetobacter)、梭菌属(Clostridium)、梭状芽孢杆菌XlVa(Clostridium XlVa)、棒状杆菌属(Corynebacterium)、乳球菌属(Lactococcus)、瘤胃球菌属(Ruminococcus)和另枝菌属(Alistipes)等菌属2倍以上的上调,巴氏杆菌(Barnesiella)和乳杆菌属(Lactobacillus)等菌属2倍以上的下调。结果表明,乌米可以使小鼠肠道中的属菌群丰度发生改变,增加了产生短链脂肪酸(SCFAs)菌属的丰度。

图5 小鼠肠道菌群属水平的OTU气泡图Fig.5 OTU bubble plot on the genus level of gut microbiota
在种水平上,对照组和乌米组中的Kineothrixalysoides、解糖梭菌(Clostridium saccharolyticum)、Muribaculumintestinale和变异棒杆菌(Corynebacterium variabile)的丰度占比如图6所示。与对照组相比,乌米组中Muribaculumintestinale的丰度从58.92%±0.36%降低至9.24%±0.46%,解糖梭菌的丰度从0.58%±0.01%增加到1.01±0.06%,Kineothrixalysoides的丰度1.78%±0.24%增加到10.88%±0.65%。在对照组中没有变异棒杆菌,乌米组中的变异棒杆菌丰度为4.71%±0.30%(P<0.01)。结果表明,乌米可以增加小鼠肠道中的益生菌,减少致病菌的丰度。
3 讨论
乌米可以减轻小鼠体重,降低血清中的TC、TG、LDL-C 水平和提升HDL-C水平,通过调节机体对脂肪的代谢能力从而实现减轻体重。

图6 小鼠肠道菌群种水平分布Fig.6 Horizontal distribution of gut microbiota in mice
喂食乌米改变了小鼠肠道菌群的结构。在门水平,乌米可增加小鼠肠道中的放线菌门和厚壁菌门的丰度,减少拟杆菌门的丰度。有研究表明,放线菌门可以产生抗菌剂、抗癌物质、免疫抑制剂和植物生长激素等丰富的生物活性次级代谢产物[16-19],具有抗菌、抗病毒、抗肿瘤和促进生长等作用,目前被认为是天然药物的主要来源[20]。此外,有研究表明,拟杆菌门参与碳水化合物的转化,分解为更多的葡萄糖,积累过多就会转化为脂肪从而形成肥胖[21-22]。乌米可以使小鼠肠道菌群中的梭菌属、梭状芽孢杆菌属、瘤胃球菌属和不动杆菌属等产SCFAs的菌属丰度增加。研究表明肠道细菌产生的SCFAs,尤其是丁酸,可促进调节性T细胞的发育,增强杯状细胞的粘液产生,从而增强粘膜屏障[23]。另一方面,肠道内SCFA水平升高,保护肠上皮屏障受损,减少肠内毒素以及减少炎症反应的产生,防止因炎症而造成的肝脏受损,从而改善脂质代谢,减少肥胖。乌米处理使小鼠肠道菌群中的Muribaculumintestinale丰度显著降低,Kineothrixalysoides和变异棒杆菌丰度显著升高。有研究表明,Muribaculumintestinale在大肠肿瘤和胃癌等肠道疾病中检出增加[24-25],在肠道菌群由于多种原因导致平衡发生变化会导致疾病[26]。Kineothrixalysoides属于人类肠道微生物最丰富家族之一中的Lachnospiracae家族,可以产生很多丁酸[27]。丁酸也是一种短链脂肪酸,与免疫稳态、预防代谢性疾病以及改善生活质量和减少抑郁有关[28-29],对肠道健康至关重要。
综上所述,乌米可以减轻体重,预防血脂疾病,可以通过调节肠道菌群预防肥胖、减少肠内毒素以及减少炎症的发生从而对机体产生有益影响。
4 结论
本研究通过分析小鼠喂食高粱乌米后的体重、血清生理生化指标的变化,以及利用高通量测序技术分析肠道微生物的多样性、群落组成以及结构的变化发现,乌米可以减轻体重,预防血脂疾病,可以通过调节肠道菌群预防肥胖、减少肠内毒素以及减少炎症的发生而对机体产生有益影响。
