HPLC-ICP-MS结合微波酸提取分析测定干制食用菌中砷的形态
2021-06-18熊善波汪佳林何瀚庭
熊善波,何 鲒, ,张 阔,汪佳林,何瀚庭,兰 航
(1.成都市食品药品检验院,四川成都 610500;2.成都经开区农村农业局,四川成都 610500)
砷(As)是自然界中一种常见的污染物,在自然界中主要以无机砷和有机砷的形态存在。砷化合物的毒性依赖于其化学形态和浓度,并通过食物链在人体内富集,有机砷通常被认为是低毒性或者无毒性的,无机砷是致癌、致畸的主要来源[1-2]。基于砷形态毒性的差异,仅测定食品中的总砷含量已不能满足评价砷毒性的需求,因此采用高灵敏度的形态分析测定方法测定食品中的砷含量对食品安全具有积极的意义[3]。
野生食用菌为一类珍稀名贵的食材,因其味道鲜美,营养丰富。富含蛋白质、氨基酸、多糖、维生素、多种矿物质元素及不饱和脂肪酸等生理活性成分,能够增强免疫功能、 降血压和抗肿瘤,深受国内外消费者喜爱。野生食用菌重金属含量与土壤、水分、大气等生长环境因子具有密切联系。多数对重金属 As、Hg、Cd、Pb有很强的富集能力,总砷含量超标问题凸显,而无机砷含量则相对较低[4]。因此,建立准确测定食用菌中无机砷的测定方法和研究砷元素的化学形态对其质量安全评价具有重要意义。
适宜的提取方法是形态分析的关键环节,样品基质不同最优的提取方法不同,现有的研究多采用加热震荡酸提取[5-6]、超声辅助酸提取、微波酸提取[7-8]等方式对食品样品中不同形态的砷化合物进行提取。目前砷形态分析主要有HPLC-ICP-MS、LC-AFS等方法[9-10]。LC-AFS虽然使用成本较低,但是由于对流动相要求较高,同时存在长期稳定欠缺和仪器灵敏度较低,不适合低含量的样品分析。而前者具有检出限低,精密度高,和分离效果好等优点被广泛应用[11]。本文研究采用不同的前处理方法,结合高效、低干扰、高灵敏度、检出限低、线性范围广的检测手段,建立微波酸提取并结合高效液相色谱-电感耦合等离子体质谱联用技术对干制食用菌中砷形态的快速分析方法,以期为全面客观评价食用菌中砷元素的危害提供了方法依据和基础数据。
1 材料与方法
1.1 材料与仪器
黑牛肝菌、松茸、黑松露、青杠菌、黑虎掌菌、姬菇、葱菌、羊肚菌、姬菇、松毛菇、珍珠菌 来自四川川野食品有限公司;亚砷酸根(As(Ⅲ),1.011±0.016 μmol/g)、砷酸根(As(V)),0.233±0.005 μmol/g)、一甲基砷 (MMA,0.335±0.011 μmol/g)、二甲基砷(DMA,0.706±0.024 μmol/g)、砷甜菜碱(AsB,0.518±0.015 μmol/g)、砷胆碱(AsC,0.374±0.015 μmol/g)中国计量科学研究院;碳酸铵、硝酸 优级纯,赛默飞世尔科技有限公司;实验用水 均为去离子水。
iCAP RQ型电感耦合等离子体质谱仪、U3000型HPLC高效液相色谱仪、Dionex IonPacTMAS7色谱柱(4×250 mm) 赛默飞世尔科技有限公司;超纯水仪 德国默克密理博公司;分析天平 瑞士梅特勒-托利多公司;微波消解仪 安东帕有限公司;实验中所用器皿均25%的硝酸溶液浸泡过夜,去离子水冲净晾干备用。
1.2 实验方法
1.2.1 标准溶液的配制 亚砷酸根As(Ⅲ)、砷酸根As(V)、一甲基砷 MMA、二甲基砷 DMA、砷甜菜碱AsB、砷胆碱 AsC标准溶液:将标准溶液分别转入10 mL容量瓶配制成1 μg/mL的标准使用液(以As计),避光保存于4 ℃冰箱中。标准溶液梯度:分别移取混合标准储备液用超纯水逐级稀释成浓度为0.00、 2.50、5.00、10.0、20.0、50.0、100.0 μg/L的混合标准系列溶液,现用现配。
1.2.2 样品前处理方法的选择 将样品直接用粉碎机粉碎,过60 目筛后备用。样品中总砷的测定方法按GB 5009.11-2014(第一篇 第一法 电感耦合等离子体质谱法)进行测定[5],将分离的各个形态砷的总和相加即得到样品中形态砷总和。
1.2.2.1 微波萃取-酸提取 准确称取制备混匀的样品约0.5 g于微波消解罐中,加入25 mL,4%的硝酸溶液,静置30 min后在110 ℃、功率为1000 W的条件下微波消解15 min。冷却后将提取液转移到离心管,用少量超纯水转移消解罐的残渣,8000 r/min离心15 min。加入5 mL正已烷,振摇1 min后,8000 r/min离心15 min。吸取下层清液,经0.45 μm有机滤膜过滤及C18小柱净化后进样。按同一操作方法作空白试验。
1.2.2.2 加热震荡酸提取 准确称取制备混匀的样品约0.5 g于50 mL塑料离心管中,加入25 mL ,4%的硝酸溶液,放置过夜。于90 ℃下恒温箱中提取2.5 h,期间振摇数次,将提取液转移到离心管[12-13]。
1.2.2.3 超声辅助-酸提取 准确称取制备混匀的样品约0.5 g于50 mL塑料离心管中,加入25 mL,4%的硝酸溶液,放置过夜。60 ℃下超声水浴提取2.5 h,期间振摇数次,将提取液转移到离心管[14]。
1.2.3 样品微波萃取-酸提取条件的优化 按照1.2.2.1中条件对样品进行处理,考察提取温度(70、80、90、100、110、120、130、140 ℃)以及酸度(2%、3%、4%、5%、6%)对提取率的影响,通过测定各形态砷含量的总和与样品总砷含量的比值计算提取率,优选最佳提取温度及酸浓度。
1.2.4 HPLC-ICP-MS条件 色谱条件:流速:1.0 mL/min;进样量:20 μL;柱温:30 ℃;流动相:A相:5 mmol/L碳酸铵 ,B相:100 mmol/L碳酸铵。 洗脱方式:梯度洗脱。
ICP-MS工作参数:射频功率:1550 W;采样深度:5 mm;半导体制冷温度: -5℃;检测器电压(计数)1037.5 V;检测器电压(模拟):-1787.5 V;冷却气流量:14 L/min;As质量数:75;检测模式:KED;采样锥和截取锥:铂锥;载气:≥99.999%高纯氩。
1.3 数据处理
所有测量数据均重复测定三次,结果以平均值±标准偏差表示,采用 Origin 8.0 绘图软件绘图,实验数据采用Excel软件进行统计分析。
2 结果与分析
2.1 色谱条件的选择
GB 5009.11-2014(第二篇 第二法 液相色谱-电感耦合等离子体质谱法)中组分的保留时间和分离度主要通过控制流动相的浓度和pH来调节。本文选择的流动相成分为碳酸铵,采用梯度洗脱的方式,既避免了配制组分复杂的流动相,又不用调节pH。经试验最终确定流动相A:碳酸铵(5 mmol/L),流动相B:碳酸铵(100 mmol/L)。洗脱程序见表1,分离效果见图1。六种形态砷在10 min内分离开,保证了砷甜菜碱(AsB)与As(Ⅲ)分离度,确保测定干制野生菌时砷甜菜碱(AsB)含量过高对三价砷检测的影响,且As(V)的峰面积明显增加,提高了检出限。
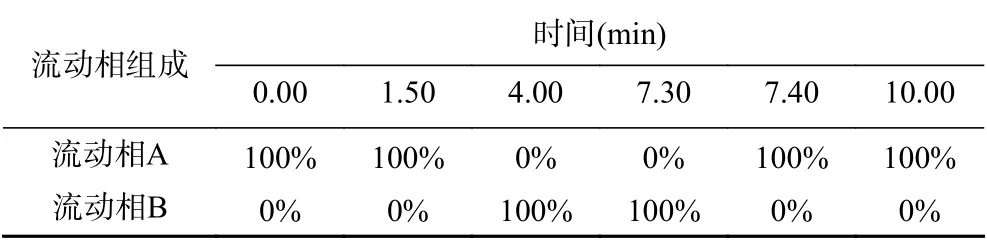
表1 流动相梯度洗脱程序Table 1 Steps for gradient elution of mobile phase
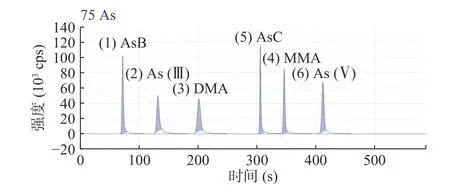
图1 标准溶液的砷形态分离谱图Fig.1 Speciation spectrum of arsenic in standard solution
2.2 食用菌中砷形态检测的影响因素
2.2.1 样品前处理方法的选择 定量分析砷形态时,砷化合物的提取率是关键,本文选取姬菇、牛肝菌比较微波萃取-酸提取、加热震荡酸提取、超声辅助-酸提取3种常见提取方式[15-18],通过测定各形态砷含量的总和与样品总砷含量的比值计算提取率,比较不同前处理方式的提取效果,见表2。
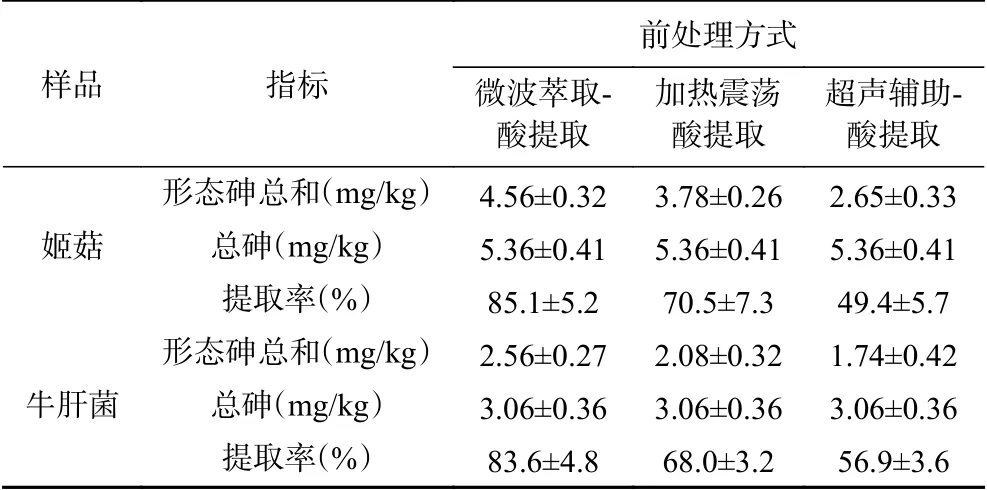
表2 前处理方式对砷化合物提取率的影响(n=7,X±S)Table 2 Effects of pretreatment methods on extraction rate of arsenic compounds (n=7, X±S)
干制食用菌含有丰富的蛋白质、氨基酸、粗纤维等,样品粉碎后颗粒偏大,特别容易因为样品前处理方式不当致使提取率偏低[19-20]。通过试验发现样品中As(Ⅲ)最难被提取,同时进一步说明寻找更为有效的提取方式的必要性。加热震荡酸提取和超声辅助-酸提取因为提取条件相对温和,无法完全破坏干制食用菌的有机成分,均不能有效地提取样品中砷的形态化合物。结果见表2。微波萃取-酸提取方式可高效提取样品中的砷的形态化合物,相比其他方式具有明显的优势,因此本实验选用微波萃取-酸提取对样品进行前处理。
2.2.2 温度对样品提取的影响 本文借助可精准控温的微波消解技术,将提取温度分别设置为70、80、90、100、110、120、130、140 ℃,通过测定各形态砷含量的总和与样品总砷含量的比值,考察提取温度对样品中总砷提取率的影响。将微波提取的时间设定为15 min。结果如图2所示。随着温度的提高,提取率逐步上升,温度超过110 ℃时,提取率变化不明显。从提取液形态分析结果发现,温度的提升主要影响的是As(Ⅲ)的提取效率,随温度升高呈现上升趋势;而As(V)则随温度的提高变化不明显,但可观察到在高温范围内有缓慢的下降趋势,初步推论 2 种不同价态的无机砷在高温下有微量的转化;温度在110 ℃时,各形态砷总和与总砷测定结果一致,证实此温度下总砷被有效提取出来。
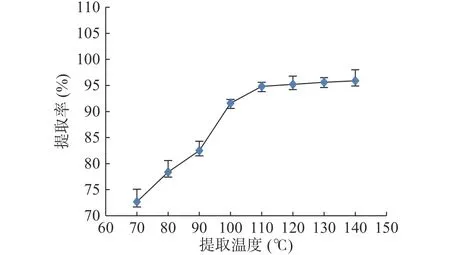
图2 温度对总砷提取率的影响Fig.2 Effect of temperature on extraction rate of total arsenic
2.2.3 酸度对样品测定的影响 砷形态标准溶液以纯水配制,样品中砷的形态化合物提取溶液为HNO3,酸度不一致,而阴离子交换柱的分离效果受pH 影响较大。本研究综合考虑提取液酸度对提取效率和色谱分离带来的影响。以2%、3%、4%、5%、6%的硝酸溶液作为提取液,微波温度设定为110 ℃时,时间15 min。结果见图3。提取率随着硝酸浓度而增加,当浓度大于4%时,随着酸度增加,提取率无明显的变化。故将提取液的酸度确定为4%。将各个酸度的提取液重复上机50余次,发现样液酸度对色谱分离效果基本没有影响,分离效果见图4。6种砷形态保留时间基本没有发生偏移。再一次验证了本实验色谱条件的优越性。
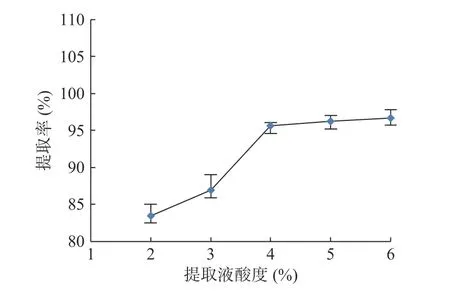
图3 酸度对总砷提取率的影响Fig.3 Effect of acidity on extraction rate of rate of total arsenic
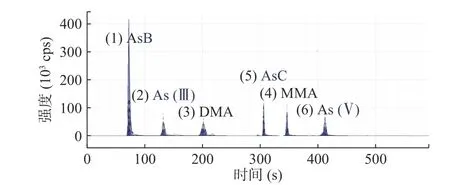
图4 不同酸度下样液色谱分离效果图Fig.4 Chromatogram of different acidity sample liquid
2.2.4 优化提取条件的验证 样品前处理既要完全提取样品中的砷,又要保证样品中的砷形态不发生改变。本文通过选取珍珠菌做提取条件的验证实验,向其中加入0.25 mL, 1 μg/mL砷形态混合标准溶液,加入25 mL,4%的硝酸,于110 ℃下微波提取15 min,上机测定,考察各形态砷标准溶液在该提取条件下的提取效率和稳定性。结果见表3,通过回收率发现,样品中的砷形态化合物提取完全,AsB、 DMA、 AsC、MMA等有机砷化合物基本没有转化成无机砷。As(Ⅲ)有些许转化成As(V),但实验测定的无机砷是As(V)和As( Ⅲ)的总和,故没有影响。
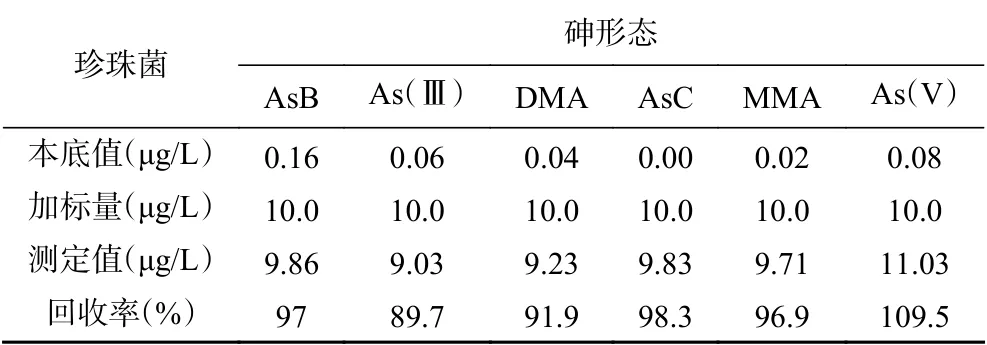
表3 砷形态的加标回收率及转化情况Table 3 Arsenic speciation recovery and transformation
2.3 线性范围及检出限
用HPLC-ICP-MS分析测定干制食用菌中砷的形态,结果如下:方法在1~100 μg/L范围内线性良好。根据检出限的方法,测定砷甜菜碱 AsB、亚砷酸根As(Ⅲ)、二甲基砷 DMA、砷胆碱 AsC、一甲基砷MMA、砷酸根 As(V)的检出限。按照前处理方式称样量为0.5 g,定容量为25 mL,计算该方法各砷形态化合物的定量限分别为0.009、 0.012、0.013、0.010、0.011、0.010 mg/kg,结果见表4。
2.4 方法的精密度
在实际产品中不容易找到同时存在6种砷化合物的样品,本实验混合标准溶液(2.0 μg/L)上机进行测试7次,结果见表4。亚砷酸根As(Ⅲ)、砷酸根As(V)、一甲基砷 MMA、二甲基砷 DMA、砷甜菜碱AsB、砷胆碱 AsC相对标准偏差(RSD%)均<10%,方法精密度良好。
2.5 加标回收实验结果
选取羊肚菌、黑松露两种干制食用菌做加标回收实验,分别向其中添加三个水平(0.80 、5.00、10.00 μg/L)的砷形态混合标准溶液,分析结果见表5。六种砷形态的加标回收率分别在 83.6%~105.5%之间。满足GB/T 27404-2008标准。由此可见,在本实验选定的实验条件下,研究选用的仪器条件和实验方法的可靠性较高。
2.6 标准物质分析测定
用本实验建立的方法对标准物质SRM1568b和GBW(E)100348进行测定,验证方法的准确性,结果见表6,测得标准物质形态砷的总和,无机砷的含量均在标准值范围内。说明在本研究选用的仪器条件和实验方法的准确度较高。
2.7 实际样品的测定
选取市售的9种干制食用菌, 按所建立的HPLC-ICP-MS分析方法考察,其中的无机砷及其他砷形态分布情况详见表7。结果表明:食用菌中砷以各种形态的方式存在,在考察砷污染情况的同时,更应该细化的去了解它的价态组成,总砷含量高的样品,有毒的无机砷含量不一定高,特别是松茸菌。
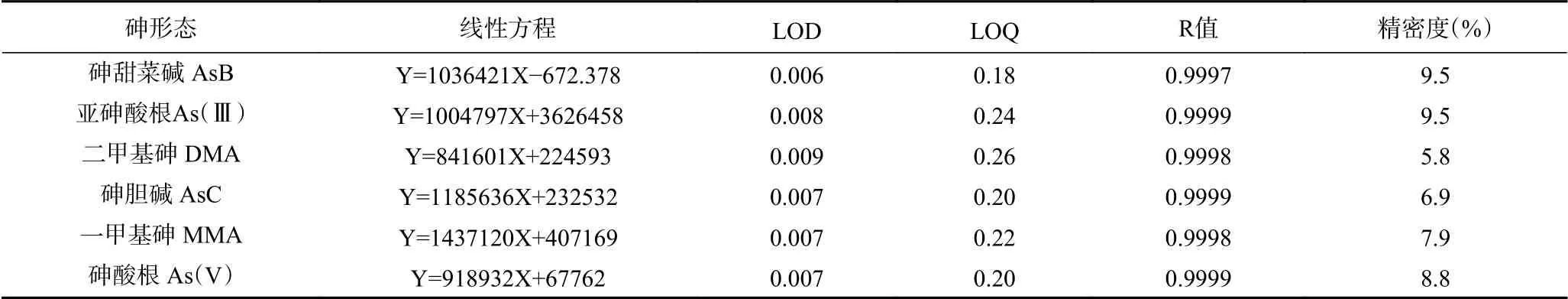
表4 6种砷形态线性回归方程、检出限及精密度(n=7,μg/L)Table 4 Standard curve, limits of detection and precision (relative standard deviation) for six arsenic species (n=7, μg/L)
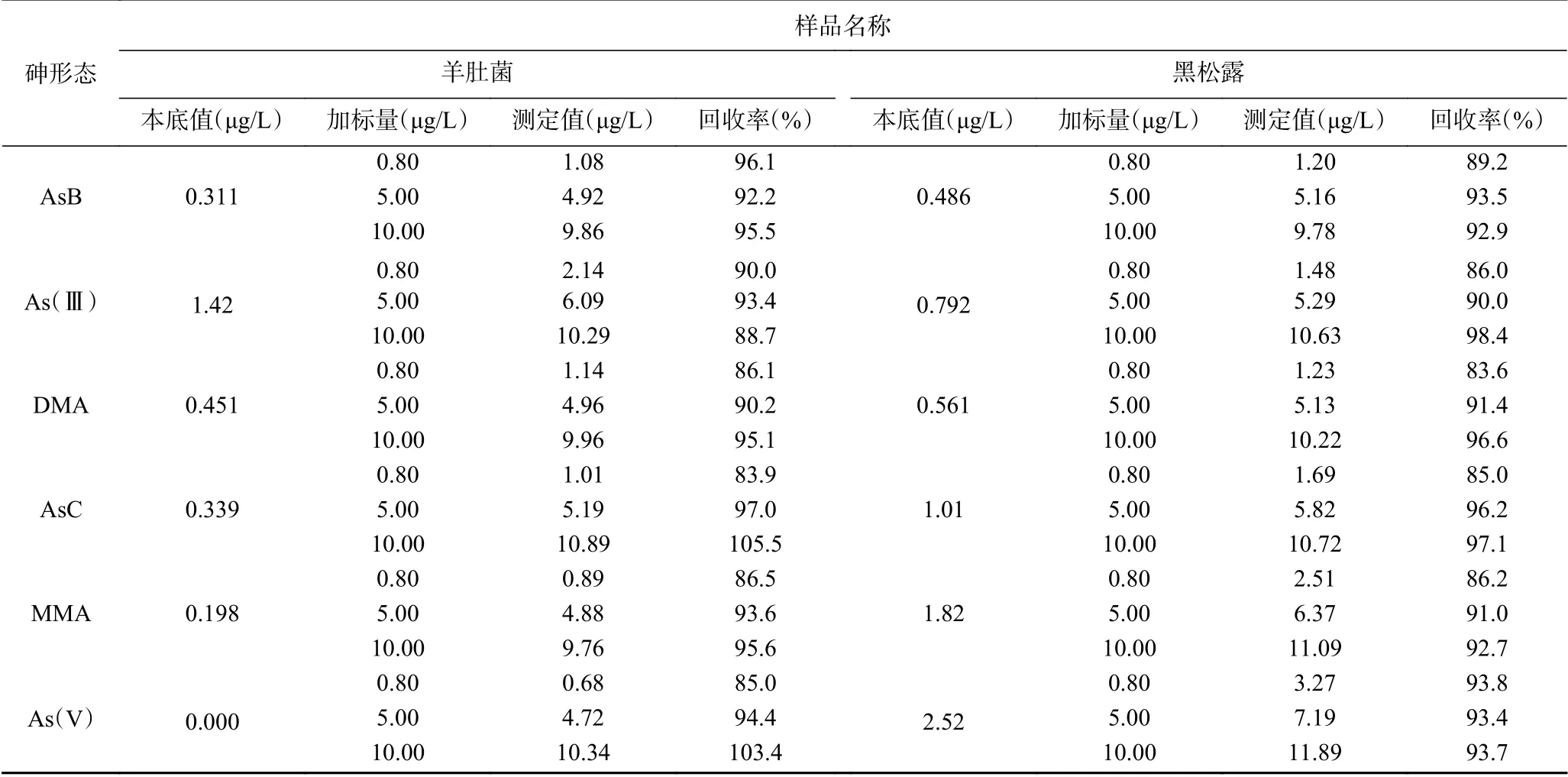
表5 不同样品中砷形态的加标回收率Table 5 Recoveries of arsenic speciation in different samples

表6 标准物质中砷形态的测定结果(mg/kg)Table 6 Results of arsenic speciation in reference materials (mg/kg)
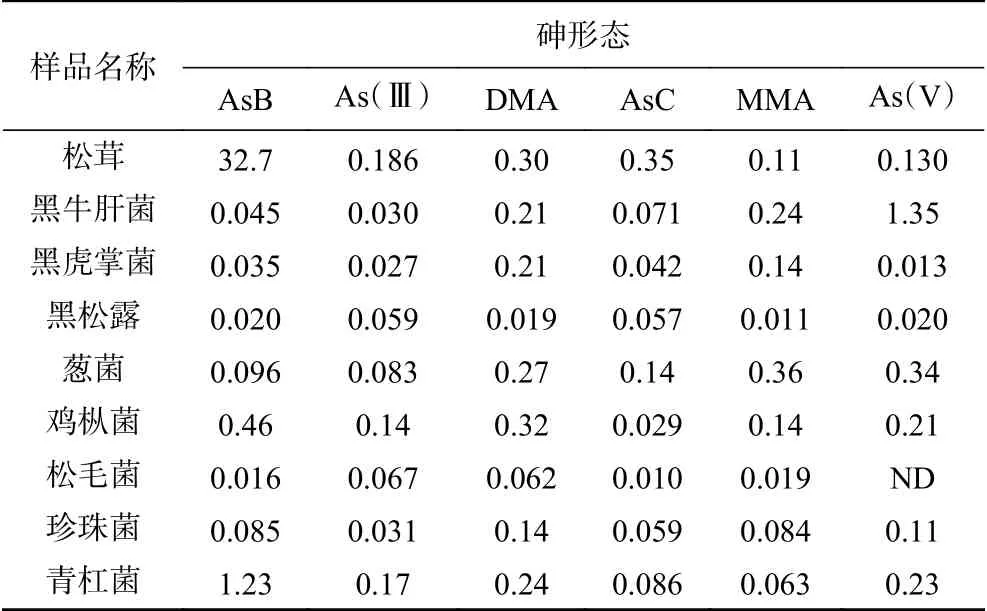
表7 样品中不同价态砷的含量(mg/kg)Table 7 Contents of different valence states of arsenic in samples (mg/kg)
3 结论
HPLC-ICP-MS联用技术分析测定不同砷形态是目前较为先进的检测技术。本文选择的流动相组成和洗脱程序,解决了常用色谱条件下砷形态分离度较差,因样液酸度的不同导致的色谱峰的漂移,As(V)检测灵敏度低和分析时间长等问题。省去了样品前处理时调节pH值这一繁琐的步骤,大大简化了前处理的过程。前处理方式选择了借助微波-酸提取的方法,过程简便、提取完全,砷的形态化合物基本没有发生转化。
本实验通过对提取方式比较和提取条件的优化,建立了微波-酸提结合HPLC-ICP-MS联用测定干制食用菌中6种形态砷化合物的方法。最优提取条件为提取温度110 ℃、提取时间15 min。选用5和100 mmol/L碳酸铵溶液进行梯度洗脱,可以在10 min内实现了砷形态的分离,结果表明:该方法的峰分离效果好,线性关系(r>0.9990),相对标准偏差(RSD%)<10.0% ,6种形态砷的定量限分别为0.009、0.012、0.013、0.010、0.011、0.010 mg/kg,以羊肚菌、黑松露两种基质样品进行加标回收实验,砷形态的加标回收率在83.6%~105.5%之间,采用标准物质验证了方法的准确性良好。所建立的方法灵密度高、准确性好、精密度高、 前处理简单且提取效率高,满足大批量,长时间的干制食用菌中砷形态的定量分析要求。
